L’aumento delle perimplantiti è un problema di emergente attualità. L’eliminazione delle cause che hanno originato la perimplantite richiede analisi batteriche e la rimozione completa del tessuto infetto dalla superficie complessa che costituisce il corpo impiantare con l’obiettivo di sterilizzare la zona e l’impianto stesso. La potenza del laser Er:YAG è assorbita dalle molecole d’acqua in modo tale che la temperatura non si alzi e non si carbonizzi l’obiettivo. È stato dimostrato che questo laser è in grado di favorire la rigenerazione tissutale se usato in ambito clinico nei casi di perimplantite. La cura antibatterica, basata sull’analisi batteriologica e la conseguente terapia rigenerativa con applicazione di laser Er:YAG, viene proposta come trattamento efficace per la perimplantite.
Materiali e metodi
Una donna di 62 anni, con impianti nella zona molare mandibolare di destra posizionati 10 anni fa, tornò nel mio ambulatorio dopo 6 anni di assenza. Lamentava una fastidiosa sensazione in quella zona e la diagnosi, effettuata attraverso l’esame radiografico, fu di perimplantite. L’impianto era del sistema SteriOss, con superficie TPS. Questo caso fu trattato con laser Er:YAG durante la fase di mantenimento dopo la terapia implantare e successivamente alla diagnosi ottenuta tramite esame radiografico. Fu eseguita l’analisi batteriologica con esame PCR-Invader (BML Inc., Japan).
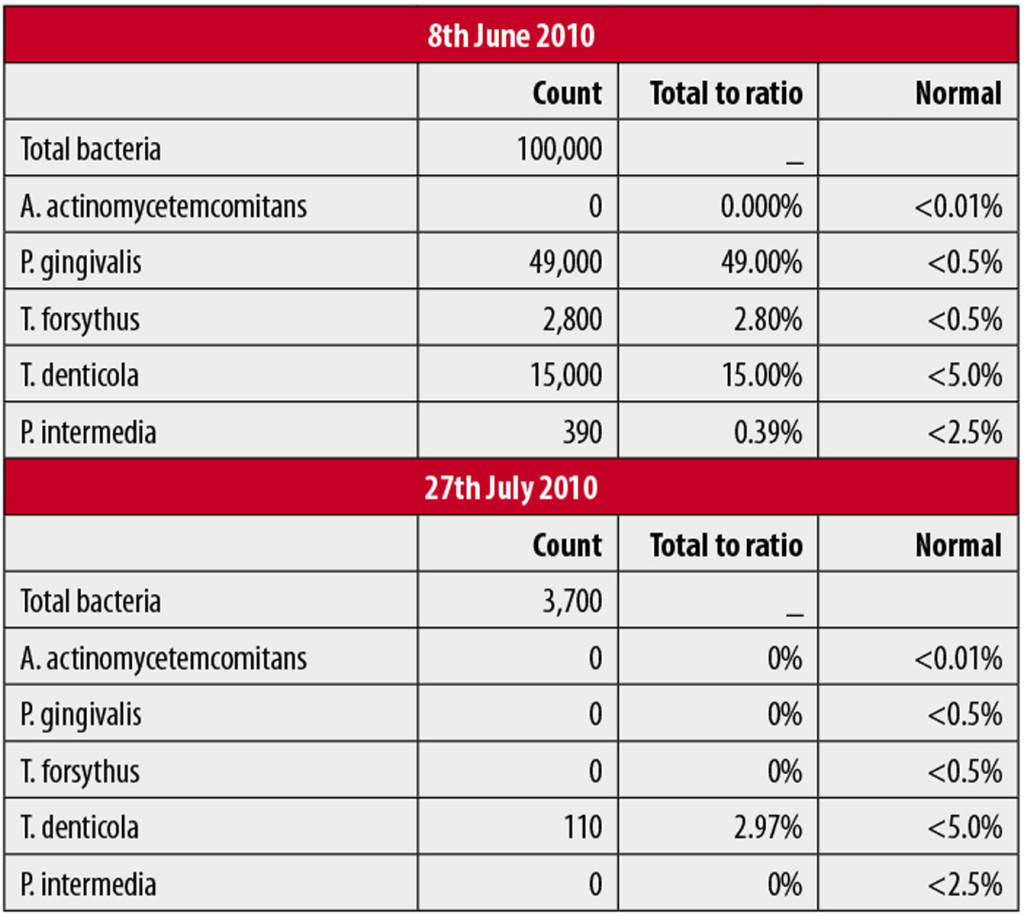
Inizialmente è stata determinata la conta totale dei batteri, il numero per ciascuna flora batterica e il rapporto parziale tra le flore rilevate. Furono riscontrate le seguenti specie batteriche: Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola, Aggrigatibacter actinomycetocomitans e Perovotella intermedia. Questi parametri furono valutati nelle diverse fasi della terapia: immediatamente dopo la diagnosi di perimplantite, dopo la terapia antibiotica e dopo la terapia chirurgica.
In questo caso fu somministrata Amoxicillina combinata con Metronidazolo per quattro settimane e il laser fu utilizzato in seguito alla sterilizzazione. Fu utilizzato il laser Er:YAG (Arwin AdvErL, J. Morita MFG. Corp., Japan) con diversi tipi di punte, come quella a irradiazione diretta (CF400) per la penetrazione nell’osso, quella a irradiazione laterale (P400T) per la pulizia del corpo dell’impianto e la punta a irradiazione diretta e laterale (PS600T) per rimuovere l’epitelio marginale interno del solco implantare. I livelli di impulso in uscita furono scelti da un pannello con parametri prestabiliti e furono rispettivamente di 100 pps 150 mJ, 10 pps 40 mJ, 25 pps 70 mJ. Come materiali da innesto si mescolarono la stessa quantità di FDBA (Oragraft Cortical LifeNet org.) e osso autogeno, che furono impregnati con il fattore di crescita rhPDGF-BB (Gem21s, Osteohealth). Fu posizionata una membrana in acido polilattico (GC Membrane, GC Corp., Japan), fissata tramite la vite di chiusura. Per valutare i tessuti duri, fu effettuata un’analisi di tipo cone beam CT (Veraviewepocs 3D, J. Morita MFG. Corp., Japan) per valutare la massima ampiezza del difetto osseo in senso orizzontale e verticale su sezioni mesio-distali ottenute prima della terapia rigenerativa e dopo 9 mesi.
Risultati
Il test batterico è riportato in Figura 1 e poiché fu possibile evidenziare una percentuale eccessiva di flora di batteri parodontopatici furono somministrati Amoxicillina e Metronidazolo per via orale.
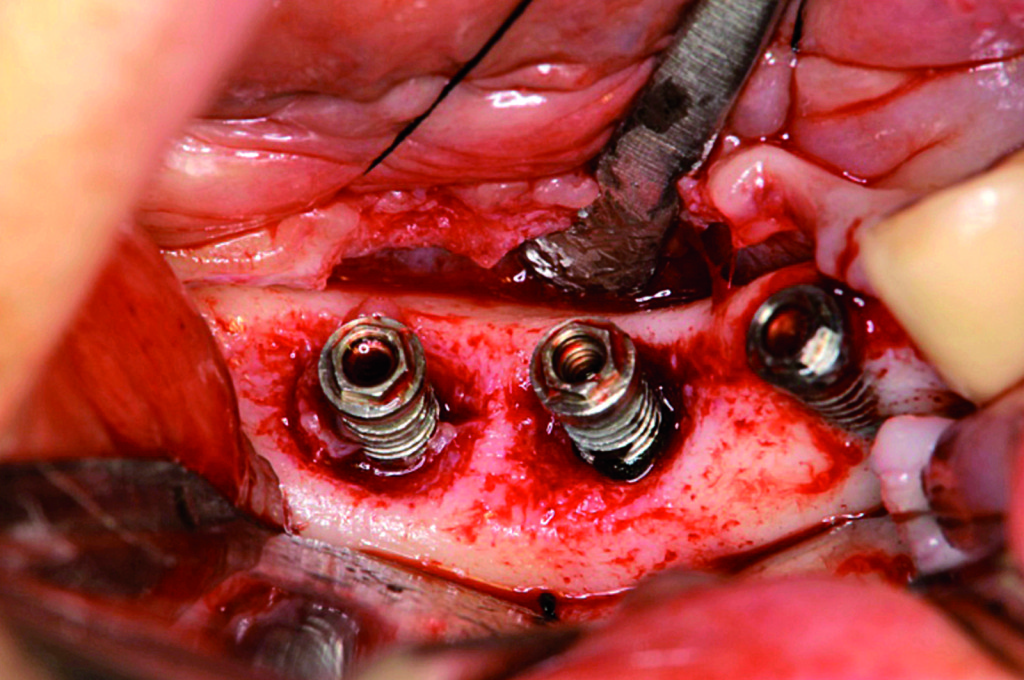
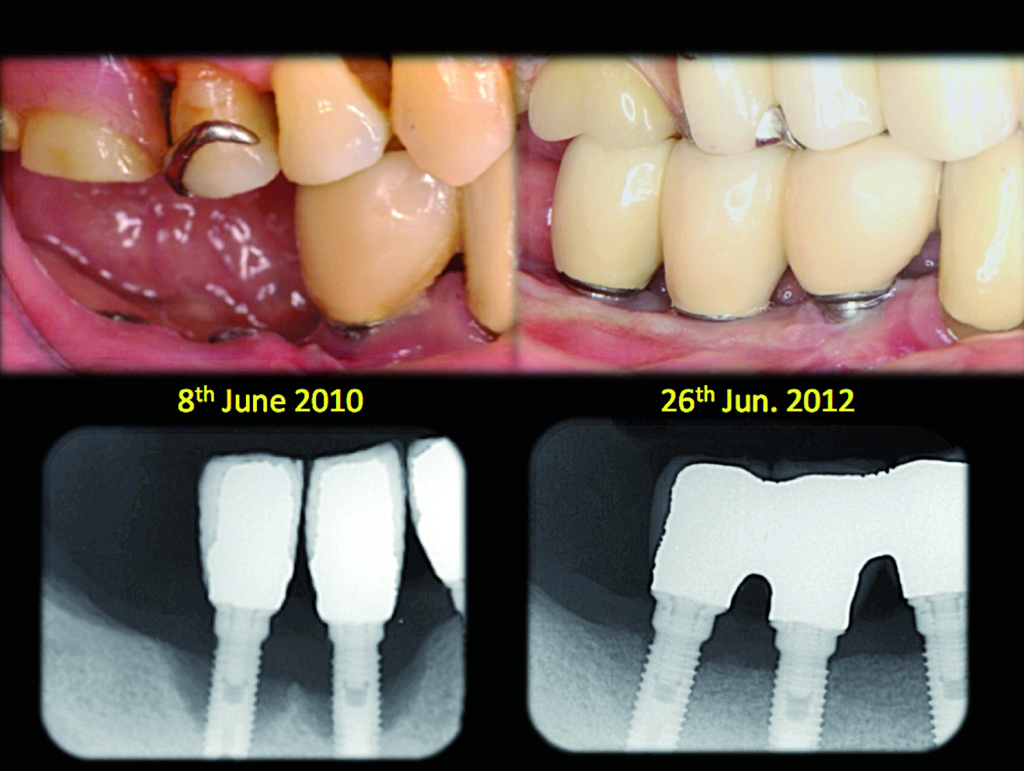
La radiografia panoramica effettuata dopo la terapia antibatterica rivelò un aumento dell’opacità dell’osso. La rimozione del tartaro sottogengivale, l’asportazione del tessuto di granulazione e la disinfezione dell’impianto furono effettuati con il laser Er:YAG e, in seguito, si procedette con la terapia rigenerativa mediante osso autogeno, FDBA, GEM21 e membrana in acido polilattico (Figura 2).
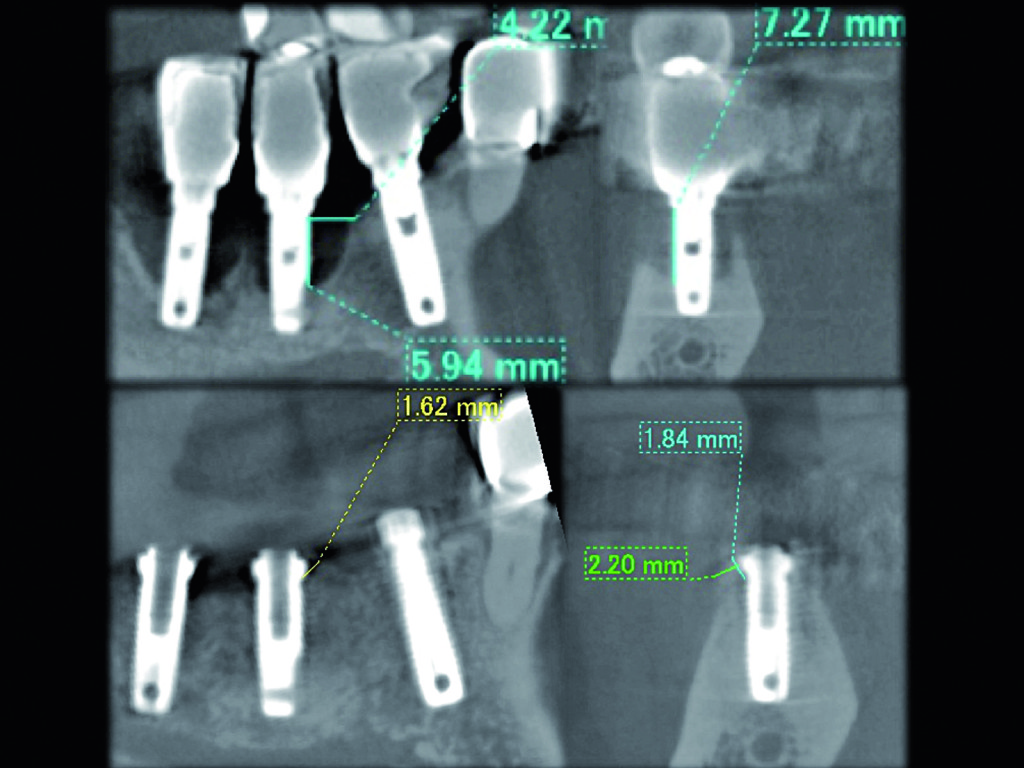
A 9 mesi dalla terapia rigenerativa, l’esame cone beam mostrò una rigenerazione del tessuto osseo precedentemente danneggiato di 4,22 mm in senso orizzontale e 7,21 mm in senso verticale (Figura 3). Questa paziente ha continuato a mostrare buone condizioni di salute del sito fino ad ora.
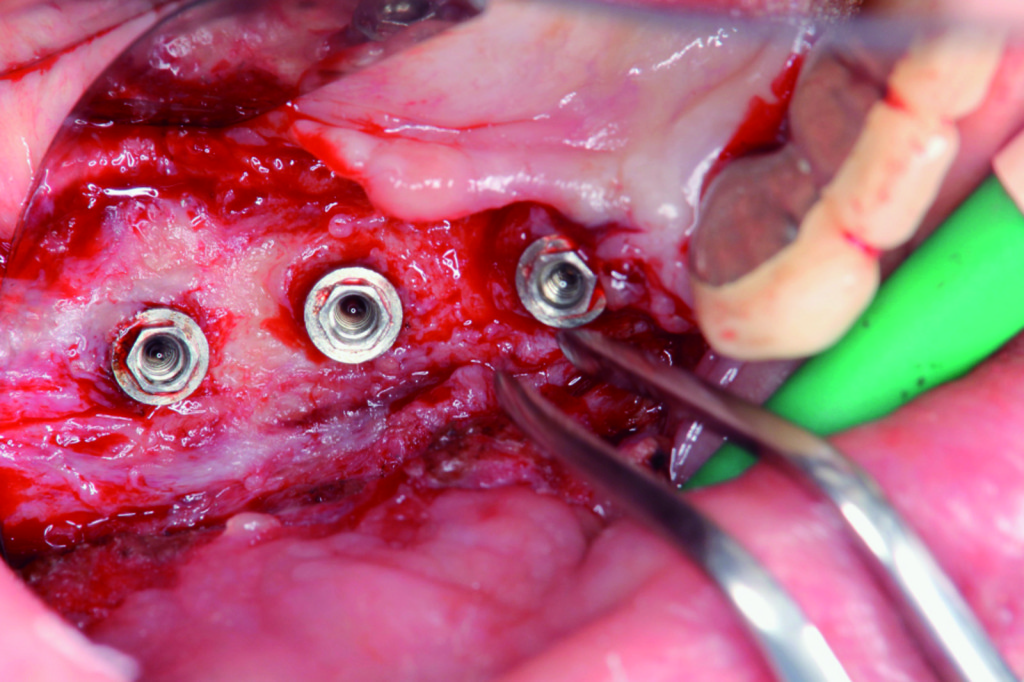
Discussione
La terapia implantare è ormai molto diffusa e probabilmente sta diventando la scelta elettiva per il trattamento delle edentulie parziali. Il trattamento implantare viene effettuato dai dentisti in modo così assiduo che le superfici degli impianti sono state modificate per accelerarne l’osseointegrazione e favorire una miglior biocompatibilità. A questo specifico sviluppo tecnologico è associato un più alto rischio di infezione batterica, con aumento delle perimplantiti. Questa patologia è simile alla malattia parodontale poiché entrambe sono causate da infezione batterica1, ma la differenza è che la prima si manifesta su un corpo estraneo artificiale, benché biocompatibile, posto nell’osso alveolare. In altre parole la peri-implantite è causata dalla terapia implantare stessa. È essenziale quindi proteggere i restanti denti naturali, specialmente quando gli impianti sono usati per sopperire a una perdita di entità ridotta. Dovremmo prima di tutto enfatizzare l’eziologia e la diagnosi, per comprendere le cause e le suscettibilità ambientali per quest’infezione, proseguendo solo in seguito con lo sviluppo della metodologia di trattamento finalizzata all’eliminazione delle cause. Oltre alla terapia antibiotica, è indispensabile ripulire la superficie implantare dal tessuto contaminato senza danneggiarne la superficie e, in seguito, promuovere la formazione di nuovo osso con terapia rigenerativa. L’Er:YAG ha la caratteristica di essere un laser le cui irradiazioni vengono assorbite dalle molecole d’acqua2, prevenendo in questo modo l’aumento di temperatura che potrebbe carbonizzare o causare degenerazione termica ai tessuti vitali3. Il laser Er:YAG può essere utilizzato anche per la resezione dei tessuti parodontali, la levigatura radicolare, l’evaporazione e la rimozione di tessuti vitali come osso e cemento4. Questo dispositivo permette di arrivare alla degenerazione dei tessuti che andranno rimossi senza provocare danneggiamenti, con alterazione termica minima o assente e senza influenzare negativamente la superficie in titanio5. I batteri presenti sulla superficie possono essere eradicati senza che si crei eccessivo calore. Il laser, inoltre, è in grado di detossificare gli LPS, incrementando l’attività di promozione della guarigione delle cellule tissutali6. In caso di perimplantite, il laser Er:YAG può essere anche utilizzato per rimuovere il tessuto contaminato dalla superficie del corpo dell’impianto, eliminare la corticale del tessuto osseo, sterilizzare i tessuti duri e molli danneggiati dalla perimplantite, detossificare l’area dai metaboliti batterici e migliorare la guarigione della ferita attivando i tessuti vitali7. Lo studio in questione mostra come siano stati ottenuti risultati positivi in termini di rigenerazione ossea in una paziente affetta da perimplantite, effettuando terapia antibiotica basandosi sui testi microbiologici e immunologici, seguita da rimozione del tessuto di granulazione dal difetto e la sua sterilizzazione con laser Er:YAG diretto sull’impianto stesso e sui tessuti perimplantari8.
La storia dei criteri diagnostici delle complicazioni su impianti riflette quella dei criteri di successo applicati alla terapia implantare. Nel 1978 l’NIH-Conferenza sullo Sviluppo ad Harvard aveva ritenuto accettabili certi criteri problematici, che non sarebbero mai stati contemplati nell’Era dell’Osteointegrazione, quali la possibilità di consentire movimenti minori di 1 mm in qualsiasi direzione, il riassorbimento verticale d’osso fino a un terzo della lunghezza dell’impianto ecc.10. Nel 1986, Albrektsson introdusse criteri che sono tutt’ora applicabili11. Ad oggi, i principi di successo definiti alla Conferenza di Toronto sull’Osteointegrazione nel 1998 sono considerati lo standard di riferimento. Il riassorbimento osseo verticale considerato accettabile è fino a 0,2 mm per anno a partire da quando l’impianto viene funzionalizzato, il che significa che l’infezione sull’interfaccia di osteointegrazione porta al fallimento rispetto a questo criterio, a eccezione di condizioni di riassorbimento simili causati dal sovraccarico dell’impianto. Il fatto che la flora batterica riscontrata intorno agli impianti sia simile a quella rinvenuta nei denti naturali12-14 e che si trovi flora di batteri parodontopatici sulla superficie di impianti falliti, ci ha convinti che l’infezione perimplantare origini da denti infetti15-17.
È molto importante trattare i difetti parodontali in modo completo ed eradicare la flora batterica di parodontopatici se si dovesse riscontrare una conta batterica alta dai relativi test. Inoltre, è necessario verificare se vi è infezione batterica e monitorare la perdita di attacco. Prima di trattare le perimplantiti vanno completamente eliminati sanguinamento, sondaggio e presenza di essudato purulento: sono condizioni essenziali e basilari così come lo sono nel piano di trattamento parodontale. Lang et al. hanno riassunto tutti questi concetti e stabilito la formula della Cumulative Interceptive Supportive Therapy: CIST18, che viene attualmente considerata una linea guida nel trattamento delle perimplantiti. La flora batterica perimplantare è simile a quella dei denti naturali e sono stati rilevati parodontopatici sulla superficie di impianti falliti. Tuttavia, bisogna valutare in modo comprensivo non solo la flora batterica e la sua conta totale, ma anche la percentuale di ogni specie batterica rilevata, lo status immunitario del paziente e altre condizioni fisiche tipiche dell’individuo prima di scegliere una terapia antibiotica. La scelta di antibiotici per via orale dovrebbe essere basata sulla pubblicazione condivisa dalla AAP e, in aggiunta9, dovremmo considerare questo step come un prerequisito obbligatorio prima di passare alla fase di pulizia della superficie implantare. Generalmente, per promuovere un’integrazione più stabile e veloce, sono realizzate delle microporosità sulla superficie dell’impianto, le quali rendono particolarmente complessa la rimozione meccanica del tessuto infetto dalla superficie implantare. Molti impianti, ad oggi, hanno spire – a differenza di quelli cilindrici – e ciò rende pertanto difficile la pulizia della superficie senza l’utilizzo di strumenti di dimensioni molto piccole. Inoltre, quando si tratta di un dente, anche devitalizzato con grande perdita di supporto, l’effetto dell’antibiotico può essere esercitato passando attraverso il cemento, i tubuli dentinali o il plesso vascolare, mentre nel caso di un impianto, fatto completamente di metallo, la penetrazione è impossibile, anche imbevendone la superficie con prodotti antibatterici. Questo fatto rende impossibile ai leucociti, agli anticorpi e alle citochine di lavorare correttamente nella zona perimplantare. Quando i tessuti sono distrutti dalla malattia perimplantare, infatti, la guarigione spontanea è impossibile. Inoltre, sarà necessario rimuovere la superficie implantare infetta quando la perimplantite sarà progredita sino a una certa gravità. Arrivati a questo punto, crediamo che il laser Er:YAG sia lo strumento ideale per le necessità terapeutiche. L’energia da lui scatenata viene assorbita dalle molecole d’acqua, con un minimo incremento di temperatura, permettendo un minor effetto di carbonizzazione19 e sterilizzando efficacemente la superficie irradiata con effetti minimi sulla superficie di titanio5.
Valutando queste sue capacità, gli Autori considerano il laser Er:YAG la prima scelta nella procedura di decontaminazione e rimozione del tessuto di granulazione dalla superficie implantare. Il metodo convenzionale basato sull’ablazione mediante spray ad aria compressa può essere efficace per la rimozione del tessuto infetto, ma i microgranuli possono penetrare e residuare nei tessuti molli. Il laser Er:YAG è in grado non solo di superare questo problema, ma può agire detossificando gli LPS5,20 e accelerando i fenomeni di guarigione tissutale se confrontato con gli altri metodi disponibili7. La foto-terapia, che include la terapia laser, non richiede il contatto diretto con gli oggetti, quindi il fascio può irradiare in diverse direzioni, lateralmente e frontalmente. Questa caratteristica rende il laser Er:YAG particolarmente efficace sulla complessa struttura implantare.
Conclusioni
La terapia rigenerativa dei tessuti perimplantari, persi a causa della perimplantite, basata sui test batterici e terapia antibiotica, seguiti da irradiazione del sito con laser Er:YAG, viene suggerita come un metodo terapeutico efficace.
Ringraziamenti
Gli Autori desiderano ringraziare fortemente la J. Morita Corp. per i fondamentali consigli sull’utilizzo del dispositivo laser.
Corrispondenza
Toshiaki Yoshino
Yoshino-do@nifty.com
Toshiaki Yoshino1
Yoshihiro Ono2
1Studio privato, Yoshino Dental Office Perio-Implant Center, Yokohama, Japan
2Studio privato, Kiwakai Dental Office Perio-Implant Center,
Tokyo, Japan
2. Hale GM, Querry MR. Optical Constants of Water in the 200-nm to 200-microm Wavelength Region. Appl Opt 1973;12(3):555-63. 3. Aoki A, Sasaki KM, Watanabe H, Ishikawa I. Lasers in nonsurgical periodontal therapy. Periodontol 2000 2004;36:59-97. 4. Folwaczny M, Benner KU, Flasskamp B, Mehl A, Hickel R. Effects of 2.94 microm Er:YAG laser radiation on root surfaces treated in situ: a histological study. J Periodontol 2003;74(3):360-5. 5. Tomoko Matsuyama, Akira Aoki, et al. Effects of the Er:YAG Laser Irradiation on Titanium Implant Materials and Contaminated Implant Abutment Surfaces. Journal of Clinical LaserMedicine & Surgery 2003;21( 1):7-17. 6. Folwaczny Met. Al Removal of bacterial endotoxin from root surface with Er:YAG laser. Am J Dent 2003;16(1):3-5. 7. Aleksic V, Aoki A, Iwasaki K, Takasaki AA, Wang CY, Abiko Y, Ishikawa I, Izumi Y. Low-level Er:YAG laser irradiation enhances osteoblast proliferation through activation of MAPK/ERK. Lasers Med Sci 2010;25(4):559-69. Epub 2010 Feb 26. 8. Takasaki AA, Aoki A, et al. Er:YAG laser therapy for peri-implant infection: a histological study. Lasers Med 2007;22:143-157. 9. Califano JV. Research, Science and Therapy Committee American Academy of Periodontology. Position paper: periodontal diseases of children and adolescents. J Periodontol 2003;74(11):1696-704. 10. Grunder U, Gracis S, Capelli M. Influence of the 3-D bone-to-implant relationship on esthetics. Int J Periodontics Restorative Dent 2005;25(2):113-9. 11. Albrektsson T, Zarb G, Worthington P, Eriksson AR. The long-term efficacy of currently used dental implants: a review and proposed criteria of success. Int J Oral Maxillofac Implants 1986;1(1):11-25. 12. Friberg B, Jemt T, Lekholm U. Early failures in 4,641 consecutively placed Brånemark dental implants: a study from stage 1 surgery to the connection of completed prostheses. Int J Oral Maxillofac Implants 1991;6(2):142-6. 13. Quirynen M, Listgarten MA. Distribution of bacterial morphotypes around natural teeth and titanium implants ad modum Brånemark. Clin Oral Implants Res 1990;1(1):8-12 14. Mombelli A, Marxer M, Gaberthüel T, Grunder U, Lang NP. The microbiota of osseointegrated implants in patients with a history of periodontal disease. J Clin Periodontol 1995;22(2):124-30. 15. Pontoriero R, Tonelli MP, Carnevale G, Mombelli A, Nyman SR, Lang NP. Experimentally induced peri-implant mucositis. A clinical study in humans. Clin Oral Implants Res 1994;5(4):254-9. 16. Mombelli A, Lang NP. Antimicrobial treatment of peri-implant infections. Clin Oral Implants Res 1992;3(4):162-8. 17. Rosenberg ES, Torosian JP, Slots J. Microbial differences in 2 clinically distinct types of failures of osseointegrated implants. Clin Oral Implants Res 1991;2(3):135-44. 18. Lang NP, et al. Consensus statements and recommend clinical procedures regarding implants survival and complications. Int Oral Maxillofac Implants 2004;19 Suppl:150-154. 19. Yoshino T, Aoki A, Oda S, Takasaki AA, Mizutani K, Sasaki KM, Kinoshita A, Watanabe H, Ishikawa I, Izumi Y. Long-term histologic analysis of bone tissue alteration and healing following Er:YAG laser irradiation compared to electrosurgery. J Periodontol 2009;80(1):82-92. 20. Folwaczny Met. Al Removal of bacterial endotoxin from root surface with Er:YAG laser. Am J Dent 2003;16(1):3-5. 21. Folwaczny M. Antimicrobial effects of 2.94 microm Er:YAG laser radiation on root surfaces: an in vitro study. J Clin Periodontol 2002;29(1):73-8.





