Riassunto
Scopo. Valutare l’efficacia in vitro di un dispositivo sperimentale per l’irrigazione canalare che sfrutta il principio del “vuoto”.
Metodologia. Sono stati selezionati 52 elementi dentari monocanalari, estratti di recente, ed eseguite delle sezioni a 12,5 mm dall’apice radicolare. Nei due millimetri più coronali è stato realizzato un serbatoio per l’irrigante tale da simulare la camera pulpare. I campioni sono stati preparati attraverso tecnica crown-down. Al momento del test i campioni di ogni gruppo sono stati inoculati con 0,05 ml di brodocoltura (107 UFC di Staphylococcus aureus) e suddivisi in modo random in 4 gruppi. Gruppo A (n=2): controllo positivo per la quantizzazione della carica batterica iniziale; Gruppo B (n=2): controllo negativo per la verifica della sterilità iniziale dei campioni; Gruppo C (n=24): irrigazione con tecnica tradizionale NaOCl 0,52%; Gruppo D (n=24): irrigazione con Dental AID NaOCl 0,52%. I dati ottenuti sono stati raccolti e analizzati statisticamente (test Anova, significatività fissata al 95%).
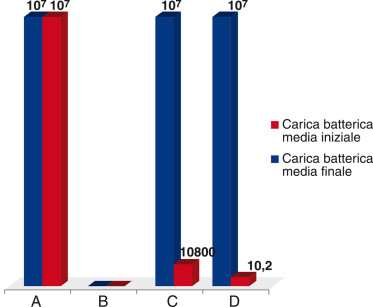
Risultati. I risultati mostrano fra i gruppi C e D una differenza statisticamente significativa nel numero di colonie batteriche residue, attribuendo alla tecnica del vuoto una discreta efficacia. È stata altresì rilevata una differenza statisticamente significativa fra i gruppi D e C e i gruppi di controllo positivo (A) e negativo (B).
Conclusioni. Dai dati ottenuti si evidenzia come il DentalAID rappresenti un presidio efficace nel potenziamento delle procedure di irrigazione canalare anche se la sua validità deve essere confermata da studi clinici.
Summary
Microbiological evaluation of a new device for endodontic irrigation
Aim. Evaluate in vitro efficacy of a new experimental device for endodontic irrigation with vacuum technique.
Methodology. 52 single rooted freshly extracted teeth were selected and sectioned at the cement-enamel junction. A 2 millimeters reservoir was created in the coronal part of the canals. Specimens were prepared with endodontic Ni-Ti rotary instruments using crown-down technique. All specimens were inoculated with 0,05 ml broth culture of Staphylococcus aureus (107 CFU) and randomly divided into 4 groups: Group A (n=2) positive control; Group B (n=2) negative control; Group C (n=24) irrigating with syringe NaOCl 0,52%; Group D (n=24) irrigating with DentalAID NaOCl 0,52%. Data were collected and statistically analyzed (Anova = significance at 95%).
Results. Demonstrated that groups C and D showed a significant decrease of bacterial charge when compared to control; the new device provided significantly best results when compared with the group C.
Conclusions. Results show that the new device could be a useful tool in improving irrigating, even if further studies are necessary to evaluated the new technology.
Il trattamento endodontico ha come obiettivo quello di ottenere un’adeguata alesatura del sistema dei canali radicolari associata alla disinfezione dello spazio endodontico e alla rimozione di batteri, tossine e dei substrati organici e inorganici presenti o formatisi durante la strumentazione. È bene precisare come tale finalità si realizzi non solo attraverso la strumentazione meccanica ma anche e soprattutto con l’impiego degli irriganti canalari secondo i principi dello shaping and cleaning introdotti da Schilder1,2.
Tali considerazioni sono avvalorate da diverse fonti presenti in letteratura che ben testimoniano come anche con l’impiego di strumenti endodontici di ultima generazione una percentuale variabile fra il 20 e il 40 per cento delle pareti canalari rimanga esclusa dalla preparazione meccanica3-8.
Appare pertanto evidente la necessità di ricercare soluzioni irriganti sempre più efficaci cui associare tecniche sempre più performanti. Una soluzione irrigante per essere considerata ideale deve possedere specifici requisiti, alcuni dei quali in antitesi fra loro: a) elevato potere germicida e antibatterico, b) assenza di effetti tossici o irritanti per i tessuti periapicali, c) dissoluzione dei tessuti e del materiale organico presenti all’interno dei canali, d) impedimento della formazione dello smear layer o facilitazione della sua rimozione senza decalcificare i tessuti dentali, e) azione lubrificante che favorisca la penetrazione degli strumenti canalari, f) tensione superficiale sufficientemente bassa da permettere il raggiungimento di tutte le aree non accessibili con gli strumenti, g) mantenimento in sospensione dei residui dentinali prodotti dalla preparazione meccanica (caratteristica questa legata invece a un’alta tensione superficiale), h) innocuità per paziente e operatore.
In relazione a quanto sopra evidenziato si può affermare come, ad oggi, nessuna soluzione irrigante possa essere considerata ideale; quindi, ai fini di una idonea detersione, l’unico mezzo è rappresentato dall’utilizzo sinergico di più soluzioni irriganti.
In quest’ottica la migliore associazione è rappresentata dall’utilizzo iniziale dell’ipoclorito di sodio (NaOCl) seguito dall’EDTA che agisce sullo smear layer9,10.
Difatti lo NaOCl presenta due proprietà che lo rendono indispensabile per ottenere una corretta endodonzia: efficace azione antibatterica, grazie all’ampio spettro d’azione, ed effetto di dissoluzione dei residui organici. Le concentrazioni più efficaci per ottenere i suddetti effetti sono comprese fra il 5 e il 5.25%11-14. Concentrazioni maggiori consentono di ottenere una miglior dissoluzione dei tessuti necrotici ma comportano inevitabilmente un maggior rischio di effetti collaterali (necrosi, sintomatologia post-operatoria) in caso di estrusione oltre apice.
In quest’ottica nel corso degli anni diversi Autori hanno cercato di incrementare l’effetto dello NaOCl mantenendo invariata la sua concentrazione, andando ad agire su altre variabili quali ad esempio la temperatura15,16. Difatti si è potuto constatare che aumentando la temperatura di utilizzo dello NaOCl, in un range compreso fra 37° e 50°, si registrava un incremento dell’azione dissolvente dell’irrigante. Viceversa l’attivazione dell’irrigante attraverso gli ultrasuoni sembra non incrementarne in alcun modo le capacità proteolitiche17.
Diversi studi in merito alle capacità di rimozione dei residui inorganici (smear layer) dimostrano come l’ipoclorito non sia assolutamente in grado di assolvere a tale compito18,19.
In relazione a quanto sopra evidenziato è necessario utilizzare agenti chelanti, tra cui un ruolo di assoluto rilievo è assunto dallo EDTA. Questa sostanza, introdotta in endodonzia per facilitare l’azione meccanica e la progressione degli strumenti endodontici, si è rivelata poi particolarmente efficace nella rimozione dello smear layer20-24. La migliore azione chelante si esplica a concentrazioni comprese tra 10% e 17%25. Va comunque sottolineato come sebbene l’azione dello EDTA sullo smear layer sia in genere efficace, non offre altrettante garanzie in aree difficilmente raggiungibili quali il terzo apicale, canali laterali ecc26-29.
Infatti, come emerso in diversi studi presenti in letteratura, sebbene nel corso degli anni siano state affinate sistematiche di preparazione chemiomeccanica del sistema canalare sempre più efficaci non è possibile, ad oggi, detergere completamente l’intero spazio endodontico30-33.
In virtù delle problematiche operative sopra espresse appare evidente la necessità da parte dell’endodontista di poter disporre di presidi in grado di consentire un’adeguata penetrazione degli irriganti anche nelle aree anatomiche di più difficile accesso.
Scopo del presente lavoro in vitro è stato quello di valutare l’efficacia di un dispositivo sperimentale per l’irrigazione canalare (DentalAID) di nuova concezione e in via di commercializzazione.
Materiali e Metodi
DentalAID
Il sistema DentalAID è un dispositivo di irrigazione endocanalare che sfrutta il principio del “vuoto”. Esso consta di due componenti: 1) un corpo macchina in cui sono integrati un sistema di aspirazione ad alta velocità, una pompa per irrigazione canalare, due distinti serbatoi e un apparato di riscaldamento per l’irrigante, 2) una particolare siringa da irrigazione.
Questa è provvista di un ugello da cui fuoriesce la soluzione irrigante e di un alloggiamento in cui vanno inseriti i puntali di aspirazione: una macrocannula (#55 ISO) in materiale plastico, con estremità aperta, oppure una microcannula (#32 ISO) in acciaio inossidabile, con estremità chiusa e 12 fori laterali disposti in quattro file.
Attraverso i controlli presenti sul corpo del dispositivo è possibile impostare l’entità del flusso (in ml/min) e la temperatura (in °C) della soluzione irrigante.
È inoltre possibile scegliere se attivare o meno il sistema di aspirazione e selezionare dai due serbatoi presenti l’irrigante da utilizzare. Una volta impostati questi parametri, il dispositivo viene azionato direttamente attraverso uno switch presente sulla siringa.
Durante l’irrigazione con tale congegno, l’irrigante viene espulso a pressione all’interno del canale radicolare. La pressione negativa determinata dall’aspirazione ad alta velocità del puntale attrae l’irrigante in senso apicale determinando un intimo contatto con le pareti canalari.
Allestimento delle colture batteriche
Per il test è stato selezionato un ceppo di collezione di Staphylococcus aureus in forma liofilizzata. Il ceppo è stato sottoposto a un doppio passaggio di reidratazione e così rivitalizzato. Le colture ottenute sono state poste in 10 Eppendorf contenenti 0,5 ml di BHI (Brain Heart Infusion) e congelate poi a -20 °C. Due giorni prima di eseguire il test è stata scongelata una delle Eppendorf contenenti la brodocoltura. Il suo contenuto è stato quindi inoculato in una provetta contenente 10 ml di BHI e posto in incubazione a 37 °C. Il giorno prima del test la coltura è stata “ripassata” prelevandone 0,01 ml e inoculandola in una nuova provetta contenente 10 ml di BHI. Il giorno del test la provetta è stata vortexata per 30 secondi al fine di renderne più omogeneo il contenuto. Da questa provetta è stata prelevata la brodocoltura poi inoculata nelle radici servendosi di una siringa da insulina il cui ago, particolarmente sottile, ha permesso di riempire senza vuoti i campioni radicolari.
In questo modo si sono realizzate colture con colonie in fase di crescita logaritmica ricreando un ambiente del tutto simile alle condizioni che clinicamente si realizzano nel sistema dei canali radicolari34,35: 107 UFC (Unità Formanti Colonie).
Preparazione dei campioni dentali
Per realizzare il test sono stati selezionati 52 elementi dentari monocanalari, estratti di recente. La selezione dei campioni è stata effettuata secondo i seguenti criteri:
- assenza di lesioni cariose e/o precedenti trattamenti di conservativa;
- canali radicolari rettilinei e ampi per trattenere una quantità adeguata di brodocoltura.
Gli elementi sono stati immersi per circa 3 ore in una soluzione di ipoclorito di sodio al 5,25%. Successivamente la superficie esterna dell’elemento dentario è stata accuratamente detersa, attraverso delle currettes, e lavata in acqua distillata per rimuovere ogni residuo di tessuto molle o calcificato.
Quindi, tramite dei dischi abrasivi diamantati, sono state eseguite delle sezioni a 12,5 mm dall’apice radicolare. La lunghezza di lavoro è stata determinata attraverso un K-file #10 introdotto nel canale fino a osservarne la fuoriuscita dal forame apicale. Alla misurazione ottenuta sono stati poi sottratti 0,5 mm.
I segmenti radicolari così ottenuti sono stati poi preparati con strumenti rotanti Ni-Ti (K3, SybronEndo, Orange, CA, USA) secondo la tecnica crown-down, utilizzando come ultimo strumento all’apice un file 35/.06 taper. Come file di pervietà è stato utilizzato lo stesso k-file #10 impiegato per determinare la lunghezza di lavoro. A livello dei due millimetri più coronali delle radici è stato inoltre realizzato, attraverso l’impiego di frese Gates Glidden #6, una sorta di serbatoio per l’irrigante in modo da simulare una camera pulpare. Dopo l’utilizzo di ogni strumento e al termine della preparazione, i campioni sono stati abbondantemente irrigati utilizzando EDTA in soluzione 17% (Smear Clear SybronEndo, Orange, CA, USA) per facilitare la rimozione dello smear layer, e NaOCl 5,25% (Niclor 5, Ogna, Milano) per rimuovere eventuali residui organici. La scelta di elementi dentari con anatomia canalare semplice e la rimozione della corona, con realizzazione di una camera pulpare artificiale, sono state effettuate al fine di ottenere dei campioni dentali standardizzati (con morfologia endodontica molto simile). Tutti i campioni radicolari sono stati sterilizzati in autoclave (120 °C a 2 Atm) e mantenuti in asepsi attraverso delle provette monouso, ermetiche e sterili fino all’esecuzione del test.
I campioni ottenuti sono stati identificati con numeri da 1 a 52 e suddivisi in modo random in 4 gruppi:
- Gruppo A: controllo positivo (n. 2 campioni) quantizzazione carica batterica iniziale;
- Gruppo B: controllo negativo (n. 2 campioni) verifica della sterilità iniziale dei campioni;
- Gruppo C: irrigazione con tecnica tradizionale NaOCl 0,52% (n. 24 campioni);
- Gruppo D: irrigazione con DentalAID NaOCl 0,52% (n. 24 campioni).
Test di irrigazione in vitro
Al momento del test i campioni di ogni gruppo sono stati inoculati con 0,05 ml di brodocoltura contenente 107 UFC, a eccezione del gruppo B (controllo negativo).
Sui campioni del gruppo A non è stato effettuato alcun trattamento sebbene siano stati tenuti insieme a quelli degli altri gruppi durante tutti i passaggi del test. Questo accorgimento è stato adottato per escludere accidentali perdite di colonie e verificare l’effettiva carica batterica di partenza.
Stesso procedimento è stato attuato per i campioni del gruppo B che però non sono stati né inoculati né trattati. Quanto descritto è stato necessario al fine di escludere eventuali contaminazioni accidentali.
I campioni del gruppo C sono stati irrigati con NaOCl 0,52 % (Niclor 5 diluzione 1/10), utilizzando una siringa in plastica da 5 ml provvista di un ago 30-gauge. L’ago è stato introdotto passivamente nel canale sino a 3 mm dal forame apicale, verificando che non si impegnasse contro le pareti canalari. È stato quindi effettuato un ciclo di irrigazione canalare di 30 secondi, depositando circa 2,5 ml di soluzione. Durante quest’operazione sono state effettuate con l’ago delle piccole escursioni in senso corono-apicale per migliorare la dinamica del flusso irrigante. Al termine del ciclo la soluzione è stata lasciata agire nel canale per ulteriori 30 secondi, quindi è stata aspirata dal canale attraverso un ago da aspirazione 30 gauge posto a 3 mm dalla lunghezza di lavoro.
I campioni del gruppo D sono stati trattati mediante tecnica del vuoto (DentalAID). Sul terminale del dispositivo è stata applicata una macrocannula (#55 conicità ISO), e il serbatoio è stato caricato con NaOCl 0,52%. La macrocannula è stata introdotta passivamente nel canale fino a 3 mm dal forame apicale, sempre prevenendo il suo impegno contro le pareti canalari. Con tale metodica è stato effettuato un ciclo di irrigazione canalare di 30 secondi, adottando un flusso di irrigazione di 5 ml/min, ed effettuando anche in questo caso delle escursioni alternate in senso corono-apicale.
Al termine del ciclo la soluzione è stata lasciata agire nel canale per altri 30 secondi e successivamente aspirata mediante la macrocannula stessa. Al termine di ogni trattamento i campioni dei gruppi C e D sono stati introdotti singolarmente in provette contenenti 0,5 ml di tiosolfato in soluzione al fine di neutralizzare l’NaOCl residuo a contatto dei campioni, limitando così l’azione dell’irrigante ai 60 secondi del trattamento.
Esame microbiologico
I campioni così trattati sono stati inviati in laboratorio. Le provette del gruppo A sono state vortexate per 30 secondi e, dopo le opportune diluizioni (10-3-10-4), il loro contenuto è stato seminato per spatolamento su di una piastra di Petri contenente 5 ml di terreno solido selettivo e differenziale costituito da MSA (mannitol salt agar). Il contenuto delle provette B, C e D è stato invece riversato interamente, senza diluzione, sulla piastra di Petri contenente lo stesso terreno di coltura. Le piastre cosi ottenute sono state incubate in aerobiosi a 37 °C per 48 ore. Trascorso tale intervallo di tempo, necessario al completo sviluppo delle colonie, si è proceduto al loro conteggio tramite metodo visivo.
Analisi statistica
L’analisi statistica è stata eseguita con test Anova e la significatività è stata fissata al 95%.
Risultati
I risultati ottenuti mostrano fra i gruppi C e D una differenza statisticamente significativa nel numero di colonie batteriche residue, attribuendo quindi alla tecnica del vuoto una migliore efficacia (figura 1). È stata altresì rilevata, come era logico presupporre, una differenza statisticamente significativa (tabella 1) fra i valori iniziali e finali dei gruppi D e C e i gruppi di controllo positivo (A) e negativo (B).
Discussione
L’efficacia del processo di detersione è sensibilmente influenzata dalle proprietà chimiche e fisiche della soluzione irrigante. Dalla composizione chimica dipendono: potere germicida e antibatterico, capacità di dissoluzione dei residui organici e inorganici, tossicità tissutale ecc11-14,36. Le caratteristiche fisiche in grado di influenzare l’efficacia dell’irrigante invece sono rappresentate da temperatura, viscosità, pressione e velocità, volume di soluzione in grado di raggiungere il sito d’azione ecc15,16,37,38. Alla luce di questi concetti si può dedurre che mentre le proprietà chimiche dipendono unicamente dalla natura intrinseca di ciascuna soluzione e possono quindi essere considerate costanti, le caratteristiche fisiche rappresentano delle variabili sulle quali si può agire per potenziare l’effetto detergente della soluzione, ad esempio variando la tecnica di irrigazione. Il presente lavoro è stato condotto impiegando NaOCl 0,52% proprio al fine di svincolarne quanto più l’azione fisica da quella chimica. La cannula di aspirazione dell’apparato per il vuoto riesce a creare in prossimità del forame apicale una pressione negativa che attrae con forza la soluzione irrigante e ne determina un intimo contatto con le pareti canalari. Attraverso tale metodica l’irrigante, al di là della sua efficacia chimica nel dissolvere tessuti organici e inorganici, diventa uno strumento meccanico di detersione che permette di veicolare la soluzione irrigante sino alla lunghezza di lavoro, condizione indispensabile per una completa pulizia canalare. L’importanza di questo fenomeno è inoltre particolarmente evidente a livello di quelle superfici canalari che non possono essere strumentate (circa il 20-40%) in cui il processo di detersione è interamente affidato agli irriganti3-8. Dai risultati ottenuti con il dispositivo testato si evidenzia una più efficace disinfezione del sistema canalare rispetto alla tecnica convenzionale: infatti quanto più tessuto infetto si rimuove tanto più tale azione si verifica. Ne deriva anche la validità concettuale di eseguire una detersione “potenziata” a fine sagomatura, quando non si produce più fango dentinale e il canale è stato sagomato con conicità e diametro adeguato, cosicché è possibile inserire più agevolmente aghi o cannule nei pressi dell’apice.
 È documentato38 come la diminuzione del diametro dell’ago e/o della sua distanza dal forame apicale, al fine di aumentare l’entità del flusso di irrigante a questo livello, incrementino di pari passo il rischio di estrusione oltre apice della soluzione (in particolare se si aumenta la spinta sul pistone della siringa). Le probabilità che tale evenienza si verifichi, come confermato in da Fukumoto et al39, sono notevolmente ridotte dall’utilizzo della tecnica del vuoto, in quanto la cannula di aspirazione confina efficacemente il flusso del’irrigante all’interno del canale. La biocompatibilità del processo di irrigazione viene quindi a essere incrementata mediante la tecnica del vuoto in quanto si ottiene un maggiore controllo del flusso di irrigante e si ha, inoltre, la possibilità di ridurne la concentrazione36. Nella realizzazione dello studio è stato selezionato sul dispositivo testato un flusso di irrigazione pari a 5 ml/min, parametro questo sovrapponibile a quello erogato in media con la tecnica convenzionale adottata (ago 30 gauge) durante la pratica clinica38. Il dispositivo testato presenta però la possibilità di incrementare il getto fino a un massimo di 15 ml/min. L’incremento del flusso di irrigazione rappresenta uno dei principali metodi per potenziare l’efficacia della soluzione irrigante, sia perché se ne amplifica ulteriormente l’azione meccanica, sia perché se ne determina un costante ricambio. Altro parametro su cui si può agire tramite il dispositivo è la temperatura. È infatti possibile incrementare la temperatura della soluzione fino a 50 °C, potenziandone così ulteriormente il potere detergente.
È documentato38 come la diminuzione del diametro dell’ago e/o della sua distanza dal forame apicale, al fine di aumentare l’entità del flusso di irrigante a questo livello, incrementino di pari passo il rischio di estrusione oltre apice della soluzione (in particolare se si aumenta la spinta sul pistone della siringa). Le probabilità che tale evenienza si verifichi, come confermato in da Fukumoto et al39, sono notevolmente ridotte dall’utilizzo della tecnica del vuoto, in quanto la cannula di aspirazione confina efficacemente il flusso del’irrigante all’interno del canale. La biocompatibilità del processo di irrigazione viene quindi a essere incrementata mediante la tecnica del vuoto in quanto si ottiene un maggiore controllo del flusso di irrigante e si ha, inoltre, la possibilità di ridurne la concentrazione36. Nella realizzazione dello studio è stato selezionato sul dispositivo testato un flusso di irrigazione pari a 5 ml/min, parametro questo sovrapponibile a quello erogato in media con la tecnica convenzionale adottata (ago 30 gauge) durante la pratica clinica38. Il dispositivo testato presenta però la possibilità di incrementare il getto fino a un massimo di 15 ml/min. L’incremento del flusso di irrigazione rappresenta uno dei principali metodi per potenziare l’efficacia della soluzione irrigante, sia perché se ne amplifica ulteriormente l’azione meccanica, sia perché se ne determina un costante ricambio. Altro parametro su cui si può agire tramite il dispositivo è la temperatura. È infatti possibile incrementare la temperatura della soluzione fino a 50 °C, potenziandone così ulteriormente il potere detergente.
Conclusioni
Il processo di detersione rappresenta sicuramente un punto cardine della terapia endodontica. Sarebbe auspicabile, vista l’importanza di questa fase per il raggiungimento di un’idonea disinfezione canalare (indispensabile per trattamenti di successo), arrivare a un miglioramento tecnologico e dei protocolli. La difficoltà di tale standardizzazione scaturisce dalle innumerevoli variabili che vanno valutate durante la fase di irrigazione: diametro dell’ago, profondità di inserzione, pressione dell’irrigante, durata dell’irrigazione, volume della soluzione, temperatura ecc. Molti di questi parametri, inoltre, sono operatore-dipendenti e soggetti quindi a un certo grado di empirismo.
L’introduzione di un dispositivo in grado di controllare simultaneamente tutti questi parametri potrebbe allora essere d’aiuto nel fornire delle linee guida per le attività di ricerca, facilitando al contempo la realizzazione di protocolli standardizzati, in particolare per quel che concerne l’entità del flusso irrigante e il tempo d’azione. La possibilità di trasformare questi parametri in un semplice valore numerico, da impostare sul dispositivo, potrebbe semplificare la comunicazione in ambito clinico e di ricerca. Questo studio sperimentale, comunque, andrà supportato da test clinici per verificare la reale validità della metodica proposta.
Corrispondenza
Dottor Valerio Milana
Via Collatina, 76 – 00177 Roma
e-mail: v.milana@unicampus.it
• Valerio Milana
• Luca Testarelli
• Francesco Rizzo
• Stefano Petti
• Gianluca Gambarini
Sapienza Università di Roma, Corso di Laurea Specialistica in Odontoiatria e Protesi Dentaria, Insegnamento di Endodonzia,
Titolari Proff. G. Gambarini, L. Testarelli





