Tilman Eberhard
Freimut Vizethum
Riassunto
Le infezioni del cavo orale associate al biofilm, come la parodontite recidiva cronica, aggressiva e la periimplantite rappresentano anche al giorno d’oggi una grande sfida per la pratica clinica. Sono stati documentati i risultati di un nuovo protocollo terapeutico su 70 pazienti con questa diagnosi. Si è analizzato l’effetto clinico dell’applicazione della terapia fotodinamica antimicrobica secondo il metodo HELBO® su 1683 unità (denti + impianti) considerando il decorso clinico e la flora batterica per un periodo di 5 anni. Grazie all’applicazione sistematica del metodo terapeutico HELBO® nell’ambito di questo protocollo si è osservata inizialmente una diminuzione significativa della presenza di batteri parodonto-patogeni e a lungo termine si è notato anche un notevole miglioramento delle profondità di sondaggio parodontali e perimplantari e dell’indice di sanguinamento.
La terapia fotodinamica antimicrobica secondo il metodo HELBO® risulta essere efficace per il trattamento mininvasivo della parodontite e della perimplantite e aiuta in modo efficiente il mantenimento a lungo termine dei denti.
Parole chiave: fotodinamica, minimamente invasiva, Helbo, parodontiti, periimplantiti, profilassi
Summary
Results of a 5-year study on photodynamic therapy with HELBO® Photodynamic Systems as a minimally invasive adjuvant treatment of periodontitis and periimplantitis. A longitudinal cohort study
Biofilm-related infections in the oral cavity such as aggressive, chronic and recurrent periodontitis and peri-implantitis continue to pose significant challanges for clinical practice. The results of a new therapeutic protocol on 70 patients with this diagnosis have now been documented.The Authors have analyzed the clinical effect of antimicrobial photodynamic therapy with HELBO® Photodynamic Systems on 1,683 units (teeth + implants), with a specific focus on the clinical course of the disease and the bacterial flora over a period of 5 years. Thanks to the systematic application of the HELBO® therapeutic approach in the framework of this protocol, an initial significant reduction was observed in the number of periodontal pathogenic bacteria. In addition, a long-term substantial improvement was recorded in periodontal and peri-implant Probing Depth and Bleeding On Probing (BOP) Indices. The research evidence shows that Antimicrobial Photodynamic Therapy with HELBO® Photodynamic Systems is an effective minimally invasive treatment for periodontitis and peri-implantitis and helps to maintain teeth in the long term.
Key words: photodynamic, minimally invasive, Helbo, periodontitis, periimplantitis, prophylaxis
Per il trattamento delle infiammazioni associate al biofilm, un obiettivo importante sembra essere la rimozione del biofilm patogeno dalla superficie radicolare subgengivale, ma il tasso di successo della decontaminazione meccanica (debridement) nella terapia parodontale diminuisce con l’aumento della profondità di sondaggio e la presenza di forcazioni17,27,30. Si ottiene infatti molto raramente la rimozione completa dei depositi batterici in vivo10 e riserve batteriche persistono nelle aree non accessibili. Per mantenere risultati stabili a lungo termine è quindi necessario eseguire una terapia di supporto a intervalli ravvicinati regolari. Le terapie antimicrobiche di supporto tradizionali spesso non danno miglioramenti a lungo termine. Allo stesso modo con l’irrigazione subgengivale di soluzioni antibatteriche la sostanza antisettica riesce ad arrivare solo nella metà marginale della tasca parodontale18, mentre l’efficacia di un lavaggio orale senza irrigazione5 è limitata all’area sopragengivale. L’utilizzo di protocolli di trattamento invasivi, con la somministrazione per via sistemica di antibiotici, deve essere considerato piuttosto criticamente1 per quanto riguarda il carattere cronico della malattia, i gravi effetti collaterali e la formazione di resistenze.
Da alcuni anni sono noti i successi terapeutici della terapia fotodinamica antimicrobica (aPDT, ditta Bredent medical, HELBO®, Walldorf, Germania) come terapia aggiuntiva mininvasiva. Grazie a questa terapia è possibile ottenere un’efficace riduzione dei batteri normalmente di 2-4 potenze decimali nelle aree raggiunte da uno speciale colorante e poi esposte a una luce al laser di bassa intensità3,4,8,14,36. Ciò avviene grazie alla stimolazione, attivata dalla luce laser, di una molecola di colorante fotoattiva sulla parete batterica che passa allo stato di tripletto, uno stato quantico ad alta energia. Successivamente, per un trasferimento d’energia sulle molecole d’ossigeno localmente presenti si formano molecole d’ossigeno singoletto estremamente aggressive. L’ossigeno singoletto, con l’ossidazione lipidica, distrugge localmente le strutture essenziali della parete batterica ed elimina così i microrganismi colorati. Grazie alla limitata diffusione dell’ossigeno singoletto, che è inferiore a 0,2 µm16, si evitano danni nell’area circostante. Anche nel caso di virus e funghi si suppone vi sia un simile meccanismo d’eliminazione32,35. Si presuppone anche un effetto diretto della terapia aPDT sui fattori virulenti della popolazione batterica23. Inoltre, l’effetto biodinamico della LILT (low intensity laser therapy) favorisce una riduzione del dolore33, una veloce remissione dell’infiammazione e la rigenerazione dei tessuti interessati31.
I pazienti con impianti e un’anamnesi di parodontite cronica o aggressiva mostrano maggior profondità di sondaggio a lungo termine, perdita ossea marginale perimplantare e segni di periimplantite se confrontati con pazienti sani dal punto di vista parodontale22. Attualmente, il biofilm e l’attività batterica vengono riconosciuti come cause della mucosite perimplantare e della periimplantite, proprio come per la parodontite. Essi causano infatti l’infiammazione e l’alterazione del tessuto7,26. La mucosite perimplantare colpisce 4 pazienti su 5 e la periimplantite dal 25% al 56% di tutti i pazienti con impianti2. Gli Autori sostengono la necessità di una decontaminazione come presupposto per ogni successo terapeutico. Tuttavia, tale richiesta, come spiegato precedentemente, è di difficile realizzazione con una terapia antisettica convenzionale. L’utilizzo della terapia fotodinamica antimicrobica, per il suo particolare meccanismo per la decontaminazione, risulta essere, per lo studio odontoiatrico, un’alternativa terapeutica per pazienti con parodontite sia senza impianti che con impianti. Il presente studio di coorte longitudinale è stato iniziato allo scopo di analizzare gli effetti a lungo termine della terapia per la parodontite e periimplantite e le possibilità cliniche con un utilizzo anche profilattico.
Letteratura
Nella letteratura scientifica l’efficacia dei processi fotodinamici era già nota da tempo, ma per un lungo periodo20 non ha avuto rilevanza clinica e non ha suscitato l’interesse per una vasta applicazione pratica. In ambito odontoiatrico, fino alla fine del secolo scorso, gli studi si limitavano prevalentemente a prove in vitro o su animali14,20. Sono stati i lavori, per esempio, di Dobson14, Haas19, Dörtbudak15 e Wilson35 a fornire le prime indicazioni sulla valenza clinica di questa terapia. Tuttavia anche i concetti terapeutici e di tecnologia medicale non erano maturati completamente a quel tempo e si trovavano a un livello tecnico poco sviluppato. Ulteriori studi hanno comunque dimostrato l’efficacia della fotodinamica nella riduzione di batteri in vitro nei batteri planctonici e nella parodontite indotta da legature e nella periimplantite in esperimenti su animali. Si è potuto vedere che l’utilizzo della terapia aPDT ha un’influenza importante sulla riduzione di Aggregatibacter actinomycetemcomitans (A.a.) e influisce direttamente sull’espressione di citochine12,13.
Altri studi hanno dimostrato che è possibile ridurre sia i batteri gram-positivi che quelli gram-negativi25,29,34. In uno studio in vitro si è potuto verificare se anche nel biofilm si ottiene l’efficacia della aPDT28. Questo lavoro mostra infatti che la terapia fotodinamica antimicrobica riesce a ridurre batteri in grado di riprodursi anche nel modello di biofilm artificiale. Decisivi per l’utilizzo futuro sono stati lo sviluppo e lo studio di protocolli terapeutici corrispondenti. Oggi esistono diversi studi clinici su questioni rilevanti. Nella valutazione degli effetti della aPDT nel trattamento della parodontite aggressiva in vivo senza precedente igiene orale professionale, l’aPDT e l’SRP (scaling and root planing) mostrano risultati clinici simili11. In uno studio randomizzato, facendo un confronto tra quadranti, si è potuto vedere che con un protocollo di trattamento semplice su pazienti affetti da parodontite cronica i risultati della terapia di igiene orale professionale convenzionale potevano essere migliorati con l’utilizzo aggiuntivo della aPDT6.
L’efficacia di un unico trattamento con aPDT sui segni d’infiammazione parodontale con tasche refrattarie poteva essere dimostrato anche 6 mesi dopo il trattamento9. Uno studio randomizzato doppio cieco ha analizzato gli effetti di una terapia intensiva sui parametri parodontali nei casi refrattari24. L’utilizzo ripetuto ha mostrato un notevole miglioramento di questi parametri nel gruppo aPDT. La letteratura lascia quindi supporre un effetto clinico efficace della terapia aPDT con un utilizzo sistematico in parodontologia. Proprio per verificare gli effetti a lungo termine nella terapia per la parodontite e periimplantite e le possibilità cliniche con un utilizzo anche profilattico, 6 anni fa si è iniziato il presente studio di coorte longitudinale.
Concetto dello studio, materiali e metodi
Il gruppo di pazienti presi in considerazione nello studio comprende 70 soggetti, di cui 2/3 donne, 1/3 uomini. All’inizio di questo studio l’età media dei pazienti era di 54 anni; essi erano in cura parodontologica nello stesso studio odontoiatrico da un minimo di 2 anni a un massimo di 19 anni, in media da 14 anni. Nei pazienti inseriti poi nello studio non è stato riscontrato nessun risultato stabile nonostante una regolare terapia tradizionale e profilassi. Per tutti i pazienti è stata fatta la diagnosi di parodontite persistente cronica o aggressiva o di perimplantite.
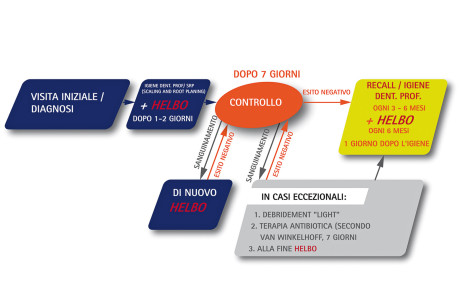
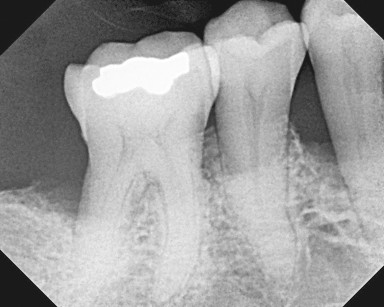
All’inizio del nostro studio tutti i pazienti sono stati curati in base a uno schema terapeutico fisso comprendente la terapia fotodinamica antimicrobica. Si è utilizzato il sistema terapeutico HELBO® della ditta Bredent medical, Walldorf, composto dal fotosensibilizzatore HELBO® Blue, una soluzione sterile di cloruro di fenotiazina, un laser a bassa intensità con una lunghezza d’onda di 660 nm, una potenza dei diodi di 100 mW e una potenza delle fibre ottiche di ca. 40 mW. Questo sistema è stato approvato dal 2003 per tutte le indicazioni in ambito orale. Il laser a diodi HELBO® è montato su un manipolo ergonomico che pesa solo 80 grammi; la trasmissione della luce laser nella tasca avviene tramite sonde sterili monouso con irraggiamento tridimensionale. Il fotosensibilizzatore è fornito sterile in apposite siringhe (Figura 1). Tutti i pazienti sono stati sottoposti al test microbiologico Meridol-Parotest (GABA):
- prima di cambiare terapia;
- 1 settimana dopo la prima terapia;
- dopo sei mesi.
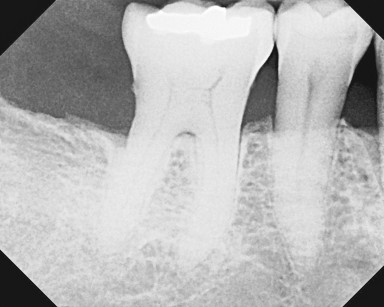
 In tutte le unità (denti + impianti) è stata misurata regolarmente nel tempo la profondità della tasca mesiale e distale. Dopo la terapia iniziale, comprendente l’igiene dentale professionale, se necessario un deep scaling e la terapia fotodinamica in una seduta separata, secondo lo schema terapeutico (Figura 2), nell’ambito dei recall semestrali seguiva sempre una pulizia professionale delicata con terapia fotodinamica aggiuntiva. Quest’ultima veniva eseguita entro uno o due giorni dalla pulizia dentale professionale. Contemporaneamente, per valutare la tendenza al sanguinamento, si è utilizzato un SBI modificato (indice di sanguinamento del solco gengivale) con una scala da 0 a 3:
In tutte le unità (denti + impianti) è stata misurata regolarmente nel tempo la profondità della tasca mesiale e distale. Dopo la terapia iniziale, comprendente l’igiene dentale professionale, se necessario un deep scaling e la terapia fotodinamica in una seduta separata, secondo lo schema terapeutico (Figura 2), nell’ambito dei recall semestrali seguiva sempre una pulizia professionale delicata con terapia fotodinamica aggiuntiva. Quest’ultima veniva eseguita entro uno o due giorni dalla pulizia dentale professionale. Contemporaneamente, per valutare la tendenza al sanguinamento, si è utilizzato un SBI modificato (indice di sanguinamento del solco gengivale) con una scala da 0 a 3:
- 0 = assenza di sanguinamento al sondaggio;
- 1 = sanguinamento puntiforme al sondaggio;
- 2 = sanguinamento superficiale al sondaggio;
- 3 = solco/papilla pieni di sangue.
Nei casi di tasche perimplantari con una profondità superiore a 6 mm, nel primo trattamento è stato inoltre eseguito un attento curettage dei tessuti molli.
Opzione terapeutica B
Se dopo la seconda applicazione della terapia HELBO® (al giorno zero e dopo 7 giorni) nel controllo successivo, dopo ancora 7 giorni, si diagnosticava un sanguinamento persistente a un sondaggio leggero, si prescriveva come opzione terapeutica l’assunzione di antibiotici per una settimana (van Winkelhoff-Cocktail: metronidazolo e amoxicillina). Alla fine della settimana si eseguiva di nuovo l’aPDT. Questo perchè l’aPDT rende inattive le tasche e il biofilm che esse contengono; tuttavia non vengono raggiunti in profondità i germi aggressivi presenti nei tessuti come gli A.a. (Actinobacillus actinomycetemcomitans) o P.g. (Porphyromonas gingivalis). Ciò viene assicurato con la terapia antibiotica adiuvante, mentre la successiva aPDT provvede all’eliminazione dei batteri che si sono depositati nelle tasche gengivali. Anche per questo gruppo è stato stabilito un recall semestrale. La Figura 2 mostra lo schema terapeutico della terapia per la parodontite e periimplantite integrata con la terapia fotodinamica antimicrobica.
Risultati
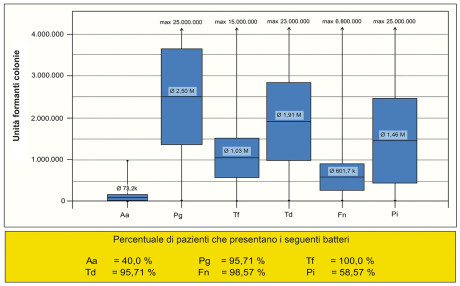
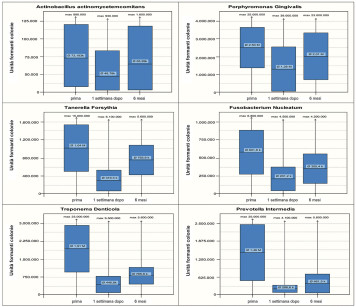
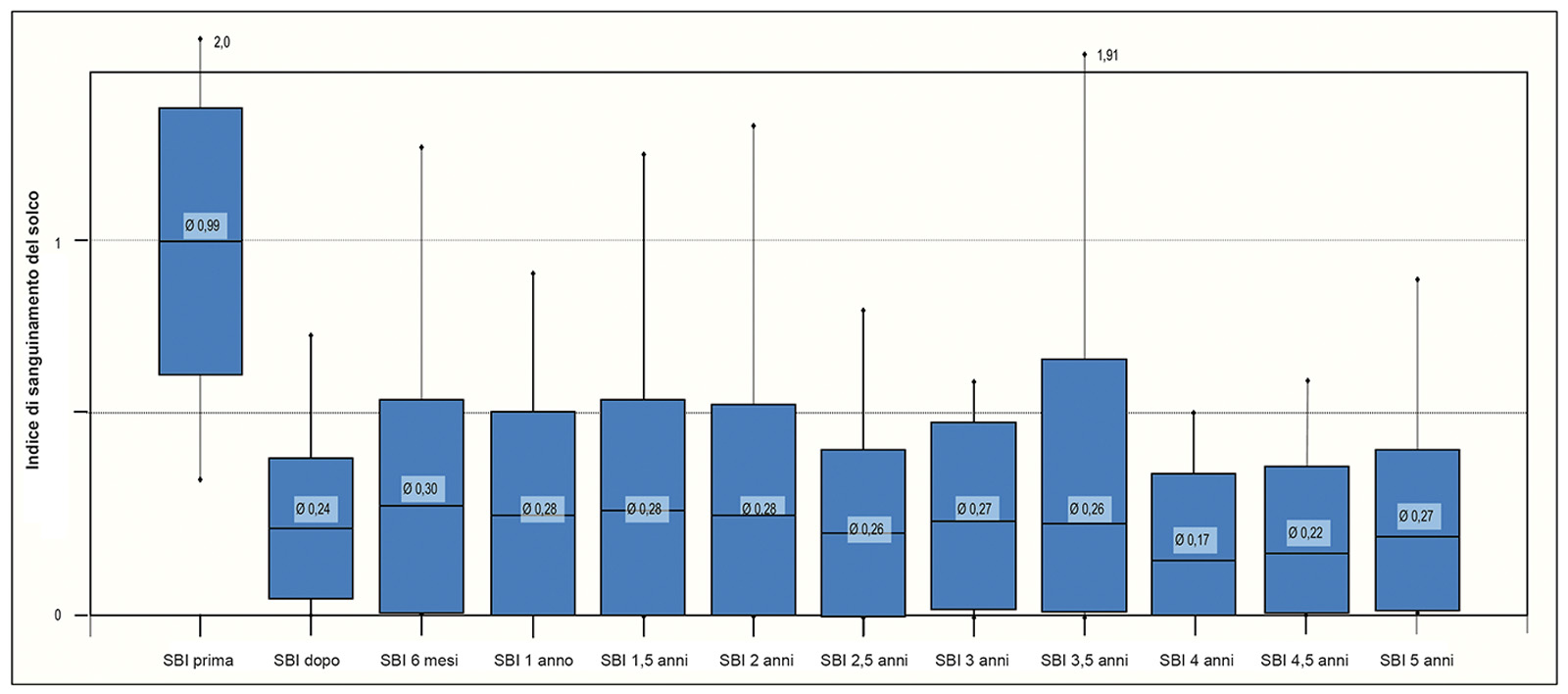
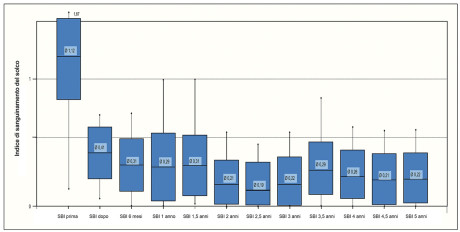
Il test microbiologico (Diagramma 1a) mostra il quadro iniziale prima di cambiare terapia. Sia i germi A.a. che quelli P.g. erano chiaramente presenti rispettivamente con una percentuale del 40% e 95%. Nel Diagramma 1b si nota inizialmente una diminuzione dei batteri parodonto-patogeni una settimana dopo la terapia. Dopo sei mesi una parte dei germi parodonto-patogeni si trovava sempre a un livello basso, mentre una parte era aumentata leggermente e un’altra marcatamente. Nell’ambito del trattamento con il protocollo standard descritto, senza misure aggiuntive, si è potuto osservare una notevole diminuzione dell’infiammazione in 53 pazienti che presentavano una parodontite recidiva cronica o aggressiva. Ciò è dimostrato dalla diminuzione dell’indice di sanguinamento modificato del solco gengivale (Diagramma 2).
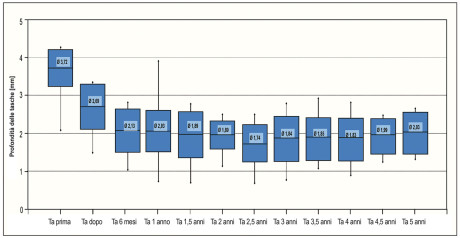
Già dopo una settimana dalla terapia il valore medio scende da 0,99 a 0,2 e per un periodo di 5 anni rimane stabile in un range compreso tra 0,3 e 0,2. Non si constata una tendenza all’aumento con il passare del tempo. Con il passaggio alla terapia HELBO® la profondità media delle tasche dei pazienti diminuisce già una settimana dopo il trattamento: nella media di tutte le tasche si passa da 3,5 mm a 2,4 mm. Al primo recall si constata un’ulteriore diminuzione con una profondità di 2,1 mm. Questo valore rimane invariato nell’arco dei 5 anni considerati (Diagramma 3). Il numero medio di tasche con una profondità di sondaggio tra 4 e 6 mm, come misura della stabilità parodontale, si riduce già dopo una settimana da 21,3 a 6,6; dopo un anno raggiunge il valore di 3,3 e dopo 5 anni è pari a un valore medio di 2,6 (Diagramma 4). Se si considera il numero di tasche con una profondità maggiore di 6 mm si ottiene un risultato simile; comunque, grazie al lungo periodo di trattamento preventivo, fin dall’inizio il numero di queste tasche è più basso (Diagramma 5).
Opzione terapeutica B
In 17 pazienti (20%), chiaramente affetti da batteri A.a. e contemporaneamente da un’elevata concentrazione di P.g., nel controllo dopo 14 giorni si riscontrava ancora la tendenza al sanguinamento persistente. In base all’opzione terapeutica B si è quindi proceduto, dopo un altro lieve debridement, con un trattamento antibiotico secondo van Winkelhoff per una settimana, seguito direttamente dalla terapia fotodinamica. Nel decorso successivo questi pazienti mostrano, con la stessa identica terapia, gli stessi miglioramenti clinici dei soggetti non sottoposti a trattamento antibiotico. L’indice modificato di sanguinamento del solco come scala del grado d’infiammazione diminuisce da 1,1 a 0,4 e rimane in un range compreso tra 0,3 e 0,2 nei follow-up eseguiti da 0,5 fino a 5 anni (Diagramma 6). Non si sono presentate recidive. La profondità media delle tasche dei pazienti sottoposti a terapia antibiotica diminuisce da 3,7 a 2,7 mm con il cambio della terapia e dopo sei mesi raggiunge un valore di 2,1. Nella media di tutte le tasche, anche in questo gruppo di pazienti la profondità delle tasche rimane, per un periodo d’osservazione di 5 anni, in un range compreso tra 2,0 e 1,7 mm senza alcun ulteriore trattamento antibiotico (Diagramma 7).
Non si sono registrate recidive. La terapia dopo la somministrazione antibiotica corrispondeva in tutti gli aspetti a quella del gruppo standard (Figure 3-4). DiscussioneCon il nuovo schema terapeutico descritto si riscontra una diminuzione iniziale dei batteri parodonto-patogeni una settimana dopo la terapia. Dopo sei mesi una parte dei germi patogeni è a un livello molto basso, un’altra parte è lievemente aumentata e un’altra ancora mostra una chiara crescita. Tuttavia, questo nuovo aumento non sembra avere nessun effetto clinico per quanto riguarda i parametri parodontali e il grado d’infiammazione. Ciò potrebbe essere interpretato come indizio di un notevole miglioramento del comportamento di difesa locale del tessuto precedentemente malato. La presenza di batteri patogeni come A.a., P.g., P.i., T.d. e T.f. non può essere valutata come l’unico fattore decisivo per l’insorgenza di esacerbazioni infiammatorie7. Si può riscontrare l’Aggregatibacter actinomycetemcomitans sia in condizioni di salute parodontale che in tutte le forme di parodontite21. Anche nel tessuto perimplantare l’insorgenza di batteri patogeni non sembra essere l’unico fattore associato all’infiammazione perimplantare26. Si evidenzia così l’importanza dei parametri clinici nella valutazione del decorso della malattia, mentre non sembra abbia senso un monitoraggio del “Fingerprint” batterico del paziente. I dati a lungo termine raccolti confermano ciò molto chiaramente. I segni clinici di infiammazione e le profondità delle tasche si sono ridotti significativamente e sono rimasti stabili per un periodo di 5 anni. Nell’ambito dello studio gli intervalli per i recall e per l’aPDT erano stati fissati a 6 mesi, ma al di fuori delle condizioni dello studio dovevano continuare a essere decisi individualmente. In questo modo ci si aspetta ancora un leggero miglioramento in singoli casi.
Come misura mininvasiva, sembra giustificato l’utilizzo regolare dall’assenza di recidive ed esso può essere interpretato quasi come una sovraterapia, soprattutto considerando il miglioramento della situazione infiammatoria orale di pazienti con condizioni parodontali instabili da molti anni. La terapia fotodinamica antimicrobica aggiuntiva secondo il metodo HELBO®, nel periodo d’osservazione di 5 anni, nell’ambito di questo studio di coorte longitudinale ha mostrato un notevole successo nella cura e nella profilassi per la parodontite e sembra aprire nuove possibilità terapeutiche in questo settore. Importanti sono il controllo una settimana dopo la prima terapia ed eventualmente la cura supplementare per le tasche che continuano a sanguinare a un attento esame con la sonda. Se anche nel secondo controllo dopo 14 giorni il risultato della terapia non fosse soddisfacente, si consiglia una terapia antibiotica secondo Winckelhoff con un’ulteriore aPDT (schema terapeutico Figura 2). In seguito ci si aspetta risultati stabili anche in questo gruppo di pazienti. In caso di resistenza alla terapia si consiglia un consulto internistico. Con l’utilizzo del metodo HELBO® in futuro l’indicazione per la terapia sistemica antibiotica nel trattamento della parodontite sarà sempre più limitato. Viene a mancare completamente l’indicazione per una somministrazione locale di antibiotici che favorisce resistenze.
Nell’ambito dello studio è stato eseguito un precedente debridement almeno per allentare il biofilm. I risultati di questo studio di 5 anni non possono assolutamente essere trasferiti all’utilizzo di altri sistemi terapeutici fotodinamici e ad altri schemi di trattamento. Ancora oggi variano importanti parametri nei sistemi di protocolli disponibili, per esempio per tipo, concentrazione e modo d’utilizzo del fotosensibilizzatore, per tipo d’applicazione, fonte luminosa terapeutica efficace, lunghezza d’onda, densità energetica e potenza specifica della luce stimolante e per percorso terapeutico. Fondamentale è la collaborazione del paziente, poiché senza una buona igiene orale individuale non si possono mantenere i risultati osservati. I costi della terapia fotodinamica antimicrobica aggiuntiva, anche in caso di un utilizzo regolare, rimangono in un ambito che non rappresenta alcun problema per quasi tutti i pazienti che sono abituati alla profilassi.
Corrispondenza
Tilman Eberhard
Untere Zeiselbergstr. 18
D- 73525 Schwäbisch Gmünd
Tel. +49 (0)7171-2435
info@zahnarzt-eberhard.de
Freimut Vizethum
Am Mannaberg 7
D-69231 Rauenberg
Tel. +49 (0)6222-6840398
info@evidea.net