Riassunto
Nella maggior parte dei casi, il paziente candidato alla cardiochirurgia è un soggetto ad alto rischio operatorio che implica, per l’odontoiatra, difficoltà nelle scelte terapeutiche e nella gestione ambulatoriale. La revisione della letteratura eseguita mira a stabilire un protocollo operativo per la gestione del paziente candidato alla chirurgia in ambito odontoiatrico. Sono stati rilevati i dati epidemiologici riguardanti le patologie cardiovascolari di interesse cardiochirurgico maggiormente incidenti. Sono stati analizzati gli studi, sia epidemiologici sia sperimentali, in merito alla correlazione tra patologie odontostomatologiche e patologie cardiovascolari ed è stata esaminata la letteratura più recente (risalente all’ultimo decennio) in merito alle problematiche gestionali, anestesiologiche e farmacologiche nel trattamento odontoiatrico del paziente cardiopatico, alle indicazioni di trattamento odontoiatrico nel paziente cardiotrapiantato e alle recenti linee guida per quanto riguarda la profilassi contro l’endocardite e il trattamento anticoagulante orale. Gli autori concludono che è sempre consigliabile, per i pazienti candidati alla cardiochirurgia, soprattutto se di tipo valvolare, una valutazione odontoiatrica preventiva, mirata all’individuazione e all’eventuale eliminazione di foci infettivi a livello del cavo orale, i quali potrebbero sostenere una batteriemia, con conseguenze importanti a livello endocardico e, secondo recenti studi, anche a livello vascolare. Dato l’alto rischio operatorio che caratterizza questi pazienti, in caso di necessità di terapie estrattive è indicata l’ospedalizzazione. Vengono riportati i recenti protocolli relativi all’impostazione della profilassi antibiotica e alla gestione della terapia anticoagulante orale che possono essere di aiuto all’odontoiatra nel trattamento di questi pazienti.
Summary
Dental operative protocol for heart surgery patient
Patients who need heart surgery are characterized by a high operating risk, so choices about dental treatments could be difficult for the dentist. The aim of this study is to establish an operative protocol for dental treatment in patients who need heart surgery. We find epidemiologic studies about main heart surgery operation and about the relationship between dental pathologies and heart pathologies. Moreover we find the most recent guidelines about pharmacologic approach to heart surgery patients and about patients who undergo to heart transplant. In conclusion, we recommend for heart surgery patients to be submitted to dental examination and eventually to dental treatment before heart surgery operation. In this way, we can eliminate dental infections that could provoke serious infections, as endocarditis.
L’incremento della vita media della popolazione e delle patologie di natura cardiovascolare a eziologia prevalentemente ischemica, determinato dall’alta incidenza di abitudine al fumo, obesità e sedentarietà, che hanno caratterizzato la società occidentale dell’ultimo ventennio, ha portato a un incremento del numero di soggetti che, uniti ai pazienti affetti da valvulopatie di origine congenita o acquisita, vengono sottoposti a interventi cardiochirurgici. È inoltre necessario evidenziare come, nel corso dell’ultimo decennio, sia stato rilevato anche un aumento dell’incidenza delle patologie valvolari su base degenerativa, correlato proprio all’innalzamento dell’età media della popolazione.
Questo tipo di pazienti necessita, sempre più, di un’adeguata “preparazione all’intervento”, mediante terapie odontoiatriche che mirino all’eliminazione di foci infettivi contingenti o latenti e, quindi, in ogni caso, forieri di pericolose infezioni batteriche che possano diffondersi all’endocardio, vanificando l’efficacia dell’intervento cardiochirurgico e mettendo a rischio la vita del paziente.
Dal punto di vista odontoiatrico, è sempre più frequente che la popolazione media giunga all’età anziana completamente o quasi completamente dentata, oppure dotata di riabilitazioni protesiche di tipo fisso. Di conseguenza, è sempre più frequente che l’odontoiatra si trovi a dover impostare un piano di trattamento, costituito da terapie di tipo sia conservativo sia estrattivo, al fine di poter certificare l’assoluta assenza di foci infettivi a livello oro-dentale, in vista dell’intervento cardiochirurgico programmato.
La capacità di portare a termine questo tipo di trattamenti implica, tuttavia, una complessità di gestione del caso clinico dal punto di vista della salute generale del paziente, che prevede una particolare attenzione alla valutazione del rischio operatorio, all’impostazione di una corretta profilassi antibiotica contro l’endocardite, alla gestione dell’eventuale terapia anticoagulante orale o antiaggregante e alla prevenzione e risoluzione delle complicanze post-operatorie.
Revisione della letteratura
Evoluzione ed epidemiologia della cardiochirurgia
La cardiochirurgia è la branca della medicina che si interessa della diagnosi e del trattamento delle malattie cardiovascolari in stretta collaborazione con la cardiologia, l’anestesia, la terapia intensiva cardiochirurgica, la chirurgia toracica e la chirurgia vascolare1.
L’evento considerato come inizio della cardiochirurgia risale al 1896, quando Ludwig Rehn suturò una ferita da taglio, localizzata in corrispondenza del ventricolo destro. Successivamente, il lavoro del premio Nobel Alexis Carrel diede origine alla moderna chirurgia cardiovascolare, dimostrando, nel 1904, la fattibilità di un bypass aorto-coronarico a cuore battente eseguito su modello animale1.
Gli anni Cinquanta furono caratterizzati da intenso sviluppo e sperimentazione in cardiochirurgia: è del 1954 la circolazione extracorporea di Lillehei, che ha permesso la chirurgia a cuore aperto; del 1950 e del 1951 la prima rivascolarizzazione dell’aorta addominale per occlusione e per aneurisma, rispettivamente da parte di Oudot e Dubost; negli stessi anni si ebbe la pubblicazione da parte di Alfred Blalock sul primo intervento di shunt succlavio-polmonare eseguito in pazienti con tetralogia di Fallot1. Negli anni Sessanta, la rapida crescita e le nuove applicazioni della cardiochirurgia portarono allo sviluppo della chirurgia protesica valvolare; vennero impiantati i primi pacemaker definitivi e venne confezionato il primo graft per bypass aorto-coronarico1,2. Nel 1967, Christian Barnard eseguì il primo trapianto cardiaco1.
Gli ultimi 15 anni hanno visto cambiare notevolmente la chirurgia cardiaca: le tecniche di fast-tracking, il bypass in monotermia, la perfusione cerebrale retrograda, gli accessi mininvasivi, la chirurgia coronaria off-pump, l’uso di valvole stentless e l’applicazione della robotica ne sono solo alcuni esempi1.
Nel 1998, sono stati pubblicati dalla STS (Society of Thoracic Surgeons) americana i risultati statistici degli interventi cardiochirurgici più frequenti. In questo studio, oltre agli interventi eseguiti con maggior frequenza, si riporta anche la mortalità operatoria1:
- bypass aortocoronarico (mortalità globale: 2,8%);
- sostituzione valvolare aortica (mortalità: 3,6%);
- sostituzione valvolare mitralica (mortalità: 5,6%);
- doppia sostituzione valvolare mitro-aortica (mortalità: 7,7%);
- plastica valvolare mitrale (mortalità: 2,2%);
- bypass più sostituzione valvolare aortica (mortalità: 5,9%);
- bypass più sostituzione valvolare mitrale (mortalità: 12,7%);
- bypass più plastica valvolare mitralica (mortalità: 7,5%).
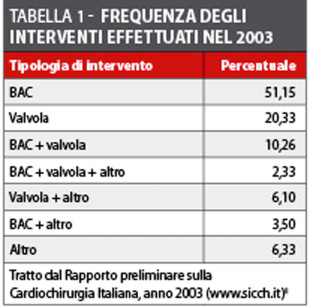
Per quanto riguarda la situazione nel nostro Paese, secondo dati forniti dall’Associazione Italiana di Cardiochirurgia, nel 2003 in Italia sono stati realizzati più di 50.000 interventi cardiochirurgici in pazienti adulti: la metà di tali procedure è costituita dall’intervento di by-pass aorto-coronarico (BAC), seguito da interventi di tipo valvolare e dalla combinazione dei primi due (tabella 1)3.
La terapia medica ha portato a un aumento della sopravvivenza e un miglioramento della qualità della vita, ma la progressione della severità dello scompenso conduce a un elevato numero di pazienti per il quale il trapianto cardiaco rappresenta l’unica soluzione terapeutica definitiva. Purtroppo, questa efficace terapia è fortemente limitata dalla disponibilità di donatori1.
Negli Stati Uniti sono stati effettuati 2.016 trapianti di cuore nel 2004 e 2.125 nel 2005, il 19% dei pazienti trapiantati hanno un’età compresa tra 35 e 49 anni, mentre 45% hanno una età compresa tra 50 e 64 anni. Il tasso di sopravvivenza annuo nel 2006 era 86,1% nei maschi e 83,9% per le donne. Il tasso, invece, quinquennale di sopravvivenza era per i maschi del 71,2%, per le donne del 66,9%1.
L’Italia si colloca al terzo posto, dopo Stati Uniti e Spagna, per numero di trapianti eseguiti. Secondo quanto riferito dal Ministero della Salute, il dato di fine 2004 risulta molto positivo rispetto a 10 anni fa, quando il nostro Paese era tra gli ultimi posti4.
Patologie di interesse cardiochirurgico
Le patologie che più frequentemente richiedono un trattamento cardiochirurgico sono riconducibili a: cardiopatia ischemica e infarto miocardico, patologie valvolari acquisite e congenite, insufficienza cardiaca e aneurisma aortico, cardiomiopatie, cardiopatie congenite complesse5.
La cardiopatia ischemica (CI), nelle sue diverse manifestazioni, rappresenta di gran lunga la maggior causa di mortalità in Italia e nel mondo, distanziando abbondantemente le malattie neoplastiche, che occupano il secondo posto. La cardiopatia ischemica è in genere conseguenza della localizzazione della malattia aterosclerotica a livello delle coronarie. Il trattamento chirurgico della cardiopatia ischemica è costituito dall’applicazione del by-pass aorto-coronarico, che può essere eseguito mediante innesto venoso o arterioso. Dal punto di vista tecnico, l’intervento si esegue previa messa in opera della circolazione extra-corporea e facendo ricorso all’ipotermia sistemica. Da alcuni anni è entrata nella pratica clinica un’altra metodica da impiegarsi in alternativa al by-pass aorto-coronarico: l’angioplastica coronarica percutanea con palloncino (PTCA), eseguita nei laboratori di emodinamica2.
L’infarto acuto del miocardio è la necrosi di una regione del muscolo cardiaco causata dall’occlusione acuta e perdurante di un’arteria coronarica. Il trattamento chirurgico può essere necessario in caso di insorgenza di complicanze quali l’aneurisma ventricolare sinistro, la perforazione del setto interventricolare e l’insufficienza mitralica su base ischemica2.
Le patologie valvolari che si manifestano in adulti possono essere: congenite, conseguenza di una malattia reumatica, su base degenerativa, su base involutivo-senile oppure su base ischemica. La presenza di calcificazioni è molto frequente e le manifestazioni cliniche sono progressive. Le più frequenti valvulopatie sono a carico della valvola mitralica e della semilunare aortica, per la loro maggiore sollecitazione meccanica2. La terapia chirurgica principalmente adottata nel caso delle stenosi è costituita dalla sostituzione valvolare, mediante valvole meccaniche o bioprotesi. L’alternativa può prevedere la riparazione della valvola mediante l’apertura delle commissure e l’escissione dei depositi di calcio2. Nel caso, invece, di insufficienza, prevale la terapia di tipo riparativo mediante risospensione delle cuspidi o chiusura dei difetti con patch, mentre il trattamento di tipo sostitutivo, con protesi meccaniche o biologiche, costituisce la terapia di seconda scelta. Va, inoltre, precisato che il trattamento di tipo riparativo viene preferito nel caso di valvulopatie mitraliche, rispetto alle valvulopatie aortiche2.
L’insufficienza cardiaca è una situazione fisiopatologia in cui il cuore, per cause diverse, non è più in grado di soddisfare le esigenze dell’organismo. Lo scompenso cardiaco congestizio è la fase successiva, dovuta all’inadeguatezza dei mezzi di compenso e si traduce in una sindrome clinica caratterizzata dalla congestione venosa (stasi polmonare, edemi periferici) e dall’insufficiente portata cardiaca (astenia, segni di ridotta perfusione periferica)6. Nella maggior parte dei casi, agisce un fattore precipitante che, aggiungendosi a una patologia di base fino ad allora in discreto equilibrio emodinamico, determina il manifestarsi o l’aggravarsi dello scompenso cardiaco congestizio2.
I pazienti affetti da una malattia cardiaca cronica (per esempio, valvulopatie), da cardiomiopatia, o da altre patologie cardiache irreversibili, causate da CI oppure da infarti multipli, che non possono essere trattati attraverso altri mezzi sia medici sia chirurgici, possono essere candidati per un trapianto di cuore2.
Per aneurisma dell’aorta, si intende una dilatazione del vaso con perdita del parallelismo dei bordi, dovuta a un’alterazione della parete arteriosa, con interruzione parziale delle sue componenti elastica e muscolare. Il trattamento chirurgico prevede la sostituzione protesica della parte di aorta compromessa con un tubo di Dacron2.
Per cardiomiopatie, si definiscono tutte quelle affezioni del muscolo cardiaco associate ad alterazioni della funzione cardiaca2. Se ne distinguono tre forme cliniche: dilatativa, ipertrofica e restrittiva7.
Le cardiopatie congenite complesse producono un’ampia gamma di sintomi e segni associati ad alterazioni di circolo. Esse si classificano come: cardiopatie con ostruzione dell’efflusso ventricolare, cardiopatie con shunt sinistro/destro e cardiopatie con shunt destro/sinistro. La maggior parte delle lesioni congenite cardiache possono essere corrette definitivamente con un solo intervento. In genere, tuttavia, anche se l’intervento è fisiologicamente correttivo, un ritorno a un completo stato di normalità non è possibile. La comparsa di complicanze come aritmie, disfunzioni ventricolari e insufficienza valvolare, spesso rendono questi interventi solo parzialmente correttivi. Per altre cardiopatie congenite più complesse, il programma chirurgico può prevedere due o più tappe, costituite da interventi di tipo palliativo eseguiti già in età neonatale per ridurre o aumentare il flusso ematico polmonare2.
Correlazione tra patologie oro-dentali e patologie cardiovascolari
La correlazione universalmente riconosciuta come principale causa di patologie cardiache attribuibili a infezioni oro-dentali, riguarda l’insorgenza di valvulopatie su base endocarditica infettiva. Le endocarditi infettive (EI), considerate tra i processi infettivi più preoccupanti, sono dovute alla colonizzazione e all’invasione delle valvole cardiache, dell’endocardio parietale e delle protesi valvolari da parte di microrganismi, con formazione di vegetazioni infette, di consistenza friabile, composte di detriti trombotici e microrganismi, spesso associate con distruzione del sottostante tessuto cardiaco. Il primo evento nella patogenesi dell’endocardite batterica è la formazione di un danno endoteliale che può essere il risultato di una turbolenza emodinamica o di altri eventi traumatici o patologici. In corrispondenza del tessuto danneggiato si vengono a formare vegetazioni costituite da trombi piastrinici, di per sé sterili, ma che a causa della loro struttura e dei loro componenti (piastrine, fibrina, fibronectina) facilitano, in presenza di batteriemia, l’adesione di batteri e, quindi, l’insorgenza dell’endocardite.
Questo passaggio è facilitato, qualora i batteri circolanti siano dotati di strutture che ne facilitano l’adesione alle vegetazioni, quali per esempio la fibronectin-binding protein e fibrinogen-binding protein, due componenti batteriche la cui espressione in microrganismi quali Staphylococcus aureus e Streptococcus sanguis, facilita l’insorgenza di endocardite nel modello animale, mentre una loro inibizione può ridurre significativamente la virulenza batterica. La presentazione clinica dell’endocardite è il risultato della presenza delle vegetazioni infette e delle reazioni immunitarie all’infezione. Possono insorgere episodi trombotici dovuti alla frammentazione delle vegetazioni, così come perdita di funzionalità delle valvole dovuta alla loro distruzione o un’occlusione dell’orifizio, in seguito a una crescita eccessiva. L’infezione può estendersi al miocardio e determinare disturbi di conduzione o altre patologie cardiache8.
Ogni tipo di microrganismo, compresi i funghi, le Rickettsie e le Clamidie, possono essere responsabili di queste infezioni, ma nella maggior parte dei casi sono implicati i batteri: per questo motivo, si usa spesso il termine di endocarditi batteriche. Le EI possono svilupparsi su valvole precedentemente normali, ma numerose sono le anomalie cardiache che ne favoriscono l’insorgenza. Negli anni passati, la cardiopatia reumatica ha rappresentato la condizione patologica più frequente in rapporto con lo sviluppo di EI, ma, attualmente, questo ruolo è svolto in maniera più significativa dal prolasso della valvola mitrale, dalla stenosi valvolare calcifica degenerativa, dalla valvola aortica bicuspide (sia calcifica che non), dalle valvole artificiali (protesi) e dai trapianti vascolari. Ugualmente importanti sono la neutropenia, l’immunodeficienza, le terapie immunosoppressive, il diabete mellito, l’alcol e l’abuso di droghe per via endovenosa. Più della metà dei casi di EI sono da ascrivere a diversi ceppi di Streptococchi, soprattutto del gruppo viridans, non responsabile della febbre reumatica. Questi microrganismi, a virulenza relativamente bassa, costituiscono la causa principale delle EI subacute, in quanto attecchiscono in cuori predisposti o con lesioni pregresse. Lo Staphilococcus aureus, invece, altamente virulento e responsabile del 20-30% dei casi, si impianta su valvole non alterate e costituisce la causa principale dell’endocardite infettiva acuta. Altri agenti eziologici significativi sono: Enterococchi e il cosiddetto gruppo HACEK (Haemophilus, Actinobacillus, Cardiobacterium, Eikenella e Kingella), tutti commensali del cavo orale. L’endocardite su valvole protesiche è, frequentemente, causata da Staffilococchi coagulasi-negativi (per esempio, Staphilococcus epidermidis). Altri agenti che possono causare endocardite sono i bacilli Gram negativi e i funghi.
Il fattore più importante che predispone allo sviluppo di un’endocardite è la contaminazione microbica del sangue. Il punto di ingresso nel circolo ematico dei microrganismi, può essere evidente: un intervento chirurgico od odontoiatrico causa di una batteriemia, la sede di iniezione della droga nei tossicodipendenti oppure occulta, come un’infezione misconosciuta del tratto gastroenterico, della cavità orale o di una piccola ferita. Il riconoscimento dei substrati anatomici e delle condizioni cliniche predisponenti facilita la prevenzione della batteriemia, grazie all’utilizzo di un’appropriata profilassi antibiotica. Tra le complicanze cardiache dell’EI ricordiamo, principalmente: insufficienza o stenosi valvolare, con insufficienza cardiaca; ascessi anulari miocardici, con possibili perforazioni dell’aorta, del setto interventricolare e della parete libera dei ventricoli o il coinvolgimento del sistema di conduzione; pericardite suppurativa; deiscenza parziale di una valvola artificiale, spesso con rottura in sede paravalvolare7.
Considerata l’importanza delle potenziali conseguenze di un evento come l’EI, i trattamenti odontoiatrici, in quanto potenziali fattori di rischio, sono sempre stati al centro del dibattito riguardante la prevenzione di tale patologia. La particolare attenzione rivolta alle cure odontoiatriche è spiegata dal fatto che quasi la totalità degli interventi odontoiatrici è in grado di determinare, con diversa frequenza, una batteriemia transitoria, condizione necessaria, ma non sufficiente, all’instaurarsi dell’endocardite.
A questo dobbiamo aggiungere che, nella maggior parte degli studi microbiologici sull’eziologia dell’endocardite infettiva, una larga porzione dei batteri coinvolti sono di possibile origine orale8.
Per quanto riguarda, invece, la correlazione tra CI e infezioni del distretto oro-dentale, recentemente è stata ripresa e ulteriormente documentata la teoria, già proposta per la prima volta negli anni Settanta, di associazione tra malattia parodontale (MP) e patologie in distretti extraorali, avanzando, inoltre, l’ipotesi che l’insorgenza e la severità di tali patologie sembrino correlarsi all’estensione e alla gravità delle lesioni dei tessuti parodontali. Tale associazione troverebbe una spiegazione patogenica attraverso il passaggio in circolo di lipopolisaccaridi (LPS) o di altri prodotti solubili di origine batterica, oltre che attraverso l’effetto a distanza delle citochine pro-infiammatorie, quali IL-1β, IFN-γ, TNF-α, presenti in concentrazioni elevate nei tessuti parodontali in relazione al processo infiammatorio placca-associato9.
Il legame tra MP e aumentato rischio di malattie cardiovascolari (MC), comprese la CI e le cerebrovasculopatie, va visto nell’ambito della moderna interpretazione dell’aterogenesi, processo nel quale l’infiammazione occupa una posizione centrale e tra i cui meccanismi di innesco si prospetta il concorso di un processo infettivo9.
I primi studi che hanno dato esito positivo riguardo l’esistenza di una relazione tra patologia odontoiatrica e malattia aterosclerotica, risalgono agli anni Ottanta10. Fino al 2007, sono stati condotti numerosi studi di tipo sia epidemiologico sia sperimentale, che hanno rilevato relazioni significative tra malattia parodontale e patologia cardiovascolare11. Da un lato, infatti, batteri parodontopatogeni sono stati identificati all’interno delle placche aterosclerotiche (Haraszthy, et al. 1998)12. Dall’altro lato, studi condotti su animali hanno dimostrato la capacità, per esempio di Porphyromonas gingivalis, di incrementare la formazione dell’ateroma e la calcificazione delle placche aterosclerotiche13,14.
In un lavoro del 2002 di Montebugnoli et al.15, sono stati ipotizzati cinque diversi meccanismi patogenetici, che potrebbero spiegare le modalità mediante le quali la malattia parodontale può contribuire allo sviluppo della patologia aterosclerotica cardiovascolare: invasione batterica delle cellule del sistema cardiovascolare; induzione di una reazione infiammatoria sistemica; induzione di un’iperaggregazione piastrinica; alterazione del metabolismo lipidico; reazione autoimmune.
I suddetti meccanismi patogenetici sono stati tutti confermati da studi di tipo sia clinico sia sperimentale condotti soprattutto nell’ultimo decennio12-26.
Problematiche gestionali nel trattamento odontoiatrico del paziente cardiochirurgico
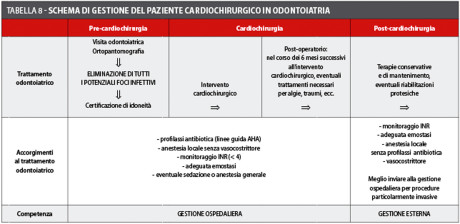
Il paziente cardiochirurgico, nella maggior parte dei casi, è un paziente ad alto rischio operatorio a causa dell’alta incidenza di conseguenze e complicanze post-operatorie. Per questo motivo, è indicata una valutazione pre-operatoria approfondita: in questo modo, sarà possibile accertare la compatibilità delle condizioni del paziente con il trattamento ambulatoriale o, nel caso in cui questo non sia possibile, valutare la possibilità di eseguire l’intervento in anestesia generale o sedazione cosciente, in regime di ricovero ospedaliero27,28. Per la valutazione clinica e la quantificazione del rischio è, infatti, di fondamentale importanza un’anamnesi accurata, dove si eseguirà un’indagine approfondita sulle patologie pregresse, quelle esistenti e sui farmaci assunti dal paziente abitualmente o saltuariamente27. Il diffondersi di interventi chirurgici sempre più aggressivi in pazienti in età avanzata, cardiopatici e portatori di altre patologie concomitanti, ha comportato un’aumento del rischio di morbilità e mortalità peri-operatorie.
La valutazione del rischio cardiaco e un’adeguata condotta peri-operatoria risultano, pertanto, di fondamentale importanza29.
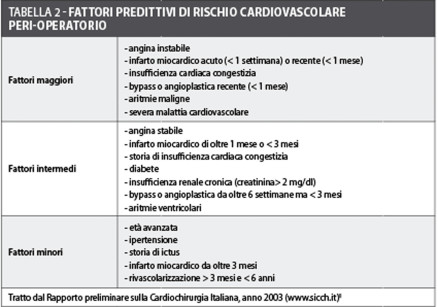
Il punto di partenza è sicuramente la stratificazione del rischio cardiaco e, a tal proposito, le linee guida formulate dalle due società americane, American College of Cardiology (ACC) e American Heart Association (AHA), individuano cinque fattori per stabilire se i pazienti necessitano di altre misure diagnostiche ed, eventualmente, terapeutiche prima dell’intervento29:
- tempo intercorso da un’eventuale rivascolarizzazione coronarica maggiore di sei anni;
- ultima valutazione cardiaca (test da sforzo o coronarografia) effettuata risalente a meno di due anni;
- presenza di fattori clinici predittivi di rischio (maggiori, intermedi e minori) relativi al paziente (tabella 2);
- stato funzionale del paziente;
- rischio cardiaco legato alla procedura chirurgica (nella chirurgia del capo e del collo, si prevede un rischio di grado medio < 5%).
In caso di procedure chirurgiche non urgenti e in assenza di una recente rivascolarizzazione coronarica o recente valutazione cardiaca, le indicazioni per ulteriori valutazioni cardiache, in accordo con le linee guida ACC/AHA sono:
- presenza di un fattore clinico predittivo maggiore;
- presenza di un fattore clinico predittivo intermedio o stato funzionale scadente, se l’intervento è ad alto rischio;
- presenza di un fattore clinico predittivo intermedio e di uno stato funzionale scadente, se l’intervento è a rischio intermedio29.
Nel trattamento del paziente cardiochirurgico, come peraltro per tutti i pazienti cardiopatici in generale, deve essere data priorità assoluta alla valutazione della gravità della patologia, ricordando che il rischio operatorio non è soltanto legato alla patologia di base e al grado di compromissione cardiaca, ma anche alle ripercussioni che queste esercitano su altri organi, apparati e sistemi27,28.
Se il paziente non possiede indagini di laboratorio eseguite di recente (entro tre mesi), queste possono essere richieste dall’odontoiatra.
Quando necessario, si possono effettuare accertamenti radiografici e altri esami strumentali27. In base al quadro patologico di base del paziente, sarà possibile formulare una valutazione numerica del rischio, che viene eseguita prevalentemente attraverso la classificazione ASA (American Society of Anesthesiologists) (tabella 3)28.
Nei casi più complessi, può essere richiesta, direttamente dall’odontoiatra, la consulenza del cardiologo e dell’anestesista, i quali esprimeranno le eventuali controindicazioni in merito all’indicazione a eseguire l’intervento e in merito al regime anestesiologico da preferire28.
Problematiche anestesiologiche e farmacologiche nel paziente cardiochirurgico
Diverse sono le tecniche di sedazione e anestesia descritte in letteratura, utilizzabili in corso di trattamenti odontostomatologici: ansiolisi, sedazione cosciente, sedazione profonda e anestesia generale27.
La scelta tra l’uno e l’altro genere di trattamento dovrà essere discussa con il paziente, sulla base di elementi di giudizio fisiologici, patologici e di risposte specifiche ai possibili farmaci impiegati; in alcuni casi è sufficiente una buona analgesia locale, in altri invece si dovrà ricorrere all’anestesia generale27.
Va precisato che, in ambito odontoiatrico-ospedaliero, sono principalmente utilizzate:
- sedazione cosciente per via orale, allo scopo di ottenere una blanda ansiolisi, in caso di procedure brevi e poco invasive;
- sedazione cosciente per via endovenosa, qualora ci sia la necessità di un effetto più rapido e di mantenere una via venosa per la gestione di eventuali emergenze;
- anestesia generale, in caso di interventi maggiormente demolitivi e per avere un monitoraggio costante e un controllo completo dei parametri vitali del paziente.
La sedazione profonda non viene, praticamente, mai utilizzata per interventi in sede oro-dentale, a causa dell’alto rischio di inalazione, determinato dalla perdita di riflessi protettivi27.
Per quanto riguarda l’utilizzo di anestetici locali, dal punto di vista cardiovascolare, tutti gli anestetici locali compromettono la contrattilità, l’eccitabilità, l’automatismo e la conduzione miocardica, e attenuano il tono vasale. Le cellule più sensibili agli anestetici locali sono quelle pacemaker, il sistema di His-Purkinje, che ne risente maggiormente al nodo seno-atriale.
Questi effetti diretti, potenziati dalla concomitante compromissione autonomica centrale e periferica (da blocco simpatico) e da eventuali condizioni di ipercapnia, acidosi e ipossia, sono dose-dipendenti e direttamente correlati con la potenza.
Infine, gli anestetici locali bloccano la contrazione del muscolo liscio della parete vascolare, interferendo nell’accoppiamento eccitazione-contrazione e bloccano i canali del Ca++ voltaggio-dipendenti. Probabilmente, intervengono anche sul rilassamento mediato dall’ossido nitrico, ostacolando il release di tale mediatore. Il blocco dei canali del sodio, lo stesso meccanismo con il quale l’anestetico locale blocca le afferenze nocicettive dalla periferia al centro, comporta l’effetto dromotropo e inotropo negativo.
Tra gli anestetici locali, la bupivacaina è il farmaco che deve essere maggiormente temuto per le possibili interferenze a livello cardiaco (peraltro, la bupivacaina raramente viene utilizzata in ambiente odontoiatrico); comunque, è evidente che il pericolo sussiste solo in caso di somministrazione di dosi elevate di anestetico locale o per iniezioni endovasali accidentali, evento quindi eccezionale nella pratica odontoiatrica27.
I vasocostrittori più frequentemente usati in odontoiatria sono stati, e sono tutt’ora, l’epinefrina, la norepinefrina e, in qualche caso, la levonordefrina e la fenilefrina.
Questi sono derivati dalla beta-feniletilamina e sono composti adrenergici chiamati amine simpaticomimetiche o catecolamine27.
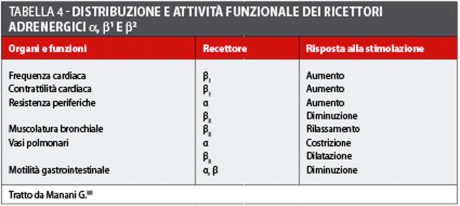
Le amine simpaticomimetiche vasocostrittrici interagiscono con molti differenti recettori adrenergici che comprendono i recettori α, β1 e β2 la cui attivazione determina specifiche risposte (tabella 4).
Teoricamente quindi il vasocostrittore adrenergico ideale dovrebbe essere un α-agonista con scarsissima attività β27.
In caso di sovradosaggio da vasocostrittore, nel paziente compare ansietà, sudorazione, aumento della pressione arteriosa, della frequenza cardiaca, tachiaritmia, palpitazioni, cioè il quadro classico da sovradosaggio da amine simpaticomimetiche; in questi casi, accanto alla somministrazione, se possibile, si impone di ridurre questi effetti da sovradosaggio ricorrendo a un farmaco di largo impiego e di facile reperimento come il diazepam oppure, meglio ancora, con nifedipina per via sublinguale che consente di controllare la crisi ipertensiva indotta dal vasocostrittore18.
I dosaggi massimi consigliati di vasocostrittore da utilizzare nell’anestesia locale sono: non più di 4 ml di soluzione anestetica locale con concentrazione di vasocostrittore 1:100.000 (epinefrina) per una dose totale di 0,04 mg in un periodo di 30 minuti (tabella 5)18.
L’assunzione del vasocostrittore può causare, peraltro, interferenze con la terapia farmacologica che il paziente assume per patologie concomitanti: per esempio, in pazienti in trattamento con antidepressivi triciclici (amitriptilina, imipramina), la somministrazione di vasocostrittori può indurre effetti simpaticomimetici. Il ricorso al vasocostrittore deve essere eseguito con altrettanta cautela nei pazienti che siano in trattamento con beta-bloccanti o con bloccanti adrenergici, per le potenziali risposte ipertensive. Da ultimo, i pazienti che assumono farmaci di tipo neurolettico (fenotiazinici, butirrofenoni) possono manifestare risposte di carattere ipotensivo, essendo inibita l’attività vasocostrittrice18.
Per quanto riguarda le interazioni tra farmaci di competenza cardiologica e altri farmaci che possono essere prescritti dall’odontoiatra, si sono riscontrate in letteratura interazioni importanti soltanto per quanto riguarda i farmaci antinifiammatori non steroidei (FANS): infatti, l’inibizione della sintesi delle prostaglandine può provocare diminuzione dell’escrezione renale di sodio, alterata resistenza agli stimoli ipertensivi e ridotta escrezione renale di litio. La maggior parte dei FANS, inoltre, inibisce la funzionalità piastrinica e può aumentare la frequenza di emorragie dovute ad altri farmaci che inibiscono l’emostasi30.
In caso di utilizzo di FANS, le interazioni clinicamente documentate sono con:
- ACE-inibitori: diminuzione della risposta antipertensiva;
- furosemide: diminuzione dell’effetto diuretico, natriuretico e antipertensivo;
- idralazina: diminuzione dell’effetto antipertensivo;
- β-bloccanti: diminuzione dell’effetto di antagonismo β-adrenergico (indometacina);
- anticoagulanti orali: aumento dell’effetto ipoprotrombinemico (meno frequente con ibuprofene, naproxene e diclofenac)30.
Gestione odontoiatrica del paziente cardiotrapiantato
Nei pazienti sottoposti a trapianto d’organo, il trattamento con immunosoppressori viene mantenuto, anche se a dosaggi minori, per tutta la vita e può avere conseguenze importanti come: leucocitopenia, piastrinopenia, effetti collaterali da ciclosporina e corticosteroridi, ma soprattutto deficit immunitario e, quindi, possibili infezioni da Pneumocystis carinii o Cytomegalovirus con grave pericolo di sepsi sistemica31.
Nonostante alcuni studi epidemiologici mettano in discussione la correlazione tra foci infettivi preesistenti al momento del trapianto ed episodi infiammatori estesi in concomitanza con il trattamento immunodepressivo32, la maggior parte delle fonti è concorde nell’affermare che foci infettivi a livello oro-dentale, che non vengano trattati prima del trapianto, possono rivelarsi fonte di gravi infezioni sistemiche nel momento in cui il paziente trapiantato viene sottoposto al trattamento immunosoppressivo33,34.
È per questo motivo che l’odontostomatologo viene chiamato a certificare l’assenza di foci infettivi effettivi o potenziali (per esempio, lesioni parodontali o periapiacali croniche) prima dell’inserimento del paziente in lista. In caso contrario, si dovrà provvedere a riportare il paziente a uno stato di salute orale stabile attraverso trattamento parodontale, dove necessario, terapie conservative di elementi cariati o trattamento “aggressivo” nei confronti di elementi che presentino lesioni periapicali, per le quali viene consigliata l’estrazione o il trattamento endodontico soltanto in casi eccezionali (per esempio, elementi frontali con particolare valore estetico)35.
Analogamente, il paziente che è già stato sottoposto a trapianto necessita di essere seguito con protocolli costituiti da controlli ravvicinati nel tempo, al fine di monitorare il suo stato di salute oro-dentale e garantire l’assoluta assenza di foci infettivi35.
Studi relativi alle variazioni pressorie di pazienti cardiotrapiantati suggeriscono che il trattamento odontoiatrico di questi pazienti, una volta stabilizzati, non presenta particolari complicazioni36,37 e presenti una gestione più semplice rispetto a quella del paziente con patologie cardiovascolari in atto38.
Profilassi dell’endocardite batterica
Avendo già approfondito gli aspetti inerenti la patogenesi dell’endocardite batterica e le sue temibili conseguenze, ci soffermeremo sulle ultime linee guida fornite dalla American Heart Association (AHA)39 e dalla British Society for Antimicrobial Chemotherapy (BSAC)8,40 in merito alla profilassi antibiotica da eseguirsi in caso di trattamento odontoiatrico. I nuovi protocolli forniti dalle due società nel 2006 e nel 2007 mirano, infatti, a una semplificazione degli schemi terapeutici per la profilassi, e possono essere riassunti nei seguenti punti.
Ottimali condizioni di igiene orale devono essere raggiunte sia prima di avviare il soggetto a interventi chirurgici cardiaci (sostituzione di valvole, autotrapianti di porzioni di aorta, ecc.) sia dopo, tramite richiami periodici, in modo da mantenere controllato lo stato di salute orale del paziente.
La profilassi dell’endocardite nelle procedure odontoiatriche viene raccomandata soltanto per i pazienti con patologie cardiache associate a un elevato rischio di sviluppare un’endocardite batterica (tabella 6). Nei pazienti che rientrano in questa categoria, si raccomanda la profilassi antibiotica per tutte le procedure odontoiatriche che coinvolgono il tessuto gengivale, la regione periapicale dei denti oppure perforano la mucosa orale.
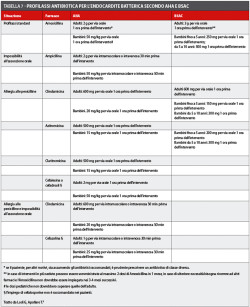
Per quanto riguarda gli antibiotici per la profilassi e la loro posologia, non sono state eseguite delle modifiche e le raccomandazioni sono rimaste essenzialmente quelle dei precedenti protocolli (tabella 7). Va precisato, a tal riguardo, che sussistono notevoli diversità tra le indicazioni fornite dalle diverse Società.
I recenti protocolli sono concordi nel ribadire che, in casi di pazienti che devono essere sottoposti a un intervento di cardiochirurgia, sia raccomandabile una valutazione odontoiatrica e, nel caso in cui il paziente necessiti di cure, il trattamento debba essere completato, se possibile, prima dell’intervento: queste misure possono ridurre l’incidenza di endocardite a livello delle valvole protesiche.
Gestione della terapia anticoagulante orale (TAO)
La terapia con anticoagulanti orali è usata da più di 50 anni per diminuire il rischio di tromboembolie41. I progressi raggiunti nel controllo della malattia tromboembolitica hanno, infatti, permesso che un numero sempre maggiore di individui possa essere sottoposto a un trattamento anticoagulante41.
Le principali patologie che prevedono l’utilizzo di anticoacolanti orali sono: patologie cardiache (stenosi mitralica, fibrillazione atriale, protesi valvolari, infarto miocardico), patologie post-traumatiche e chirurgia vascolare (arteropatia periferica, trombosi venosa profonda, embolia polmonare, chirurgia vascolare ricostruttiva), e anomalie congenite o acquisite (carenza di inibitori fisiologici della coagulazione, alterazione della fibrinolisi, trombocitosi)6. Lo scopo di questa terapia è quello di deprimere, in modo controllato e reversibile, la coagulabilità del sangue, al fine di ottenere la massima protezione possibile dagli incidenti tromboembolici con il minimo rischio di emorragie6.
Sono quattro le classi di farmaci anticoagulanti: eparina, antiaggreganti piastrinici, fibrinolitici o trombolitici, e anticoagulanti orali.
Da quanto emerge finora è proprio il gruppo dei farmaci anticoagulanti orali (o dicumarolici) quello che pone problemi terapeutici più complessi, mentre la rapida azione e, per contro, il veloce annullamento dell’effetto anticoagulante dei derivati della eparina consentono al chirurgo orale di avere range temporali d’intervento sufficientemente definibili42.
Gli anticoagulanti orali, warfarina e acenocumarolo, sono farmaci che interferiscono con il metabolismo della vitamina K con conseguente modifica, dose-dipendente, della cascata coagulativa, provocando la formazione di fattori della coagulazione inattivi, in quanto incapaci di legare il calcio, essenziale per un loro assemblaggio come complesso catalitico efficiente6. Essi possono essere antagonizzati dalla somministrazione di vitamina K. Infatti, nei pazienti in terapia anticoagulante orale una maggiore introduzione di vitamina K con la dieta provoca una riduzione dell’effetto di questi farmaci e, viceversa, una minore introduzione dietetica provoca un aumento dell’effetto anticoagulante6.
A causa della grande variabilità del loro effetto, non esistono dei dosaggi fissi in terapia. La variabilità dell’effetto è data da diversi fattori quali: caratteristiche individuali, tipo di alimentazione, farmaci interferenti e patologie concomitanti.
È necessario, quindi, per raggiungere la stabilità dell’effetto terapeutico, personalizzare il dosaggio del farmaco. Per fare questo, è necessario un monitoraggio periodico dell’effetto anticoagulante del farmaco, attraverso la misurazione del tempo di protrombina o tempo di Quick (PT) che viene standardizzata nell’indice INR6.
Il rischio di complicanze tromboemboliche è presente in ogni tipo di cardiopatia anche se in percentuale variabile da caso a caso e la sospensione della terapia abituale con anticoagulanti aggrava questo rischio indipendentemente dall’esistenza o meno del cosiddetto effetto rebound, correlato alla drastica sospensione dei dicumarolici e che si estrinseca con un pericoloso stato di ipercoagulabiltà. È stato dimostrato, infatti, che la sospensione della TAO espone il paziente ad un rischio tromboembolico di circa tre volte superiore a quello di un’emorragia41.
Risulta, quindi, di fondamentale importanza preservare il paziente dal rischio tromboembolico, prima ancora che da eventuali sanguinamenti intra- o post-operatori, che possono essere controllati e gestiti adeguatamente mediante l’adozione di semplici misure locali: quali la sutura, l’utilizzo di emostatici locali (spugne o colle di fibrina, cellulosa ossidata ecc.) e l’utilizzo di acido tranexamico, che sono in grado di ottenere un ottimo controllo dell’emostasi anche senza ricorrere a presidi aggiuntivi (somministrazione di vitamina K, trasfusioni ecc.)6.
I protocolli più recenti concordano quindi nell’affermare che:
- la terapia anticoagulante orale non deve mai essere sospesa arbitrariamente;
- esistono diversi atteggiamenti clinici da tenere, in base alla classificazione del rischio emorragico.
Negli interventi classificati a rischio basso (carie penetranti, estrazioni semplici o multiple, ablazione del tartaro, chirurgia minore o lembo mucoso-periostale), l’odontoiatra deve distinguere tre situazioni:
- se è possibile effettuare un’adeguata emostasi locale, allora il paziente può essere mantenuto nel suo range terapeutico con un intervallo di INR 2-3;
- nel caso, invece, non si possa ottenere un’accurata emostasi locale, occorre raggiungere un INR 1,5-2;
- se, infine, ci fosse la necessità di eseguire un intervento non programmato, si potrà comunque agire avendo valori di INR < 4 effettuando frequenti lavaggi e sciacqui con acido tranexamico e cercando di ottenere un’adeguata emostasi locale (sutura, spugna di fibrina e colle cianoacrilate).
Per quanto riguarda, invece, le classi di intervento ad alto rischio (chirurgia dei mascellari), la terapia anticoagulante dovrà essere sospesa in tutti i casi e, in particolare, nei portatori di valvole cardiache meccaniche oppure con trombosi endocavitaria cardiaca. La sospensione dovrà iniziare tre giorni prima dell’intervento programmato e verrà sostituita con eparina a basso peso molecolare (EBPM) a basso dosaggio terapeutico (due somministrazioni giornaliere sottocute), omettendo la somministrazione del mattino dell’intervento, ma riprendendola 12 ore dopo. Alla ripresa della TAO sono necessari dai tre ai cinque giorni per raggiungere un INR di almeno 2, pertanto, il periodo di insufficiente TAO deve essere protetto da eparina43. In casi estremamente impegnativi dal punto di vista chirurgico (come l’intervento cardiochirurgico stesso, per esempio su valvola mitrale), può essere indicata la sostituzione della TAO, con la sostituzione attraverso somministrazione di eparina per via endovenosa, implicando tuttavia la necessità di ospedalizzare il paziente almeno nei due giorni precedenti l’intervento.
Alla luce di quanto detto, l’odontoiatra, in previsione di interventi chirurgici odontostomatologici su pazienti in TAO, al fine di poter agire in modo controllato e sicuro, deve fare riferimento allo schema posologico programmato dai centri di sorveglianza medica (CSM) e rapportarlo al rischio emorragico correlato all’intervento stesso9:
- INR < 3: non vengono modificati il dosaggi della TAO in modo da non alterare un equilibrio terapeutico che non sempre è facilmente raggiungibile. In questo modo, si evita di esporre il paziente a un reale rischio tromboembolico e, attraverso un’adeguata emostasi locale, si evita anche quello emorragico;
- INR > 3: si deve, invece, prendere in considerazione una riduzione della terapia. Per ridurre, in modo prudente, la dose della terapia anticoagulante orale, in modo da arrivare a valori di INR compatibili con l’intervento, non ci sono regole fisse, anche per la grande variabilità della risposta a una modifica del dosaggio.
Questa, di fatto, è una terapia empirica e non esistono dei protocolli da seguire, la si impara solo con la pratica clinica e, di conseguenza, i risultati ottenuti alla fine devono sempre essere verificati con il PT.
Il controllo del PT va eseguito quando la riduzione del farmaco ha verosimilmente completato l’effetto: se si usa la warfarina, il controllo va fatto almeno due giorni dopo la modifica del dosaggio e possibilmente il giorno stesso dell’intervento.
Se invece, per la mancanza di tempo, l’intervento deve essere eseguito il giorno dopo, si può ricorrere alla vitamina K: 1 mg di vitamina K per os, assunta alla sera, riduce mediamente l’INR di poco più di 1 punto entro il mattino seguente. In questi casi, la terapia va ripresa al più presto, se possibile già il giorno dell’intervento, per evitare che si verifichi un’ulteriore riduzione dell’INR25.
Nel caso in cui sia necessario eseguire un intervento chirurgico odontoiatrico d’urgenza, in un paziente in terapia con anticoagulanti e valori di INR > 3, si dovrà neutralizzare la TAO attraverso una somministrazione di vitamina K per endovena lenta e procedere all’intervento dopo circa sei ore, previo controllo dei valori di INR.
Discussione e conclusioni
L’attuale paziente cardiochirurgico è caratterizzato da età media-avanzata e da un quadro pluripatologico di base piuttosto complesso. Tali caratteristiche implicano, per questi pazienti, un rischio operatorio medio-alto insieme alla necessità di gestire terapie farmacologiche che comprendono numerosi e diversi principi attivi, all’impostazione di una corretta profilassi antibiotica e alla prevenzione di complicanze intra-operatorie, sia emorragiche sia tromboemboliche, oltre alla prevenzione e gestione di eventuali complicanze post-operatorie.
L’indicazione, tuttavia, a intervenire con trattamenti odontostomatologici tutt’altro che conservativi deriva dalla presa di coscienza che la maggioranza degli studi scientifici esaminati ha confermato: l’esistenza di una correlazione tra la presenza di patologia odontostomatologica (soprattutto di tipo parodontale) e l’insorgenza di patologie cardiache e cardiovascolari. A questo proposito, la fascia di soggetti maggiormente a rischio è rappresentata dai pazienti valvulopatici, candidati a interventi di chirurgia valvolare, e dai pazienti che hanno già subito in passato questo tipo di interventi.
Considerato l’alto rischio di endocardite infettiva a cui sono soggetti questi pazienti, è infatti assolutamente necessario che essi vengano sottoposti a una valutazione odontoiatrica, con bonifica degli eventuali foci infettivi presenti, prima dell’intervento cardiochirurgico, e vengano successivamente seguiti nel tempo con un programma di controlli ravvicinati, al fine di prevenire situazioni di sepsi del cavo orale. Va, inoltre, sottolineato come un atteggiamento clinico di tipo conservativo da parte dell’odontoiatra (per esempio, la scelta di trattare endodonticamente elementi a rischio, che presentino lesioni periapicali, al fine di non estrarre tali elementi) possa rivelarsi potenzialmente pericoloso per un paziente candidato alla chirurgia cardiaca. Pertanto, è auspicabile che ogni valutazione odontoiatrica, basata su un esame clinico e su una recente ortopantomografia delle arcate dentali, insieme alle eventuali terapie consigliate o eseguite, preliminarmente all’intervento cardiochirurgico, venga adeguatamente certificata in forma scritta dall’odontoiatra e inviata al cardiochirurgo.
Per quanto concerne la gestione clinica del paziente cardiochirurgico nell’ambito del trattamento odontoiatrico, un importante problema organizzativo riguarda la ridotta disponibilità di tempo per eseguire le terapie necessarie.
A tal proposito, infatti, un normale ambulatorio odontoiatrico (sia esso privato o pubblico) difficilmente riesce a portare a termine un piano di trattamento completo in tempi ristretti (spesso inferiori a 60 giorni).
Il problema può essere quindi risolto mediante l’ospedalizzazione del paziente, attraverso ricoveri in regime di day surgery, presso servizi ospedalieri in cui venga di norma riservato uno spazio a questo tipo di interventi.
Nei casi più complessi, è possibile ospedalizzare il paziente in regime di ricovero ordinario, al fine di monitorarne per più giorni le condizioni generali.
Questo tipo di atteggiamento clinico non mira alla creazione di ricoveri impropri, bensì alla protezione del paziente da ogni eventuale complicanza ed è, pertanto, preferibile rispetto alla gestione presso semplici servizi ambulatoriali, nei quali non esista la possibilità di monitorare continuativamente le condizioni del paziente ed eventualmente porle all’attenzione di un professionista reperibile.
Anche i tempi operativi in corso di intervento devono essere brevi, data la fragilità sistemica del paziente e, quindi, elementi essenziali sono rappresentati da esperienza e manualità dell’operatore. Per la gestione della profilassi antibiotica e dell’eventuale rischio emorragico in caso di terapia anticoagulante orale, l’odontoiatra potrà fare riferimento alle più recenti linee guida, che sono state decisamente semplificate rispetto al passato.
Nei pazienti sottoposti a terapia anticoagulante si dovranno valutare, prima dell’intervento, i valori di INR, che dovranno essere inferiori a 4, in accordo con i dati presenti in letteratura, in modo che l’intervento venga eseguito in sicurezza. In questo senso è raccomandabile che non venga modificato il regime terapeutico a cui il paziente è sottoposto, evitando di esporlo a inutili rischi tromboembolici; l’adozione di semplici misure locali quali la sutura, l’utilizzo di emostatici locali e di acido tranexamico si sono, infatti, dimostrati sufficienti a ottenere un ottimo controllo dell’emostasi. Il concetto fondamentale è, quindi, riassumibile nell’assoluta controindicazione a sospendere arbitrariamente la terapia anticoagulante orale, in considerazione della possibilità di intervenire con interventi di chirurgia orale ambulatoriale su pazienti con INR < 4; e, ancora una volta, è necessario sottolineare come l’ospedalizzazione del paziente possa rendersi necessaria per gestire le eventuali complicanze peri-operatorie, soprattutto riguardanti l’assetto emocoagulativo.
Per quanto riguarda il pericolo di interazioni farmacologiche tra farmaci di competenza odontoiatrica e terapie croniche assunte dal paziente cardiopatico, si raccomanda la cautela nella prescrizione di farmaci antinfiammatori non steroidei, in quanto potenzialmente in grado di interferire con eventuali terapie antipertensive.
L’anestesia generale e loco-regionale, se correttamente applicate, non presentano differenze importanti in merito al rispetto della funzione cardiaca.
La scelta di una particolare tecnica deve essere effettuata, quindi, in base al tipo di procedura chirurgica, alle caratteristiche fisiche e psicologiche del paziente, alla familiarità dell’anestesista con la tecnica prescelta, all’ambiente in cui avrà luogo il decorso post-operatorio (con speciale riferimento alla possibilità di trasferire il paziente in un ambiente intensivo). L’impostazione del piano di trattamento del paziente cardiochirurgico si basa sulla quantificazione del rischio operatorio, che inizia al momento della valutazione pre-operatoria. I fattori che quantificano il rischio operatorio in questo tipo di pazienti sono rappresentati da: il tempo intercorso da un’eventuale rivascolarizzazione coronarica, l’ultima valutazione cardiaca effettuata, la presenza di fattori clinici predittivi di rischio, lo stato funzionale del paziente e il rischio legato alla procedura chirurgica.
La valutazione definitiva del rischio viene comunque eseguita dal cardiologo e dall’anestesista; quest’ultimo fornisce una stima quantitativa del rischio utilizzando l’indice ASA.
Dato l’alto rischio operatorio medio che caratterizza il paziente cardiopatico, sarebbe sempre opportuno che il trattamento pre- e peri-operatorio venisse messo in atto in ambiente ospedaliero, in modo da poter operare in regime di ricovero, e intervenire in tempo reale in caso di insorgenza di complicanze intra- e post-operatorie. Una volta superato l’immediato post-operatorio, il paziente può essere riaffidato al proprio odontoiatra di fiducia per le terapie conservative, le terapie di mantenimento ed eventuali riabilitazioni protesiche (tabella 8).
Corrispondenza
dottor Claudio Gallo
ULSS 16 – Padova – U.O. di Odontoiatria di Comunità
Ospedale “Immacolata Concezione”
Via San Rocco, 8
Piove di Sacco (PD)
e-mail: claudio.gallo@sanità.padova.it.it
• Claudio Gallo1
• Laura Borella1
• Silvia Gallo2
• Alessandro Giacomin2
• Marialuisa Valente3
1 ULSS 16 – Padova, Ospedale di Piove di Sacco (PD),
Servizio di Odontoiatria di Comunità, Responsabile dottor Claudio Gallo
2 ULSS 13, Ospedale di Mirano (VE), Reparto di Cardiochirurgia,
Responsabile dottor A. Giacomin
3 Università degli Studi di Padova, Corso di Laurea in Odontoiatria
e Protesi Dentaria, Presidente professoressa Marialuisa Valente
2. Belcaro G, Agus GB, Spatera C, et al. Chirurgia cardiaca, vascolare e angiologica. Torino: Ed Minerva Medica, 2000.
3. sito internet ufficiale della Società Italiana di Chirurgia Cardiaca: www.sicch.it – Rapporto preliminare sulla Cardiochirurgia Italiana, anno 2003.
4. Ministero della Salute. Relazione sullo stato sanitario del Paese 2003-2004. Roma: Utet, 2004.
5. Herold G. Guida pratica di medicina interna. IV ed. Noceto: Essebiemme Edizioni, 2001.
6. Damia L, Barcella MA. Protocollo operativo in chirurgia per pazienti in terapia anticoagulante. Dent Mod 2007;7:46-49.
7. Robbins. Le basi patologiche delle malattie. VI ed. a cura di Cotran, Kumar, Collins. Padova: Ed. Piccin, 2000.
8. Lodi G, Apollaro T. Profilassi antibiotica dell’endocardite infettiva. Dental Cadmos 2005;2:61-71.
9. Trombelli L. Malattia parodontale e stato di salute del paziente. Dental Cadmos 2000;6:21-53.
10. Paunio K, Impivaara O, Tiekso J, et al. Missing teeth and ischaemic heart disease in men aged 45-64 years. Eur Heart J 1993;14(suppl K):54-6.
11. Webster K, Wilde J. Management of anticoagulation in patients with prosthetic heart valves undergoing oral and maxillofacial operations. Br J Oral Maxillofac Surg 2000;38:124-6.
12. Haraszthy VI, Zambon JS, Trevisan M. Identification of pathogens in atheromatous plaques. J Dent Res 1998;77:666.
13. Chung HJ, Southerland JH, Geva S, et al. Effect of Porphyromonas gingivalis infections on ateroma formation in Apo E mice. J Dent Res 2000;79:313.
14. Geva S, Liu Y, Champagne CME, et al. Porphyromonas gingivalis enhances atherosclerotic plaque calcification in Apo E mice. J Dent Res 2000;79:516.
15. Montebugnoli L, Servidio D, Miaton RA, Brandi S, Prati C. Relazione tra patologia odontoiatrica e aterosclerosi. Dental Cadmos 2002;9:19-40.
16. Dorn BR, William A, Dunn JR, et al. Invasion of human coronary artery cells by periodontal pathogens. Infect Immunol 1999;67:5792-8.
17. Ellis JS, Averley PA, Preshaw PM, Steele JG, Seymour RA, Thomason JM. Change in cardiovascular risk status after dental clearance. BDJ 2007;202:543-44.
18. Giron G. L’anestesia locale nel cardiopatico. Atti del Congresso “La gestione del paziente cardiopatico in ambito odontoiatrico”. Asolo (TV) 19 giugno 1999.
19. Herzberg MC, Brentzenhofe KL. Aggregation of human platelets and adhesion of Streptococcus sanguis. Infect Immunol 1983;39:1457-9.
20. Katz J, Chauschu G, Sharabi Y. On the association between hypercholesterolemia, cardiovascular disease and severe periodontal disease. J Clin Periodontol 2001;28:865-8.
21. Loesche W, Karapetow F, Pohl C et al. Plasma lipid and blood glucose levels in patients with destructive periodontal disease. J Clin Periodontol 2000;27:537-41.
22. Maeda H, Miyamoto M, Hongyo H. Heart shock protein 60 (GroEL) from Porphyromonas gingivalis: molecular cloning and sequence analysis of its gene and purification the recombinant protein. FEMS Microbiol Lett 1994;124:121-6.
23. Offenbacher S, Madianos PN, Champagne CME, et al. Periodontitis-atherosclerosis syndrome: an expanded model of pathogenesis. J Periodont Res 1999;3:346-52.
24. Ridker PM, Cushmann M, Stampfer MJ, et al. Inflammation aspirin, and the risk of cardiovascular disease in apparently healthy men. N Engl J Med 1997;336:973-9.
25. Taylor BA, Tofler GH, Carey HMR, et al. Full-mouth tooth extraction lowers systemic inflammatory and thrombotic markers of cardiovascular risk. J Dent Res 2006;85:74-78.
26. Zheng P, Chen H, Shi S, et al. Periodontal parameters and platelet-activating factors levels in serum and gingival crevicular fluid in a Chinese population. J Clin Periodontol 2006;33(11):797-802.
27. Manani G. Anestesia in odontostomatologia. II ed. Napoli: Edizioni Idelson-Gnocchi, 2003.
28. Migliau G. Trattamento odontoiatrico nei pazienti a rischio cardiovascolare. Min Stomatol 2002;51:49-63.
29. Sollazzi L, Modesti C. Anestesia e paziente cardiopatico. Cardiology Science 2006;4:118-123.
30. Katzung BG. Farmacologia generale e clinica. Padova: Ed Piccin, 2006.
31. Guida A, Gallottini L, Grasso G, Adragante W. Ipertrofia e iperplasia gengivale da ciclosporina A. Dental Cadmos 2002;6:73-80.
32. Meyer U, Weingart D, Deng MC, Scheld HH, Joos U. Heart transplant – assessment of dental procedures. Clin Oral Investig 1999;3(2):79-83.
33. Goldman KE. Dental managment of patients with bone marrow and solid organ transplantation. Dent Clin North Am 2006;50(4):659-76.
34. Guggenheimer J, Mayher D, Eghtesad B. A survey of dental care protocols among US organ transplant centers. Clin Transplant 2005 Feb;19(1):15-8.
35. Gallo C. Odontoiatria Speciale. Padova: Ed Cortina, 2006.
36. Borea G, Montebugnoli L, Capuzzi P, Vaccaro MA. Circulatory dynamics during dental operations in patients with heart transplant. Quintessence Int 1993;24(19):749-51.
37. Montebugnoli L, Montanari G. Vasovagal syncope in heart transplant patients during dental surgery. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999;87(6):666-9.
38. Montebugnoli L, Prati C. Circulatory dynamics during dental extractions in normal, cardiac and transplant patients. JADA 2002;133(4):468-72.
39. Wilson W, Taubert KA, Gewitz M, et al. Prevention of infective endocarditis. Guidelines from the American Heart Association. JADA 2007;138(6):739-60.
40. Beynon RP. Infective endocarditis. BMJ 2006;333:334-9.
41. Conversini A, Pagano S, Caputo G, D’Errico P. Valutazione del rischio di eventi emorragici: pazienti in terapia anticoagulante. Dental Cadmos 2003;10:33-41.
42. Barbando P, Levo R, Basano L, Chiarelli A. Terapia anticoagulante orale in odontostomatologia. Dental Cadmos 2003;3:51-57.
43. Pushkar M, Cottrell DA, Booth DF. Management of heparin therapy in the high-risk, chronically anticoagulated, oral surgery patient: a review and a proposed nomogram. J Oral Maxillofac Surg 2000;58(2):198-202.