Gli obiettivi di questo lavoro sono quelli di presentare dati aggiornati sulle indicazioni, controindicazioni, possibilità e limiti della rigenerazione ossea guidata (GBR) a scopo implantologico per la correzione di difetti ossei dei mascellari parzialmente edentuli.
Verranno descritti in dettaglio:
a) i principi generali delle tecniche di GBR in base all’analisi della letteratura internazionale;
b) le indicazioni all’utilizzo dei vari tipi di membrane e di materiali da innesto, sottolineandone vantaggi e limiti;
c) le procedure chirugiche di GBR;
d) i dati ricavati dall’esperienza decennale degli autori.
La riabilitazione orale di pazienti parzialmente o totalmente edentuli con l’utilizzo di impianti endossei è divenuta ormai una metodica molto diffusa e capace di garantire risultati predicibili e affidabili a lungo termine1-14.
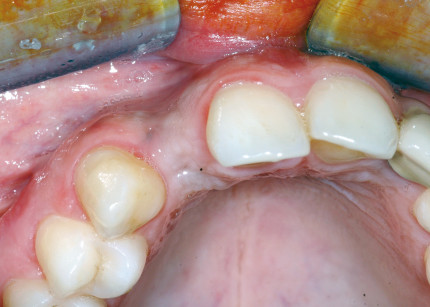
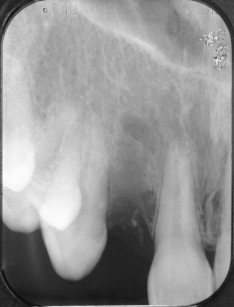
Nonostante ciò, condizioni sfavorevoli a carico delle creste alveolari dovute ad atrofia, malattia parodontale o esiti di traumi possono portare a una insufficiente dimensione ossea verticale e/o orizzontale o a una sfavorevole relazione intermascellare, tali da rendere impossibile l’inserimento di impianti endossei o da compromettere il risultato estetico-funzionale della riabilitazione protesica supportata da impianti.
Al fine di risolvere il problema della carenza ossea a livello dei mascellari, quattro sono i principali metodi proposti:
a) osteoinduzione attraverso l’utilizzo di fattori di crescita ossea15,16;
b) osteoconduzione, nella quale un materiale da innesto funge da guida per il fisiologico processo di rigenerazione ossea16, 17;
c) distrazione osteogenica, nella quale un’osteotomia chirurgica permette l’allontanamento graduale delle due porzioni ossee separate con neoformazione ossea18,19;
d) rigenerazione ossea guidata (GBR), nella quale apposite membrane fungono da mantenitori di spazio permettendo la neoformazione ossea20-27.
Nonostante il numero sempre crescente di pubblicazioni riguardanti la correzione dei difetti ossei nei mascellari edentuli, esistono tuttora molte controversie circa la scelta della tecnica più adatta e affidabile. Ciò è dovuto al fatto che spesso la qualità metodologica dei lavori scientifici è scarsa (follow-up insufficiente, campioni ristretti, assenza di randomizzazione, mancanza di criteri di inclusione ed esclusione ben definiti, mancanza di criteri di valutazione del successo implantare ben definiti e uniformi ecc.).
Scopo di questo lavoro è valutare le possibilità di correzione dei difetti ossei mediante una di queste metodiche, la rigenerazione ossea guidata (GBR), analizzandone possibilità e limiti in base ai risultati della letteratura internazionale e alla casistica personale.
Verranno inoltre valutate in dettaglio le procedure chirurgiche e le modalità tecniche per l’ottimizzazione dei risultati.
In successive pubblicazioni verranno presentati i risultati ottenuti con le altre metodiche prima citate.
Principi generali delle tecniche di GBR
La rigenerazione ossea guidata (GBR) è una tecnica chirurgica che prevede l’utilizzo di membrane in associazione o meno a materiali di riempimento, al fine di ricreare un’adeguata rigenerazione del tessuto osseo mancante per poter poi inserire impianti endo-ossei non solo in un adeguato volume osseo che circondi completamente tutta la superficie implantare, ma anche in una posizione ottimale per la successiva riabilitazione protesica.
Esiste tuttavia una notevole discordanza su quali membrane siano le più indicate, non riassorbibili o riassorbibili, nonché sulle indicazioni all’utilizzo o meno di materiali da innesto quali l’osso autologo, omologo, eterologo o materiali alloplastici quali per esempio le idrossiapatiti (HA), il tri-calcio-fosfato (TCP), i biovetri, usati singolarmente o anche miscelati tra loro22, 28-45.
Cercheremo pertanto di fornire sinteticamente ma in modo chiaro indicazioni sulle tecniche più consone relative ai diversi quadri clinici, suggerendo protocolli di trattamento razionali sulla scelta delle diverse membrane e sulle reali indicazioni all’utilizzo dei materiali di riempimento.
1. Indicazioni principali alle membrane
La membrana ideale deve essere biocompatibile, in grado di coprire il difetto mantenendo lo spazio creato, stabilizzare il coagulo o il materiale da innesto sottostante, permettere una guarigione corretta e impedire la crescita di tessuto connettivo (che tende a svilupparsi più velocemente del tessuto osseo) all’interno del difetto20-27.
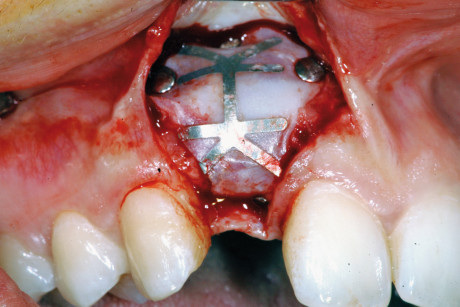
La sequela di eventi presenti nella formazione di nuovo osso (angiogenesi, presenza di osteoblasti, deposizione ossea ecc.) sono riscontrabili anche nelle procedure di guarigione ossea guidata da membrane: in quest’ottica le membrane possono aiutare a concentrare nel difetto osseo vari fattori di crescita osteoinduttivi.
Ad oggi sono stati sviluppati diversi tipi di membrana, sia riassorbibili che non riassorbibili.
1a. Membrane riassorbibili
Queste membrane sono caratterizzate dal fatto che durante le fasi di rigenerazione ossea vanno incontro a un processo di riassorbimento per idrolisi e i prodotti di degranulazione, che sono assorbiti dai tessuti circostanti, vengono infine trasformati in acqua e anidride carbonica. Tale processo dovrebbe ovviamente e idealmente avvenire con un ritmo tale da consentire un’adeguata rigenerazione ossea. Il loro utilizzo è indicato nei casi in cui si voglia evitare un secondo intervento volto alla loro rimozione. Queste membrane tuttavia necessitano sovente di essere associate a materiali da innesto in quanto, data la loro scarsa rigidità, non sono in grado di garantire da sole un sufficiente «effetto tenda» e tenderebbero perciò a collassare. Inoltre, grazie alla loro aderenza, si può spesso evitare l’uso di viti o chiodini di fissazione.
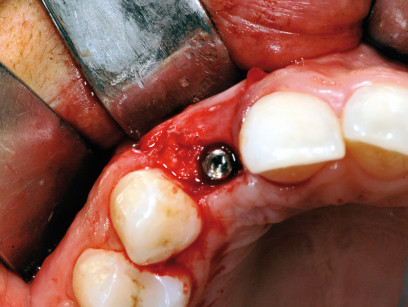
È doveroso tuttavia evidenziare che l’efficacia di alcune membrane è supportata da studi clinici rilevanti, mentre altre mancano di un sufficiente supporto da parte della letteratura scientifica30,34,35,37,40,45-48.
Le membrane riassorbibili possono essere suddivise in gruppi in base al materiale di cui sono costituite.
a) Membrane in collagene: vengono ricavate dal collagene di peritoneo bovino o suino, proteina di sintesi dei fibroblasti, che viene deproteinizzato per l’eliminazione della componente cellulare e della sostanza fondamentale per eliminare possibili reazioni immunogene. La velocità di riassorbimento è in relazione al numero dei legami crociati; maggiore sono questi legami maggiore è il tempo di riassorbimento. Inoltre, membrane costituite da collagene di tipo 1 hanno un’ottima degradabilità (4-8 settimane), diversamente da quanto osservato in quelle a struttura microfibrillare. Bisogna tuttavia ricordare che, pur trattandosi spesso dello stesso materiale, le prestazioni possono differire significativamente in base alla preparazione del prodotto, allo spessore, alla rigidità e ai tempi di riassorbimento.
b) Membrane in esteri di acido polilattico ed esteri dell’acido citrico: la membrana è formata da un duplice strato, dove la parte esterna presenta dei fori rettangolari che permettono la rapida penetrazione del connettivo gengivale, minimizzando la recessione gengivale e diminuendo di conseguenza l’esposizione della membrana. Lo strato interno è formato, invece, da fori circolari di dimensioni minori tali da impedire il passaggio di tessuto connettivo ma lasciando permeabilità alle sostanze nutritizie utili per i processi rigenerativi. I processi di degradazione non influenzano la macrostruttura per almeno 6 settimane e il completo riassorbimento si conclude solo dopo 6-12 mesi.
c) Membrane PLA/PGA: sono formate da acido polilattico (PLA) e acido poliglicolico (PGA), materiale usato molto anche per la realizzazione di fili di sutura. Le membrane in PLA e PGA presentano un’ottima risposta biologica per il loro riassorbimento nei tessuti, che inizia dopo 4-6 settimane dal contatto con i tessuti e termina dopo circa 8 mesi.
d) Membrane formate da copolimeri di acido lattico, acido glicolico e carbonato di trimetilene: questi polimeri sono degradabili per idrolisi. Le membrane dovrebbero costituire una barriera biologica per circa 8-12 settimane e riassorbirsi successivamente. La loro particolarità consiste nel fatto che un liquido plasticizzante permette alle membrane di essere malleabili nelle fasi di manipolazione e posizionamento, mentre dopo qualche minuto la membrana diventa rigida nella forma determinata, aumentandone così l’effetto tenda.
e) Membrane PEG: sono costituite dall’unione di molecole di glicole polietilenico attraverso gruppi tiolici e acrilici con una reazione di polimerizzazione a pH fisiologico che crea così una rete di legami di esteri idrolitici; per poter controllare la fluidità del composto viene aggiunta cellulosa carbossimetilata (CMC).
1b. Membrane non-riassorbibili
a) Membrane in e-PTFE: sono formate da strati multipli di noduli di Teflon, interconnessi da una trama di fibrille con una formazione di pori che permettono il passaggio selettivo di liquidi, fibroblasti, piccoli capillari e fibre collagene. Diversi studi condotti su animali e sull’uomo hanno mostrato un’ottima biocompatibilità di queste membrane, riscontrato anche dall’assenza di cellule infiammatorie (ovviamente in assenza di complicanze infiammatorie/infettive legate alla loro prematura esposizione)32,33.
È inoltre interessante notare che all’interno delle interconnessioni di e-PTFE sono state trovate tracce di matrice osteoide e di tessuto osseo: questo dato rafforza l’ipotesi riguardo alle capacità osteoinduttive di tale presidio chirurgico. La formazione di osso sembra avere origine dagli strati più esterni della membrana per poi raggiungere la porzione centrale. Nell’osso di neoformazione si può evidenziare la presenza di lacune ma assenza di sistemi Haversiani. Nella parte esterna sono stati trovati anche osteoblasti positivi alla fosfatasi alcalina, a testimoniare la fase attiva di produzione di matrice osteoide.
b) Membrane rinforzate in titanio: sono state concepite per loro capacità di mantenere un ampio spazio protetto fra queste e la superficie ossea senza dover ricorrere ad altri mezzi di supporto36, 42. Purtroppo il trattamento senza materiali da riempimento ha fatto riscontrare formazioni di tessuto molle al di sotto della membrana, perciò sembra indicato il trattamento combinato di membrana e allotrapianto o di membrana e autotrapianto. Inoltre, il tessuto molle orientato verso la sede della membrana era costituito da tessuto connettivo lasso con fibre collagene sottili, mentre quello orientato verso la superficie ossea era ben vascolarizzato e con presenza di formazione attiva di osso. Lo sviluppo dello strato di tessuto molle è stato attribuito ai seguenti fenomeni biologici:
- la rigidità della membrana ha compromesso lo stretto adattamento alla superficie ossea e ha favorito la crescita interna di cellule di tessuto molle;
- in molti casi lo spazio che sussiste tra membrana e difetto osseo non viene a essere completamente obliterato dal coagulo ematico;
- tempi inferiori ai 9 mesi per la riapertura e la rimozione della membrana non sono compatibili con la formazione e la maturazione di tutto l’osso;
- talvolta spazi troppo ampi non vengono colmati interamente da cellule osteoprogenitrici.
L’indicazione principale all’utilizzo di queste membrane è determinata dal tipo di rigenerazione ossea che deve essere eseguita. Se il difetto osseo presenta una componente verticale, si sfrutta la rigidità della membrana per sostenere i tessuti molli e permettere la formazione di nuovo osso in senso verticale: purtroppo, questo importante vantaggio comporta anche un aumento del rischio di deiscenza dei tessuti molli che ricoprono la membrana con conseguente esposizione della stessa.
Nel caso in cui una membrana non riassorbibile si esponesse è necessaria la sua immediata rimozione con conseguente compromissione del risultato finale.
c) Mesh in titanio: vengono utilizzate per il loro effetto «space maintaining» ma ovviamente devono essere essociate a un materiale da innesto30, 31, 41.
Questo tipo di sostegno per la rigenerazione ossea non offre un sufficiente effetto barriera, indipendentemente dal disegno e dalla dimensione delle varie trame di titanio, perciò è abbastanza frequente trovare del tessuto connettivo infiltrato nella parte più superficiale dell’innesto. La rigenerazione ossea mediante mesh è indicata nei casi di atrofie più estese, pur aumentando la possibiltà di esposizione dell’innesto, favorito inoltre dalla rigidità della griglia stessa.
2. Indicazioni principali ai materiali da innesto
Nel 1886 Black tentò una prima classificazione dei materiali da innesto. Seguirono poi altre classificazioni, ma il comune denominatore fu sempre «il riempimento di osso» definito come il ripristino clinico del tessuto osseo in un difetto. Nel trattamento dei difetti ossei con membrane e materiali da innesto si può andare incontro a due eventi fisiologici distinti: se il materiale è riassorbibile l’organismo sostituirà il materiale esogeno per reintegrare tale spazio con osso neoformato.
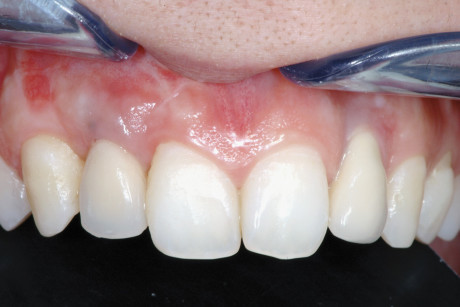
Se invece il materiale non è riassorbibile, come nel caso della idrossiapatite, l’organismo instaura un processo di incapsulamento non flogistico nel tessuto fibroso, costruendo tutto intorno osso di neoformazione.
I materiali da innesto possono essere osteoconduttivi, cioè materiali che hanno la funzione di sostegno e di impalcatura per le cellule ossee, o osteoinduttivi che, diversamente dai precedenti, inducono un processo biologico di trasformazione delle cellule mesenchimali totopotenti in cellule osteoblastiche e condroblastiche. L’attività osteoinduttiva è dovuta alla presenza di fattori di crescita proteici (BMP).
2a. Osso autologo
Osso di tipo midollare e/o corticale con elevate potenzialità osteogenetiche donato dallo stesso individuo ricevente.
L’osso autogeno contiene fattori di crescita nella sua matrice che esplicano un’attività osteoinduttiva e a oggi è considerato il miglior materiale da innesto utilizzabile con risultati positivi a lungo termine nella maggior parte dei casi clinici28, 29, 31, 33, 34, 38-40, 42.
Poiché la stragrande maggioranza dei casi di GBR è rappresentata dalla correzione di difetti limitati, è quasi sempre sufficiente eseguire un prelievo da siti intraorali, quali il corpo e il ramo della mandibola, inclusa la sinfisi mentoniera, o dal tuber mascellare. Sono stati descritti anche casi con prelievi extraorali, tipicamente dall’ala iliaca, ma solo nel caso di rigenerazioni con mesh in titanio in caso di difetti estesi.
Il ramo e il corpo della mandibola sono i siti di prelievo endorale più frequentemente adottati e consentono il prelievo della corticale esterna della mandibola nella regione compresa tra il primo molare e la linea obliqua esterna del ramo mandibolare. Il decorso post-operatorio è generalmente favorevole e sono molto rare le sequele neurologiche legate a possibili lesioni al nervo alveolare inferiore e al nervo linguale.
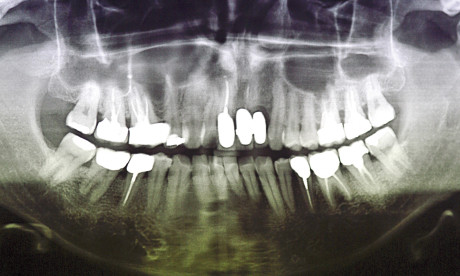
La sinfisi mentoniera consente il prelievo nella regione che si trova mesialmente ai due forami mentonieri e al di sotto degli apici dentali del gruppo incisivo-canino di circa 5 mm; il prelievo è sempre monocorticale e può comprendere anche la compagine spugnosa. Un evento spesso inevitabile e che può lasciare esiti permanti è rappresentato dalla parestesia degli elementi dentari anteriori a causa di una lesione al nervo incisivo.
Il tuber mascellare è un sito donatore utilizzato solo nel caso in cui il quantitativo di tessuto osseo necessario sia molto ridotto e dove con un’unica insisione si riesca a preparare il sito di prelievo e il sito donatore.
La qualità di quest’osso è molto scarsa per la carenza di componente corticale e per la presenza di una componente spugnosa poco densa e spesso ricca di tessuto adiposo.
2b. Altri materiali da innesto
Di materiali non autologhi, presentati sul mercato sia sotto forma di granuli di varie dimensioni, che in blocchetti preformati, esiste una grande varietà in commercio. I materiali da utilizzare devono essere supportati da adeguati studi preclinici e clinici per escludere effetti collaterali anche gravi quali quali l’immunogenicità, la trasmissione di malattie infettive, il potenziale cancerogeno eccetera29,35-37,40,44. Inoltre, devono presentare caratteristiche strutturali che simulino la struttura dell’osso autologo, in particolare la porosità. Questo fattore, dato che questi materiali sono solo osteoconduttivi e non osteoinduttivi, si dimostra di fondamentale importanza, in quanto è stato dimostrato che pori inferiori a 100 micron derterminano la formazione e la penetrazione all’interno del materiale non autologo di tessuto connettivo. Al contrario, è stato dimostrato come pori con diametro compreso tra i 200 e i 400 mm permettano una penetrazione e una crescita ottimale di tessuto precursore dell’osso49.
La procedura inizia con la formazione, dal primo coagulo ematico, di un tessuto di granulazione che ingloba il materiale trapiantato; segue una sostituzione del materiale con osso di neoformazione dovuto al passaggio di cellule osteoblastiche nella compagine del connettivo. Istologicamente appariranno isole di ossificazione con la presenza di osteoblasti sul fronte di avanzamento del tessuto osseo29,35-37,40,44.
a) L’osso omologo viene prelevato da cadaveri, generalmente dalla testa del femore, viene triturato, sterilizzato e congelato a -90 °C. Esiste in forma demineralizzata e mineralizzata.
b) L’osso eterologo è di origine animale, viene liofilizzato, sterilizzato e privato della componente organica.
c) I materiali alloplastici sono biomateriali con proprietà osteoconduttive caratterizzati da:
- bioinerzia: minima cessione di molecole con conseguente minima risposta flogistica;
- biocompatibilita: cessione di molecole senza reazione flogistica;
- bioattività: attività chimica di superficie che consente di creare legami stabili nel tempo con il tessuto osseo.
Tra I materiali più comunemente utilizzati si possono annoverare le idrossiapatiti (HA) non porose e porose, il β-fosfato tricalcico (TCP), la combinazione di HA e TCP e i biovetri.
Esula da questo articolo una descrizione dettagliata delle caratteristiche dei vari materiali. In conclusione, tuttavia, i materiali non autologhi presentano un variabile grado di capacità osteoconduttiva, mentre non hanno capacità osteoinduttive (solo l’osso omologo è stato dichiarato talvolta osteoinduttivo, ma esistono anche pareri contrari). Il loro ruolo è pertanto quello di «mantenitori di spazio» che al contempo consentano una progressiva sostituzione da parte di osso autologo. Bisogna tenere tuttavia presente che il loro riassorbimento in alcuni casi non è completo neppure dopo parecchi anni.
Descrizione della procedura chirurgica
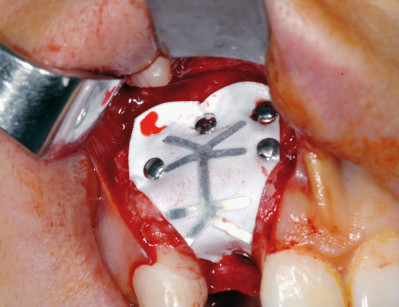
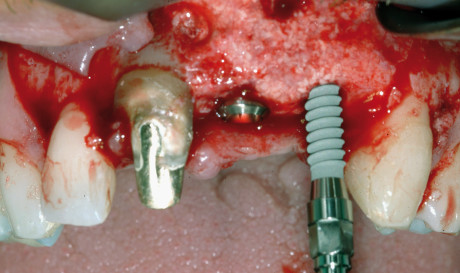
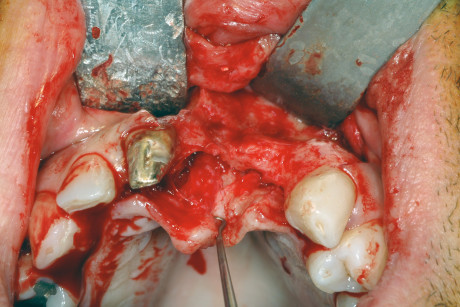
I principi di base per la realizzazione della rigenerazione ossea guidata (GBR) sono comuni sia se si utilizza una membrana riassorbibile che una non riassorbibile e consistono nell’allestimeto di un lembo a tutto spessore per l’esposizione del difetto, la rigenerazione ossea mediante l’uso di membrane e di materiali da innesto e la sutura ermetica dei lembi. Qui di seguito verranno descritte più in dettaglio le varie fasi.
L’intervento chirurgico ha inizio con un’incisione lineare a spessore totale in cresta lungo tutta l’estensione del difetto, associata, se necessario, a due incisioni di rilasciamento vestibolari anch’esse a spessore totale. Si procede quindi a un accurato scollamento sottoperiosteo del lembo, al fine di ottenere la miglior visibilità dell’area del difetto.
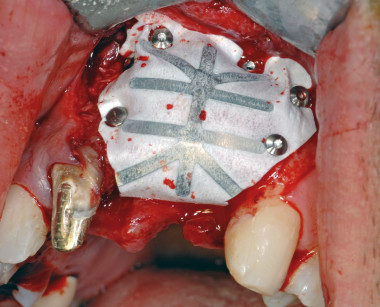
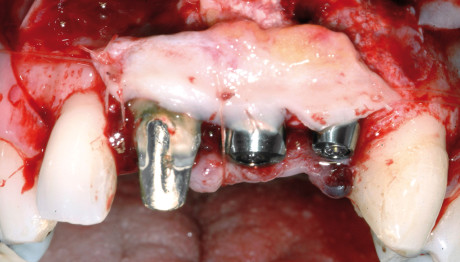
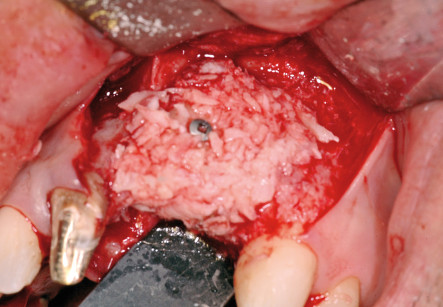
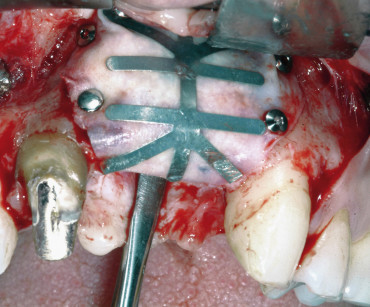
Se si decide di utilizzare osso autologo come riempitivo, si procede al prelievo di osso da siti intraorali come la sinfisi mentoniera, il ramo mandibolare o il tuber mascellare. I blocchetti ossei devono essere particolati mediante un apposito microtomo e il particolato osseo viene inserito nei difetti orizzontali o verticali e quindi immobilizzato mediante membrane adeguatamente modellate in base al difetto. È indicato fissare le membrane mediante microviti o chiodini in titanio se si adotta una membrana non riassorbibile; nel caso invece di riassorbibili è consigliato farlo per i difetti più estesi.
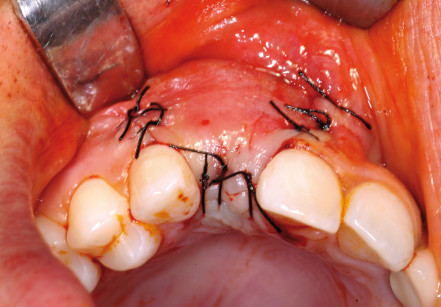
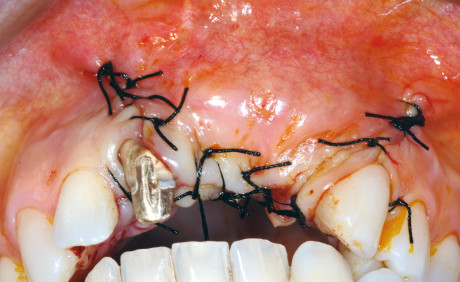
Durante l’intervento di GBR, sia orizzontale che verticale, nei casi in cui il difetto permetta comunque un’adeguata stabilità primaria degli impianti, si può procedere all’inserimento simultaneo di essi; nei casi in cui l’atrofia è più accentuata si esegue la sola procedura rigenerativa e gli impianti verranno inseriti a consolidamento del tessuto rigenerato avvenuto. Per garantire l’ermeticità della sutura e l’assenza di tensione del lembo, condizioni essenziali per prevenire una possibile deiscenza della ferita, è fondamentale eseguire adeguati rilasci periostali del lembo con l’uso di forbici chirurgiche.
Decorso post-operatorio
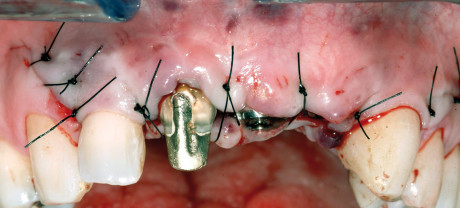
i pazienti devono essere trattati con antibiotici e analgesici non steroidei nel periodo post-operatorio. Si consiglia, inoltre, una dieta morbida per due settimane e l’utilizzo di un collutorio antisettico (clorexidina 0,12%) per il controllo domiciliare della placca batterica. Dopo un periodo di guarigione di 7-10 giorni, le suture devono essere rimosse.
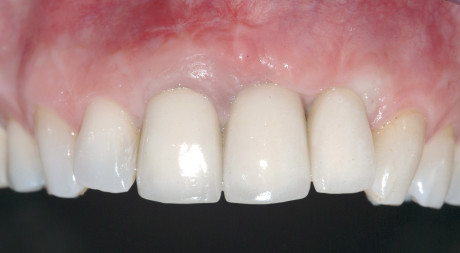
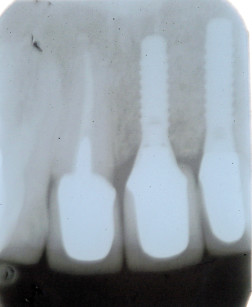
Nei pazienti sottoposti al primo intervento di sola GBR, dopo un periodo di attesa variabile tra 4 e 8 mesi, necessario per il consolidamento dell’osso neoformato, è necessario un secondo intervento chirurgico per la rimozione delle microviti o chiodini (se utilizzati) e della membrana (se non riassorbibile), e l’inserimento degli impianti effettuato con l’ausilio di dime chirurgiche realizzate in laboratorio sui modelli dei pazienti. Dopo ulteriori 4-6 mesi si può procedere all’inizio della riabilitazione protesica. Nei pazienti sottoposti a GBR contemporanea all’inserimento degli impianti dopo 4-8 mesi si può procedere all’inizio delle procedure protesiche.
Discussione
Le procedure di GBR si sono rivelate nel corso degli anni metodiche abbastanza predicabili: tuttavia esiste una grande variabilità nei risultati, legata non solo ai diversi materiali utilizzati, ma soprattutto all’estrema eterogeneicità dei dati riportati e alla spesso bassa qualità delle pubblicazioni. Ecco perché si rende necessaria una disamina della letteratura, al fine di fornire, per quanto possibile, informazioni affidabili e non opinioni personali.
In quest’analisi della letteratura sono stati valutati esclusivamente articoli in lingua inglese, pubblicati nel periodo 1980-2007, riguardanti la rigenerazione ossea guidata di creste atrofiche riabilitate con impianti endossei in titanio a forma di vite e con un follow-up minimo di 6 mesi dall’inizio del carico protesico. Sono stati raccolti 367 articoli e, tra questi, 17 pubblicazioni hanno rispettato i criteri d’inclusione stabiliti per questa revisione; gli articoli riportano i dati relativi a 1097 pazienti in cui sono stati inseriti 2002 impianti.
Alcune pubblicazioni, pur rispettando i criteri di inclusione, non sono state inserite nell’analisi qualora gli stessi dati fossero stati riportati in studi successivi dagli stessi autori. Dei 17 studi selezionati, 8 sono retrospettivi (4 dei quali multicentrici), 3 prospettici, 4 prospettici e comparativi e soltanto 2 riportano un confronto tra siti implantari trattati con GBR e siti controllo che non necessitavano di rigenerazione ossea.
I dati riportati in letteratura sembrano dimostrare che la rigenerazione ossea guidata (GBR) sia una tecnica chirurgica affidabile nel trattamento di difetti ossei orizzontali e/o verticali in pazienti parzialmente edentuli. Le percentuali di sopravvivenza implantare nelle zone trattate con GBR variano dal 92,6 al 100%, senza significative differenze tra GBR con membrane riassorbibili e non riassorbibili (incluse le griglie in titanio) e sono paragonabili a quelle di impianti inseriti in mascellari che non necessitano di procedure di incremento della dimensione ossea1-14. Il successo delle procedure chirurgiche di rigenerazione ossea guidata è stato documentato sia in caso di utilizzo di membrane non riassorbibili22,28,29,32,33,36,37,39, sia di membrane riassorbibili 30, 34, 35, 37, 40,50, sia di griglie in titanio31 ed è risultato compreso tra il 67 e il 100%.
Per quanto riguarda la GBR verticale, l’incremento dell’altezza ossea è risultato compreso tra 2 e 7 millimetri, mentre per la GBR orizzontale l’incremento trasversale è stato tra 2 e 4,5 millimetri. Analizzando le pubblicazioni disponibili sulla GBR in letteratura, comunque si evidenzia una qualità metodologica non sufficiente, in particolar modo riguardo a:
a) stabilità nel tempo dell’incremento della dimensione ossea ottenuta a seconda del tipo di rigenerazione effettuata (orizzontale e/o verticale);
b) valutazione del successo implantare secondo criteri ben definiti;
c) indicazioni precise per le procedure di GBR (in particolare in caso di difetti ossei limitati).
Ciò considerato, si ritiene che i seguenti argomenti necessitino di valutazioni più accurate nelle pubblicazioni future.
1. Stabilità dimensionale nel tempo dell’osso rigenerato
Le tecniche di rigenerazione ossea guidata dovrebbero essere idealmente valutate non soltanto per ciò che riguarda la sopravvivenza e il successo degli impianti inseriti nell’osso rigenerato, ma anche riguardo alla stabilità dimensionale nel tempo dello stesso. Per quanto riguarda la GBR verticale, il riassorbimento osseo peri-implantare è un indice adeguato per eseguire questa valutazione.
I dati riportati in due studi36, 42 dimostrano una stabilità dimensionale accettabile dell’osso rigenerato mediante GBR (da 1 a 2,9 millimetri di riassorbimento osseo peri-implantare, dopo un periodo di follow-up variabile tra 1 e 7 anni). Al contrario, il riassorbimento osseo peri-implantare non può essere considerato un indice adeguato per valutare la stabilità nel tempo dell’osso rigenerato mediante GBR orizzontale: pur restando un valido strumento per la valutazione del successo implantare, infatti, non fornisce alcuna informazione sulle modificazioni a carico dell’osso rigenerato orizzontalmente. Ciò significa che persino la perdita totale dell’osso rigenerato non è visibile nè valutabile utilizzando radiografie iuxtagengivali o panoramiche.
Purtroppo, la maggior parte degli studi considerati riportano dati sul
riassorbimento osseo peri-implantare verticale, ma non riportano alcun dato riguardante il rissorbimento osseo orizzontale22,28,30,32,34,37,39,40.
Soltanto un gruppo di autori ha valutato la stabilità dimensionale nel tempo dell’osso rigenerato madiante GBR orizzontale33: questo studio dimostra come l’incremento osseo inizialmente ottenuto subisca un significativo processo di contrazione nel tempo (pari al 40% del volume osseo rigenerato).
Per queste ragioni, appare raccomandabile una valutazione della stabilità dimensionale nel tempo dell’osso rigenerato con GBR utilizzando mezzi quali le scansioni TC o, per evitare gli elevati costi biologici di queste, con mezzi più semplici quali per esempio i calibri chirurgici, come suggerito da alcuni autori33.
2. Percentuale di successo degli impianti
Mentre la percentuale di sopravvivenza degli impianti inseriti in siti trattati con GBR è riportata in tutti gli studi analizzati oscillando tra il 77 e il 100%, soltanto
pochi studi riportano la percentuale di successo implantare secondo criteri ben definiti.
Ciò può rappresentare un limite nella valutazione circa l’affidabilità delle tecniche di GBR, poiché un’elevata percentuale di sopravvivenza implantare può non corrispondere a un’elevata percentuale di successo.
3. Indicazioni delle procedure di GBR
La necessità di utilizzare membrane per ottenere un’adeguata copertura peri-implantare in caso di difetti orizzontali/verticali limitati è tuttora discutibile. Solamente 2 studi caso-controllo sono stati reperiti in questo studio30,37.
È stato dimostrato che le percentuali di sopravvivenza e successo di impianti inseriti in siti rigenerati mediante GBR non differiscono significativamente rispetto a quelli relativi a impianti inseriti in osso nativo non rigenerato. Si potrebbe assumere che un moderato riassorbimento del processo alveolare, che porti a una riduzione soltanto parziale del contatto osso-impianto, non debba portare necessariamente al fallimento dell’impianto o a un peggioramento del risultato funzionale e/o estetico di questo. In tal caso, la domanda alla quale parrebbe opportuno dare risposta negli studi futuri è quale sia la quantità di superficie implantare esposta considerabile come limite oltre il quale si verifica un’effettiva compromissione dell’osseointegrazione24.
4. Tempo di inserimento implantare
Un altro aspetto che dovrebbe essere attentamente analizzato è la tempistica dell’inserimento implantare. Soltanto un gruppo di autori40 ha confrontato i risultati ottenuti tra l’inserimento implantare eseguito congiuntamente alle procedure di GBR e l’inserimento implantare differito.
Gli autori concludono che un approccio in due tempi (inserimento implantare differito) può comportare un minor rischio di elevate percentuali di riassorbimento osseo crestale rispetto all’approccio simultaneo (inserimento implantare all’atto delle procedure di GBR), nonostante non siano state rilevate differenze a livello clinico tra pazienti trattati con l’uno o l’altro approccio.
5. Scelta del materiale da innesto
Negli studi analizzati, il successo delle procedure di GBR e degli impianti inseriti nelle zone trattate è stato ottenuto con una grande varietà di materiali di riempimento,
come il semplice coagulo sanguigno22, 28, 36,40, osso autologo28,29,31,33,34,38,39,40,42, alloinnesti29,36, 44, xenoinnesti e/o materiali alloplastici37,40 e idrossiapatite35.
Nonostante ciò, risulta impossibile dare al clinico indicazioni definitive riguardo alla scelta del materiale da innesto, a causa della scarsità di studi caso-controllo comparativi che mettano a confronto materiali differenti. Soltanto uno studio tra quelli analizzati40 riporta dati riguardanti procedure di GBR eseguite con l’utilizzo di osso autologo o idrossiapatite bovina quali materiali di riempimento. Gli autori concludono osservando come l’utilizzo del materiale autologo e del materiale non autologo abbia portato a risultati positivi e sovrapponibili.
È da precisare, tuttavia, la frequente mancanza di dati riguardo la quantità iniziale di osso nativo prima delle procedure di rigenerazione.
6. Scelta della membrana
Il successo delle procedure di GBR è stato ottenuto sia con l’utilizzo di membrane riassorbibili che di membrane non riassorbibili. Va comunque sottolineato come frequentemente entrambi i tipi di membrana (così come membrane del medesimo tipo ma di materiali diversi) siano stati utilizzati all’interno dello stesso studio, senza correlare le percentuali di successo con il tipo di membrana.
È pertanto difficile trarre conclusioni significative riguardo la correlazione tra tipo di membrana e percentuali di successo degli interventi di rigenerazione e degli impianti inseriti nei siti rigenerati.
Soltanto un gruppo di autori40 ha riportato e confrontato dati riguardanti membrane riassorbibili e non riassorbibili, concludendo che non esistono differenze nei risultati clinici tra i due tipi. Questi risultati vanno comunque considerati con cautela, perché riferiti a difetti iniziali molto limitati, come fenestrazioni e deiscenze; queste conclusioni potrebbero pertanto non essere applicabili in caso di trattamento di difetti estesi, in paricolare in caso di GBR verticale.
Casistica personale
Nel periodo 1994-2005 sono stati trattati con tecnica di GBR 123 pazienti, di cui 105 presentavano difetti orizzontali (creste sottili) e 18 difetti verticali.
Sono stati inseriti in totale 303 impianti (Nobelbiocare e Straumann), di cui 263 nei pazienti con difetti orizzontali e 40 in quelli con difetti verticali: gli impianti sono stati monitorati con esami clinici e controlli radiografici ogni 12 mesi considerando i seguenti parametri:
a) incremento osseo verticale o orizzontale ottenuto con le procedure di rigenerazione ossea;
b) misurazione radiografica del riassorbimento osseo peri-implantare mesialmente e distalmente a ogni impianto.
L’incremento osseo ottenuto mediante GBR verticale è stato misurato e monitorato attraverso la misurazione (con righelli millimetrati trasparenti) e il confronto tra le ortopantomografie eseguite nelle varie fasi del trattamento e del follow-up. L’incremento osseo ottenuto mediante GBR orizzontale è stato misurato e monitorato tramite misurazioni eseguite con calibri chirurgici e misurazioni eseguite con un righello millimetrato trasparente su TC.
- La distorsione dimensionale tra le
- diverse ortopantomografie è stata
- corretta considerando le reali dimensioni delle corone dentarie e degli impianti.
Il riassorbimento osseo peri-implantare è stato misurato sulle radiografie di controllo, confrontando quelle eseguite immediatamente dopo l’inserimento implantare con quelle eseguite al momento del carico protesico e successivamente ogni 12 mesi. Le misurazioni sono state effettuate mesialmente e distalmente a ogni impianto, misurando con un righello millimetrato trasparente la distanza tra l’apice dell’impianto e la zona di contatto più coronale tra tessuto osseo e impianto. Le misurazioni sono state arrotondate al mezzo millimetro più vicino.
La distorsione dimensionale legata alle panoramiche e al confronto tra di esse è stata corretta tenendo conto delle reali dimensioni degli impianti.
La stabilità degli impianti è stata testata manualmente, utilizzando i manici di due specchietti odontoiatrici.
La percentuale di successo degli impianti è stata valutata secondo i criteri proposti da Albrektsson et al.1.
Risultati
L’entità della rigenerazione ossea ottenuta con le procedure di GBR è risultata compresa tra 2 e 5 millimetri nella GBR orizzontale e tra 2 e 7 millimetri nella GBR verticale. Il decorso post-operatorio è stato privo di complicanze per la maggior parte dei pazienti. Nel gruppo di pazienti trattati con GBR orizzontale (105), si sono verificate 6 esposizioni della membrana con infezione della stessa e parziale compromissione del risultato finale. Nel gruppo di pazienti trattati con GBR verticale (18), si sono verificate 4 esposizioni precoci della membrana, di cui 1 senza conseguenze rilevanti, 2 con parziale riassorbimento del materiale innestato, e 1 con perdita completa dell’innesto particolato.
La percentuale di successo della procedura chirurgica è pertanto risultata pari al 94,2% per quanto riguarda la GBR orizzontale, e all’83,4% per la GBR verticale.
Nel periodo di follow-up dall’inizio del carico protesico, compreso tra 12 e 132 mesi (media: 82 mesi), sono stati rimossi 7 impianti in pazienti trattati con GBR orizzontale; le percentuali di sopravvivenza implantare sono perciò risultate pari a 100% per gli impianti inseriti in pazienti trattati con GBR verticale, e pari al 93.6% per gli impianti inseriti in pazienti trattati con GBR orizzontale.
Le percentuali di successo implantare, valutate secondo i criteri proposti da Albrektsson et al.1, sono risultate del 92,5% (impianti immediati) e del 93,6% (impianti differiti) per gli impianti inseriti in aree trattate con GBR orizzontale.
In caso di GBR verticale, il successo è stato del 70,5% nel caso di inserimento contestuale e dell’87% per gli impianti inseriti in un secondo tempo.
Conclusioni
La nostra esperienza clinica, in accordo con la letteratura scientifica, indica che la rigenerazione ossea guidata delle creste atrofiche a scopo implantare risulta essere una metodica efficace nel caso di difetti ossei di piccola entità in quanto riduce la morbilità dell’intervento rispetto ad altre tecniche chirurgiche quali l’innesto osseo di apposizione, la distrazione osteogenetica e l’espansione della cresta alveolare. Tuttavia l’uso di membrane aumenta il rischio di deiscenza della ferita con conseguente infezione e possibile compromissione del risultato.
Poiché tale rischio può essere correlato all’estensione del difetto e quindi alla superficie della membrana, in caso di difetti ampi sembra più indicato ricorrere a innesti senza l’uso di membrane, anche alla luce del fatto che l’uso di membrane in difetti ampi non è supportato da sufficiente esperienza clinica.
Corrispondenza – Correspondence
Prof. Matteo Chiapasco
c/o Clinica Odontoiatrica
Via Beldiletto 1/3 – 20142 Milano
Tel. 02.50319000
Fax 02.50319040
matteo.chiapasco@unimi.it
• Matteo Chiapasco*
• Fulvio Gatti*
• Antonella Vizzari**
* Unità di Chirurgia Orale (direttore: Prof. Matteo Chiapasco) Clinica Odontoiatrica, Dipartimento di Medicina, Chirurgia e Odontoiatria, A.O. San Paolo Università degli Studi di Milano
** Unità di ortognatodonzia (direttore: prof.ssa Giovanna Garattini) Clinica odontoiatrica, Dipartimento di Medicina, Chirurgia e odontoiatria, A.O. S.Paolo, Università degli Studi di Milano
2. Albrektsson T. A multicenter report on osseointegrated oral implants. Journal of Prosthetic Dentistry 1988;60:75-84.
3. van Steenberghe D. A retrospective multicenter evaluation of the survival rate of osseointegrated fixtures supporting fixed partial prostheses in the treatment of partial edentulism. Journal of Prosthetic Dentistry 1989;61:217-223.
4. van Steenberghe D, Lekholm U, Bolender C, Folmer T, Henry P, Herrmann I, Higuchi K. The applicability of osseointegrated oral implants in the rehabilitation of partial edentulism: A prospective multicenter study of 558 fixtures. The International Journal of Oral and Maxillofacial Implants 1990;5:272-281.
5. van Steenberghe D, Brånemark PI, Quirynen M, De Mars G, Naert I. The rehabilitation of oral defects by osseointegrated implants. Journal of Clinical Periodontology 1991;18:488-493.
6. Adell R, Lekholm U, Gröndahl K, Brånemark PI, Lindström J, Jacobsson M. Reconstruction of severely resorbed edentulous maxillae using osseointegrated fixtures in immediate autogenous bone grafts. The International Journal of Oral and Maxillofacial Implants 1990;5:233-246.
7. Arvidson K, Bystedt H, Frykholm A, von Konow L, Lothigius E. Five-year prospective follow-up report of Astra Tech Implant System in the treatment of edentulous mandibles. Clinical Oral Implants Research 1998;9:225-234.
8. Laney W, Jemt T, Harris D, Henry PJ, Krogh PHJ, Polizzi G, Zarb GA, Herrmann I. Osseointegrated implants for single tooth replacement: Progress report from a multicenter prospective study after 3 years. The International Journal of Oral and Maxillofacial Implants 1991;6:29-36.
9. Lekholm U, van Steenberghe D, Herrmann I, Bolender C, Folmer T, Gunne J, Henry P, Higuchi K, Laney WR. Osseointegrated implants in the treatment of partially edentulous jaws: A prospective 5-year multicenter study. The International Journal of Oral and Maxillofacial Implants 1994;9:627-635.
10. Lekholm U, Gunne J, Henry P, Higuchi K, Lindén U, Bergström C, van Steenberghe D. Survival of the Brånemark implant in partially edentulous jaws: a 10-year prospective multicenter study. The International Journal of Oral and Maxillofacial Implants 1999;14:639-45.
11. Leonhardt A, Grondahl K, Bergstrom C, Lekholm U. Long-term follow-up of osseointegrated titanium implants using clinical, radiographic and microbiological parameters. Clinical Oral Implants Research 2002;13:127-132.
12. Lindquist LW, Carlsson GE, Jemt TA. A prospective 15-year follow-up study of mandibular fixed prostheses supported by osseointegrated implants. Clinical results and marginal bone loss. Clinical Oral Implants Research 1996;7:329-336.
13. Buser D, Mericske-Stern R, Bernard JP, Behneke A, Behneke N, Hirt HP, Belser UC, Lang NP. Long-term evaluation of non-submerged ITI implants. Part I: 8-year life table analysis of a prospective multicenter study with 2359 implants. Clinical Oral Implants Research 1997;8:161-172.
14. Weber HP, Crohin CC, Fiorellini JP. A 5-year prospective clinical and radiographic study of non-submerged dental implants. Clinical Oral Implants Research 2000;11:144-153.
15. Urist MR. Bone: Formation by autoinduction. Science 1965;150:893-899.
16. Reddi AH, Weintroub S, Muthukumaram N. Biologic principles of bone induction. Orthopedic Clinics of North America 1987;18:207-212.
17. Burchardt H. The biology of bone graft repair. Orthopedics and Related Research 1983;174:28-42.
18. Ilizarov GA. The tension-stress effect on the genesis and growth of tissues: Part I. The influence of stability of fixation and soft tissue preservation. Clinical Orthopedics 1989a;238:249-281.
19. Ilizarov GA. The tension-stress effect on the genesis and growth of tissues: Part II. The influence of the rate and frequency of distraction. Clinical Orthopedics 1989b;239:263-285.
20. Dahlin C, Linde A, Gottlow J, Nyman S. Healing of bone defects by guided tissue regeneration. Plastic Reconstructive Surgery 1988;81:672-676.
21. Dahlin C, Sennerby L, Lekholm U, Linde A, Nyman S. Generation of new bone around titanium implants using a membrane technique: an experimental study in rabbits. The International Journal of Oral and Maxillofacial Implants 1989;4:19-25.
22. Dahlin C, Andersson L, Linde A. Bone augmentation at fenestrated implants by an osteopromotive membrane technique. A controlled clinical study. Clinical Oral Implants Research 1991;2:159-165.
23. Hämmerle CHF, Schmid J, Olah AJ, Lang NP. A novel model system for the study of experimental guided bone formation in humans. Clinical Oral Implants Research 1996;7:38-47.
24. Hämmerle CH, Jung RF, Feloutzis A. A systematic review of the survival of implants in bone sites augmented with barrier membranes (guided bone regeneration) in partially edentulous patients. Journal of Clinical Periodontology 2002;29:226-231.
25. Kostopoulos L, Karring T. Guided bone regeneration in mandibular defects in rats using a bioresorbable polymer. Clinical Oral Implants Research 1994;5:66-74.
26. Kostopoulos L, Karring T, Uraguchi R. Formation of jawbone tuberosities by guided tissue regeneration. An experimental study in the rat. Clinical Oral Implants Research 1994;5:245-253.
27. Nyman SR, Lang NP. Guided tissue regeneration and dental implants. Periodontology 2000 1994;4:109-118.
28. Buser D, Dula K, Lang NP, Nyman S. Long-term stability of osseointegrated implants in bone regenerated with the membrane technique. Clinical Oral Implants Research 1996;7:174-183.
29. Nevins M, Mellonig JT, Clem III DS, Reiser GM, Buser DA. Implants in regenerated bone: long-term survival. The International Journal of Periodontics & Restorative Dentistry 1998;18:35-45.
30. Mayfield L, Skoglund A, Nobréus N, Attström R. Clinical and radiographic evaluation, following delivery of fixed reconstructions, at GBR treated titanium fixtures. Clinical Oral Implants Research 1998;9:292-302.
31. von Arx T, Wallkamm B, Hardt N. Localized ridge augmentation using a micro titanium mesh: a report on 27 implants followed from 1 to 3 years after functional loading. Clinical Oral Implants Research 1998;9:123-130.
32. Becker W, Dahlin C, Lekholm U, Bergstrom C, van Steenberghe D, Higuchi K, Becker DE. Five-year evaluation of implants placed at extraction and with dehiscences and fenestration defects augmented with e-PTFE membranes: results from a prospective multicenter study. Clinical Implant Dentistry and Related Research 1999;1:27-32.
33. Chiapasco M, Abati S, Romeo E, Vogel G. Clinical outcome of autogenous bone blocks or guided bone regeneration with e-PTFE membranes for the reconstruction of narrow edentulous ridges. Clinical Oral Implants Research 1999;10:278-288.
34. Lorenzoni M, Pertl C, Polansky RA, Wegscheider WA. Guided bone regeneration with barrier membranes – a clinical and radiographic follow-up study after 24 months. Clinical Oral Implants Research 1999;10:16-23.
35. Brunel G, Brocard D, Duffort JF, Jacquet E, Justumus P, Simonet T, Benqué E. Bioabsorbable materials for guided bone regeneration prior to implant placement and 7-year follow-up: Report of 14 cases. Journal of Periodontology 2001;72:257-264.
36. Simion M, Jovanovic SA, Tinti C, Parma-Benfenati S. Long-term evaluation of osseointegrated implants inserted at the time or after vertical ridge augmentation. A retrospective study on 123 implants with 1-5 year follow-up. Clinical Oral Implants Research 2001;12:35-45.
37. Zitzmann NU, Schärer P, Marinello CP. Long-term results of implants treated with guided bone regeneration: A 5-year prospective study. The International Journal of Oral & Maxillofacial Implants 2001;16:355-366.
38. Buser D, Ingimarsson S, Dula K, Lussi A, Hirt HP, Belser UC. Long-term stability of osseointegrated implants in augmented bone: A 5-year prospective study in partially edentulous patients. The International Journal of Periodontics & Restorative Dentistry 2002;22:108-117.
39. Lorenzoni M, Pertl C, Polansky RA, Jakse N, Wegscheider WA. Evaluation of implants placed with barrier membranes. A retrospective follow-up study up to five years. Clinical Oral Implants Research 2002;13:274-280.
40. Christensen DK, Karoussis IK, Joss A, Hämmerle CHF, Lang NP. Simultaneous or staged installation with guided bone augmentation of transmucosal titanium implants. A 3-year prospective cohort study. Clinical Oral Implants Research 2003;14:680-686.
41. van Steenberghe D, Johansson C, Quirynen M, Molly L, Albrektsson T, Naert I. Bone augmentation by means of a stiff occlusive titanium barrier. A study in rabbits and humans. Clinical Oral Implants Research 2003;14:63–71.
42. Chiapasco M, Romeo E, Casentini P, Rimondini L. Alveolar distraction osteogenesis vs vertical guided bone regeneration for the correction of vertically deficient edentulous ridges: a 1–3-year prospective study on humans. Clinical Oral Implants Research 2004a;15:82-95.
43. Chiapasco M, Consolo U, Bianchi A, Ronchi P. Alveolar distraction osteogenesis for the correction of vertically deficient edentulous ridges: a multicenter prospective study on humans. International Journal of Oral & Maxillofacial Implants 2004b;19:399-407.
44. Fugazzotto PA. Success and failure rates of osseointegrated implants in function in regenerated bone for 72 to 133 months. International Journal of Oral & Maxillofacial Implants 2005;20:77-83.
45. Esposito M, Grusovin MG, Kwan S, Worthington HV, Coulthard P. Interventions for replacing missing teeth: bone augmentation techniques for dental implant treatment. Cochrane Database of Systematic Reviews 2008, Issue 3.
46. Kay S, et al. Guided bone regeneration: integration of a resorbable membrane and bone graft material. In pract Periodontics Aesthet Dent 1997 Mar;9(2):185-94
47. Hämmerle CHF, Jung RE, Yaman D, Lang NP. Ridge augmentation by applying bioresorbable membranes and deproteinized bovine bone mineral: a report of twelve consecutive cases. Clin Oral Imp Res 2008;19:19-25.
48. Jung RE, Lecloux G, Rompen E, Ramel CF, Buser D, Hammerle CHF. A feasibility study evaluating an in situ formed synthetic biodegradable membrane for guided bone regeneration in dogs. Clin Oral Imp Res 20, 2009;151-161.
49. Klein M, Goetz H, Pazen S, Al-Nawas B, Wagner W, Duschner H. Pore characteristics of bone substitute materials assessed by microcomputed tomography. Clin Oral Impl Res 2009;20:67-74.
50. Brocard D, Barthet P, Baysse E, Duffort JF, Eller P, Justumus P, Marin P, Oscaby F, Simonet T, Benqué E, Brunel G. A multicenter report on 1,022 consecutively placed ITI implants: A 7-year longitudinal study. The International Journal of Oral & Maxillofacial Implants 2000;15:691-700.



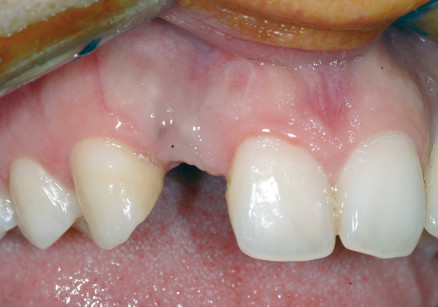
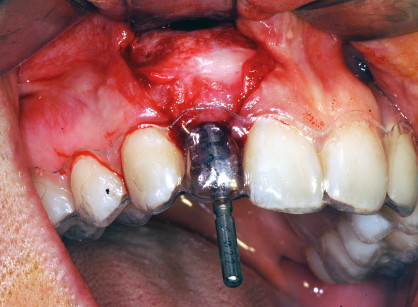
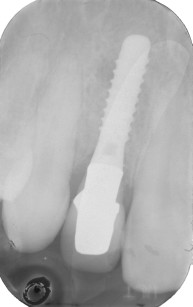
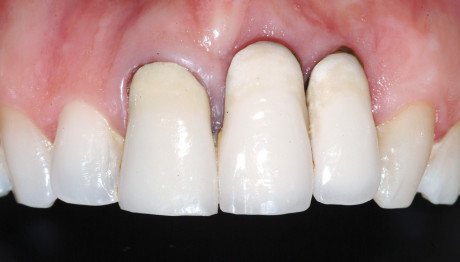





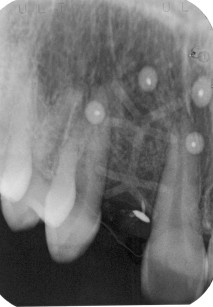
[…] principio di base della rigenerazione ossea guidata (GBR) prevede il posizionamento di barriere meccaniche definite membrane per proteggere coaguli di […]
[…] anche come GBR, la rigenerazione ossea ai scopi implantari prevede l’utilizzo di membrane e di sostituti […]
[…] termine chirurgia ossea rigenerativa indica un insieme di metodologie chirurgiche finalizzate al ripristino della struttura ossea in […]