La Fibrina Ricca di Piastrine (PRF) e Derivato della Matrice dello Smalto (EMD) nel trattamento dei difetti infraossei paradontali a 2-3 pareti: uno studio clinico comparativo
Laureanda: Lara Angela Filippo
Relatore: Chiar.mo Prof. Michele Paolantonio
Controrelatore: Chiar.mo Prof. Marco Dolci
INTRODUZIONE
Lo scopo del presente studio è stata la valutazione in vitro della infiltrazione marginale di due diverse specie microbiche al livello della connesione fixture-abutment, l’adattamento marginale delle stesse e la valutazione delle dimensioni del microgap (interfaccia I-A) in due diverse connessioni implantari.Per ciascun gruppo la parte interna di cinque impianti, è stata inoculata con 0.1μl di una sospensione di E. Faecalis e gli altri cinque con una sospensione A. Aggregatibacter .
Tutti i campioni preparati con E. faecalis sono stati incubati in condizioni aerobiche a 37 ° C; tutti i campioni inoculati A. Aggregatibacter sono stati incubati a 37 ° C in presenza di CO2 al 5 % .I difetti infraossei parodontali a 3 pareti, secondo lo studio di Ellegard e Loe, hanno un alto potenziale di guarigione se trattati con il solo open flap debridement. Secondo Cortellini et al., difetti a tre pareti poco ampi (angolo radiografico minore di 25°) e molto profondi trattati con GTR offrono risultati ottimali grazie al loro notevole potenziale rigenerativo.
Un approccio terapeutico alternativo è dato dalla Rigenerazione Parodontale Indotta attraverso l’utilizzo di un Derivato della Matrice della Smalto (EMD), di derivazione suina. Le proteine della matrice dello smalto, in gran parte amelogenine, sono secrete dalla guaina di Hertwig durante lo sviluppo embrionale, e favoriscono la differenziazione delle cellule mesenchimali dello strato interno del follicolo dentale in cementoblasti, dando origine alla cementogenesi.
Studi sull’ EMD hanno dimostrato che, in vitro, stimola la proliferazione delle cellule del legamento parodontale ed inibisce quella delle cellule epiteliali ed inoltre l’ EMD di origine suina, induce una risposta immunitaria limitata e sembra essere un biomateriale con elevati margini di sicurezza. L’ EMD, usato da solo, o in combinazione con riempitivi, ha mostrato capacità rigenerative sia su animali sia nell’uomo, migliorando i parametri clinici di PPD e CAL in difetti infraossei profondi, a livelli significativamente superiori rispetto ad un classico lembo di accesso e sovrapponibili a quelli della GTR.
Il PRF è un concentrato piastrinico di seconda generazione largamente utilizzato per accelerare la guarigione dei tessuti molli e duri grazie alla presenza di molti fattori di crescita (bFGF, VEGF, TGFβ e il PDGF). I fenomeni chiave che sono alla base della guarigione e della maturazione dei tessuti molli sono rappresentati dall’angiogenesi, dal controllo immunitario e dalla maturazione degli epiteli; le membrane di PRF sono in grado di favorire simultaneamente lo sviluppo di tutti e 3 questi fenomeni.
Diversi autori hanno dimostrato che la matrice di fibrina rappresenta un supporto ottimale per le cellule staminali mesenchimali allo scopo di ottenere rigenerazione in difetti ossei. Quindi lo scopo di questo studio è quello di confrontare l’ efficacia clinica dell’ uso di PRF rispetto all’ EMD nel trattamento di difetti infraossei a 2-3 pareti.
MATERIALI E METODI
Sono stati trattati 24 pazienti, non fumatori, affetti da parodontite cronica generalizzata di grado moderato o severo con almeno 1 difetto infraosseo a 2-3 pareti. La chirurgia parodontale è stata eseguita dopo 6 mesi (T0) dal trattamento parodontale causale. 12 pazienti sono stati trattati con PRF (gruppo PRF) e 12 pazienti con EMD (gruppo EMD). In ogni paziente è stato selezionato un solo sito chirurgico. La procedura chirurgica ha previsto, per entrambi i gruppi, il sollevamento di un lembo secondo la tecnica del Lembo con Preservazione della Papilla Semplificato, il debridement del difetto con strumenti manuali e ultrasonici.
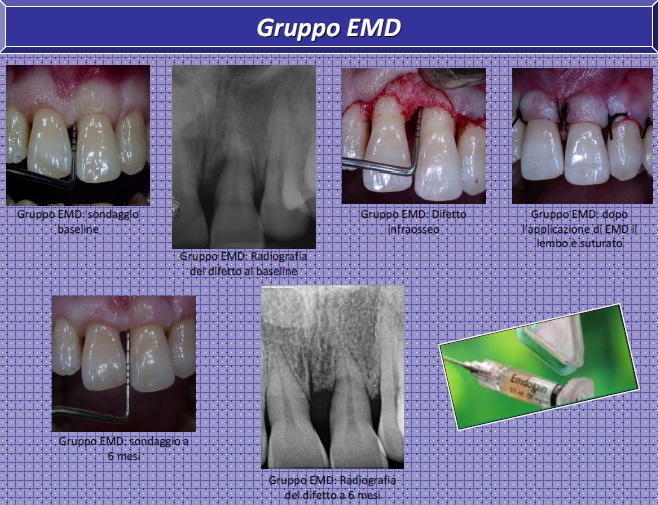
Nel gruppo PRF il difetto è stato riempito con PRF, poi coperto con membrana di PRF dello spessore di circa 0,5 mm ottenuta mediante prelievo di 10 ml di sangue venoso, raccolto in una provetta sterile senza l’aggiunta di alcun anticoagulante e poi centrifugato immediatamente con una centrifuga PC-02 a 3000 giri per 10 minuti. Per il gruppo EMD, sulla radice ed all’interno del difetto infraosseo è stato posizionato EMD. In entrambi i gruppi, dopo aver eseguito le incisioni di rilascio del periostio il lembo è stato coronalizzato e suturato.
Non è stato applicato alcun impacco chirurgico a protezione dell’area. Al baseline (T0) e a 6 mesi (T1) è stato effettuato un esame clinico e radiografico. I dati pre-operatori sono stati comparati a quelli post-operatori nei due differenti trattamenti, utilizzando indici s i a c l in i c i ( PPD, CAL , GR) ch e r a d io g r a f i c i (RBG: Rad io gr a f i c Bon e Gain, pari alla differenza valutatata su radiogrammi endorali della distanza tra il fondo del difetto e la giunzione amelocementizia rispettivamente prima e dopo il trattamento).
RISULTATI
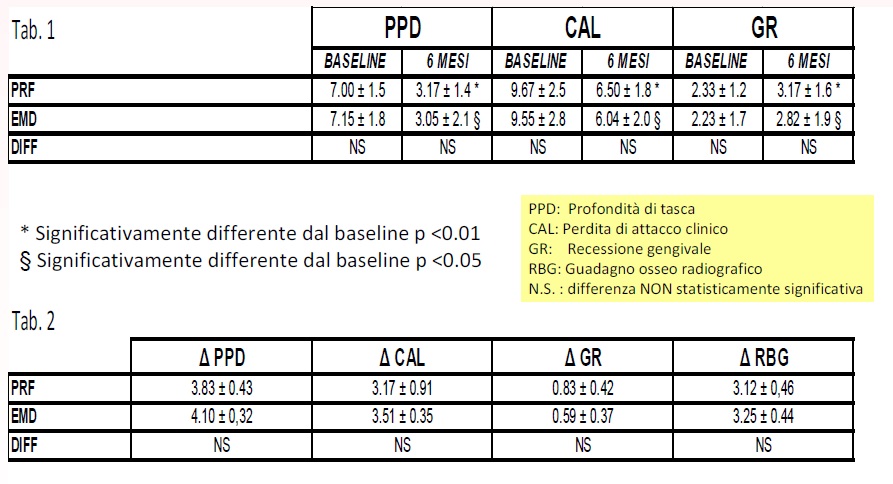
Si è avuta completa guarigione dei siti chirurgici e non si è osservato nessun caso di infezione post-operatoria. A 6 mesi dalla chirurgia (T1) tutti i parametri clinici e radiografici dimostravano significativi cambiamenti all’interno di ogni gruppo (p<0,001) (Tabella 1). A T1, entrambi i gruppi sperimentali mostravano simile riduzione di PPD, guadagno di CAL, incremento di GR e RBG, con nessuna differenza statisticamente significativa fra i 2 gruppi sperimentali (Tabella 2).
DISCUSSIONE
Questo studio ha lo scopo di valutare l’efficacia clinica del PRF nel trattamento dei difetti infraossei a 2-3 pareti confrontando i risultati clinici e radiografici ottenuti, con quelli derivanti dall’uso dell’EMD, che è già usato con successo nella rigenerazione parodontale. I nostri dati sostengono l’ipotesi che il posizionamento di PRF o di EMD nel trattamento di difetti infraossei parodontali a 2-3 pareti, produce miglioramenti delle condizioni cliniche e radiografiche senza nessuna differenza significativa fra i 2 gruppi sperimentali. Non essendo presente in letteratura comparazioni simili, questo studio potrebbe rappresentare un punto di partenza per ulteriori indagini sulle potenzialità del PRF.
Rilevanza clinica della tesi
Attraverso questo studio possiamo concludere che l’utilizzo di PRF rappresenta un approccio semplice ed efficace, minimamente invasivo per il paziente come anche l’uso dell’ EMD ma, a differenza di quest’ultimo, è un materiale completamente autologo che consente di evitare eventuali reazioni immunitarie nel sito trattato. Il PRF permette di ridurre i costi per il clinico, che sono notevoli per l’acquisto del materiale eterologo, consentendo di ottenere risultati clinici sovrapponibili a quelli ottenuti con EMD nel trattamento dei difetti parodontali a 2-3 pareti.
1. Ellegard B, Low H. New attachment of periodontal tissues after treatment of infrabony lesions. J Periodontol 1971; 42: 648-652.
2. Gestrelius S, Andersson C, Lidström D, Hammarström L, SomermanM. In vitro studies on periodontal ligament cells and enamel matrix derivative. J Clin Periodontol 1997; 24: 685-692.
3. Hammarström L. Enamel matrix, cementum development and regeneration. J Clin Periodontol 1997; 24. 658-668.
4. Peteinaki E, nikolopoulos S, castanes E. Low stimolation of peripheral lymphocytes following in vitro application of Emdogain. J Clin Periodontol 1998; 25: 715-720.
5. Heijl L, Heden G, Svärdström G, Östgren A. Enamel matrix derivative (EMDOGAIN) in the treatment of intrabony periodontal defects. J Clin Periodontol 1997; 24: 705-714.
6. Esposito M, Coulthard P, Worthington H.V., Thomsen P. Enamel matrix derivative for periodontal tissue regeneration in treatment of intrabony defects: A Cochrane systematic review. J Dental Education 2004; 68(8): 834-844.
7. Dohan DM, Choukroun J, Diss A, Dohan SL, Dohan AJ, Mouhyi J, Gogly B. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part I:technological concept and evolution. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006 Mar;101(3):e37-44
8. Carroll, Amoczky, Graham, O’Connel. Characterization of autologous growth factors in cascade platelet rich fibrin matrix (PRFM). Musculoskeletal transplant foundation 2005.
9. Bonucci E, Marini E, Valdinucci F, Fortunato G. Osteogenic response to hydroxyhapatite- fibrin implants in maxillofacial bone defects. Eur J Oral Sci 1997; 105: 557-61.
10. BensaidW, Triffitt JT, Blanchat C, Oudina K, Sedel L, Petite H. A biodegradable fibrin scaffold for mesenchymal stem cell transplantation. Biomaterials 2003; 24:2497-502.
UNIVERSITA’ DEGLI STUDI “G. D’ANNUNZIO” CHIETI
Corso di Laurea in Odontoiatria e Protesi dentaria
Dipartimento di Scienze Mediche, Orali e Biotecnologiche