Nella pratica clinica odontoiatrica l’uso dei farmaci può essere richiesto essenzialmente per due motivi:
- a scopo terapeutico (la terapia farmacologica è parte integrante del piano terapeutico e mira alla soluzione di un problema infettivo e/o flogistico);
- a scopo profilattico (i farmaci sono in questo caso un supporto in varie tipologie terapeutiche odontoiatriche).
La profilassi farmacologica negli interventi di chirurgia orale si pone i seguenti obiettivi:
- prevenire le complicanze settiche;
- controllare il dolore;
- limitare l’edema tissutale;
- trattare il disturbo d’ansia.
I casi nei quali i farmaci hanno un ruolo terapeutico complementare all’atto chirurgico non saranno oggetto della presente disamina.
Qui di seguito presentiamo una revisione critica delle indicazioni e caratteristiche di utilizzo nello studio odontoiatrico a scopo profilattico pre-, intra- e post-operatorio in soggetti di classe ASA I e II, delle seguenti categorie di farmaci: disinfettanti e antibiotici, antinfiammatori, analgesici, sedativi e ipnotici.
Il controllo delle complicanze settiche
Il controllo delle complicanze settiche si ottiene sostanzialmente con le seguenti modalità:
1. protocollo chirurgico adeguato;
2. profilassi antimicrobica tramite uso combinato di:
a) disinfettanti antisettici per controllare la carica microbica intra- e peri-orale,
b) somministrazione pre-operatoria di antibiotici per via sistemica (orale o parenterale) al fine di ottenere una concentrazione efficace di farmaco nel plasma e nei tessuti orali. Tale concentrazione dovrà essere superiore alla Minima Concentrazione Inibente al momento dell’intervento e tale dovrà rimanere per tutta la sua durata.
Benché questa trattazione verta sui farmaci, è indispensabile evidenziare che il primo punto è di fondamentale importanza. La sterilizzazione dello strumentario, l’asepsi degli ambienti operatori e la condotta chirurgica sono fattori imprescindibili di ogni attività chirurgica, com’è prevalentemente quella odontoiatrica. Questo è tanto più vero considerando le varie tipologie di prestazioni che sono giornalmente eseguite nei comuni studi odontoiatrici. È necessario, quindi, che tutti i fattori igienici e di tecnica operatoria vengano considerati per una corretta pianificazione ed esecuzione chirurgica.
Nessun farmaco, infatti, sarà in grado di prevenire un’infezione se l’atto chirurgico non è stato eseguito secondo rigorosi parametri igienici o se la condotta operatoria è stata inappropriata. Infatti, se il nostro obiettivo è la prevenzione delle complicanze settiche della ferita chirurgica orale, dovremo considerare che la tipologia dell’intervento e la sua modalità d’esecuzione influenzano il rischio infettivo. Ciò significa che in alcune situazioni particolarmente complesse dovremo fronteggiare un’infezione già presente al momento dell’operazione oppure una ferita con un rischio infettivo post-chirurgico diverso da quello previsto.
In altre parole, va sempre tenuto presente che lo scopo della somministrazione di farmaci disinfettanti e antimicrobici a scopo profilattico in chirurgia orale non è l’ottenimento dell’antisepsi assoluta del campo chirurgico, ma la riduzione al minimo della contaminazione batterica nel sito operatorio; in questo modo, si possono ridurre drasticamente le complicanze infettive post-operatorie. Tale obiettivo si può raggiungere con l’uso combinato di sostanze disinfettanti il cavo orale e di concentrazioni efficaci di antibiotico nel sangue del paziente e nei tessuti orali per tutta la durata dell’intervento. Il rischio di contaminazione batterica della ferita chirurgica, di solito, cessa quando la stessa viene chiusa1-4.
Nella Tabella 1 è illustrata la classificazione degli interventi chirurgici in base al rischio infettivo post-operatorio con alcuni esempi.
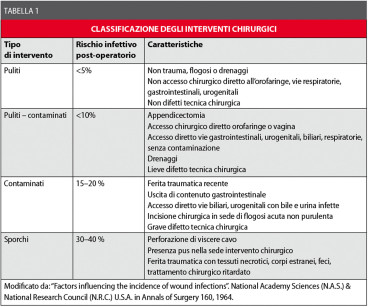 Per ottenere un buon controllo delle infezioni post-chirurgiche, la profilassi deve essere mirata al tipo di chirurgia. In generale, per le prime due tipologie d’intervento chirurgico (interventi “puliti” e “puliti-contaminati”) si può parlare propriamente di profilassi antimicrobica, con le caratteristiche che vedremo più avanti.
Per ottenere un buon controllo delle infezioni post-chirurgiche, la profilassi deve essere mirata al tipo di chirurgia. In generale, per le prime due tipologie d’intervento chirurgico (interventi “puliti” e “puliti-contaminati”) si può parlare propriamente di profilassi antimicrobica, con le caratteristiche che vedremo più avanti.
Per le ultime due, invece (interventi “contaminati” e interventi “sporchi”), si deve parlare piuttosto di antibiotico-terapia precoce, poiché in questi casi il sito chirurgico è da considerarsi già infetto al momento dell’intervento e ovviamente lo è rimasto successivamente.
Ad esempio, gli interventi di chirurgia implantare associati a prelievi di osso autologo per innesti sono classificabili come puliti-contaminati; in questo caso è indicata ed è sufficiente una profilassi antimicrobica con antibiotici.
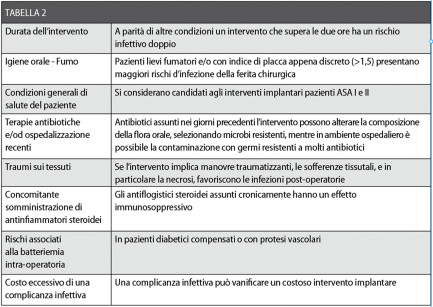
A questa si associa una disinfezione locale della ferita chirurgica attuata dallo stesso paziente fino alla rimozione dei punti di sutura. Tuttavia, in alcuni casi è preferibile adottare un regime di antibiotico-terapia, sulla base dell’esito dell’intervento e di altre considerazioni riassunte in Tabella 2 che dovranno essere valutate caso per caso.
 In sintesi, la tipologia dell’intervento chirurgico influenza l’approccio farmacologico, in base al tipo di microrganismo più frequentemente coinvolto in una particolare complicanza e alla condotta del chirurgo5-12. Inoltre, in alcuni casi, sia la complessità che la tipologia dell’intervento possono rendere la chirurgia “contaminata”, per cui il rischio d’infezione si può protrarre nel tempo; da ciò deriva la necessità di passare dall’antibiotico-profilassi a una vera e propria antibiotico-terapia per tempi adeguati, a seconda dell’evoluzione del processo di guarigione6,7,11-14.
In sintesi, la tipologia dell’intervento chirurgico influenza l’approccio farmacologico, in base al tipo di microrganismo più frequentemente coinvolto in una particolare complicanza e alla condotta del chirurgo5-12. Inoltre, in alcuni casi, sia la complessità che la tipologia dell’intervento possono rendere la chirurgia “contaminata”, per cui il rischio d’infezione si può protrarre nel tempo; da ciò deriva la necessità di passare dall’antibiotico-profilassi a una vera e propria antibiotico-terapia per tempi adeguati, a seconda dell’evoluzione del processo di guarigione6,7,11-14.
Disinfettanti
I disinfettanti sono sostanze utilizzate per uso topico al fine di abbattere e controllare la carica microbica del cavo orale e della cute peri-operatoria. Tra i composti ad azione antimicrobica quelli più frequentemente usati con successo in chirurgia orale sono qui di seguito elencati.
Preparati a base di iodio. Lo iodio in soluzione alcolica (tintura di iodio) o veicolato da molecole carrier (iodio polivinilpirrolidone) è usato molto efficacemente per la disinfezione della cute peri-operatoria15,16. È molto utile anche per la disinfezione della ferita cutanea nella zona del prelievo dell’innesto osseo nei giorni successivi all’intervento.
Risulta inoltre utile per la disinfezione pre-operatoria della cute delle mani risultando più efficace della clorexidina acquosa al 4% quando queste risultino contaminate da batteri Gram negativi17.
Preparati a base di clorexidina.
a) Soluzione allo 0,2% per sciacqui orali (sciacquo per 1 minuto immediatamente prima dell’intervento, 2 sciacqui al giorno per 1 minuto fino a 30 giorni dopo l’intervento).
b) Gel all’1% da usare come dentifricio nel periodo post-operatorio e da applicare localmente sulla ferita per la sua disinfezione.
c) Soluzioni al 4% sono per la disinfezione delle mani e della cute.
Dopo oltre 20 anni di impiego clinico la clorexidina è considerata come lo standard di riferimento con cui viene valutata l’attività antimicrobica di altre sostanze antisettiche18. La principale azione sui microrganismi, alle concentrazioni d’impiego, è di tipo batteriostatico; a più elevate concentrazioni esercita un’azione battericida19.
Numerosi Autori hanno dimostrato che in assenza di igiene orale domiciliare è possibile inibire la formazione di placca batterica e la conseguente infiammazione gengivale eseguendo uno sciacquo di 1 minuto, due volte al giorno, con una soluzione di clorexidina allo 0,2%20-23.
I principali effetti collaterali sono la pigmentazione bruna dei denti, della lingua e di alcuni materiali protesici, e con minore frequenza un’alterazione reversibile della sensibilità gustativa. Esiste una notevole variabilità individuale alla predisposizione a formare pigmenti24,25. In chirurgia orale è consigliato praticare uno sciacquo di 1 minuto con soluzione allo 0,2% prima dell’intervento, seguito da 2 sciacqui al giorno fino a un mese dopo26. La soluzione di clorexidina 0,2% è altresì indicata per il controllo della placca batterica in altre situazioni27,28.
Antibiotici
Negli interventi puliti-contaminati di chirurgia orale la contaminazione è principalmente endogena, per cui i microbi che possono svolgere un ruolo patogeno sono per la maggior parte gli stessi che costituiscono la flora saprofita del cavo orale; la gamma di potenziali patogeni è perciò molto ampia e comprende specie Gram positivi, Gram negativi, aerobi, anaerobi e microaerofili.
I criteri guida per la scelta dei farmaci antibiotici da utilizzare a scopo profilattico sono noti ormai da svariati anni1-14:
- farmaci ad azione battericida;
- spettro d’azione adeguato;
- concentrazione efficace nei tessuti orali, superiore alle MIC del maggior numero possibile di batteri patogeni previsti per il tipo di chirurgia;
- tossicità scarsa o nulla;
- buona tollerabilità;
- comoda posologia.
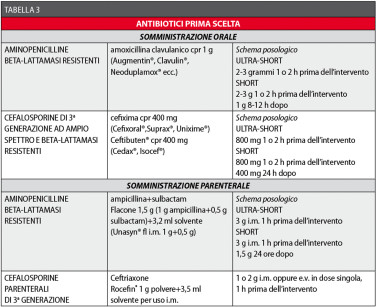
I farmaci antibiotici maggiormente rispondenti a queste caratteristiche, e quindi da considerarsi di prima scelta, sono le aminopenicilline, appartenenti al gruppo delle penicilline semisintetiche ad ampio spettro (amoxicillina, ampicillina, bacampicillina) e alcune cefalosporine29-49.
Bisogna altresì considerare che alcune specie batteriche anaerobie e beta-lattamasi produttrici possono avere un ruolo primario nelle complicanze di interventi chirurgici implantari, rigenerativi e parodontali; tali microbi, in quanto beta-lattamasi
produttori, sono resistenti alle comuni aminopenicilline29-37.
In questi casi, i farmaci efficaci contro i batteri beta-lattamasi produttori sono l’amoxicillina+acido clavulanico, alcune cefalosporine, l’ampicillina+sulbactam e il metronidazolo (un antibiotico nitroimidazolico).
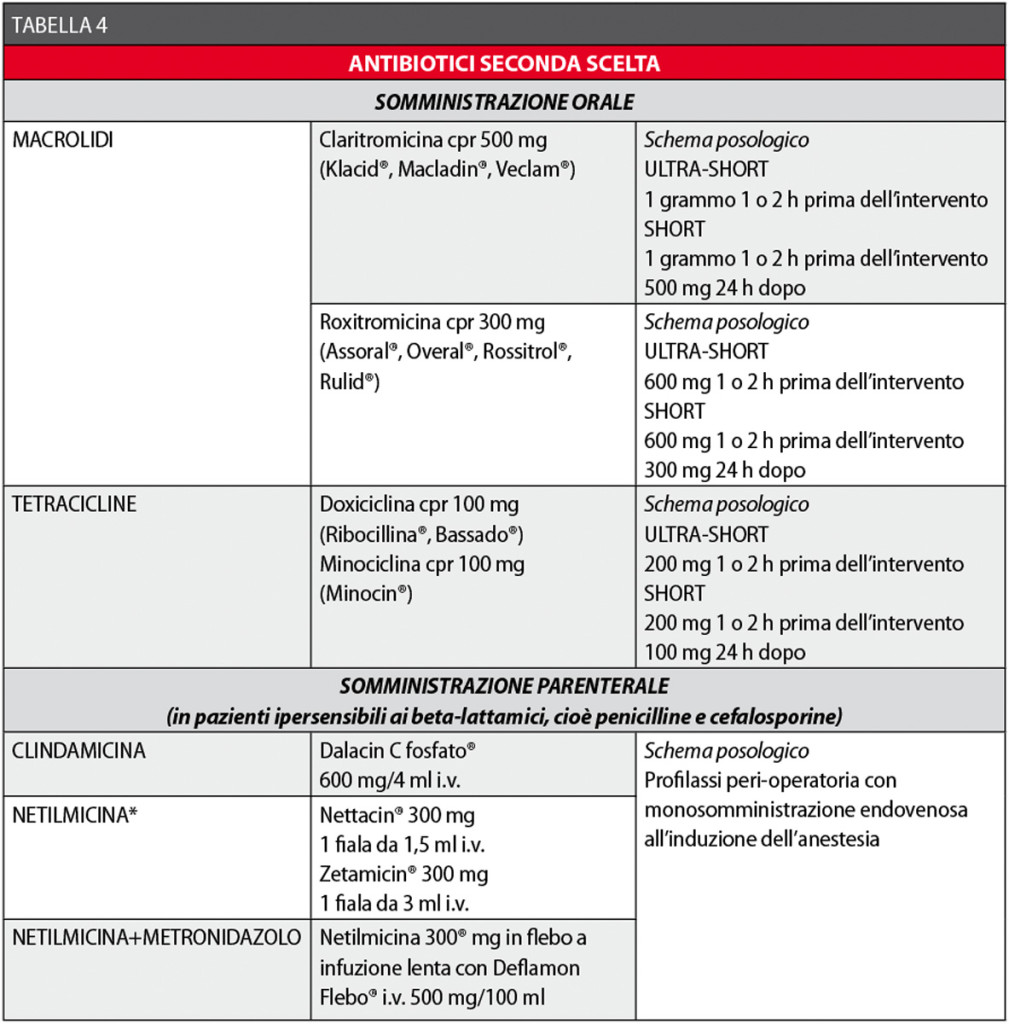
In caso di allergia alle penicilline e/o alle cefalosporine, un’utile alternativa è rappresentata dai macrolidi38-42.
Per quanto concerne i criteri di somministrazione degli antibiotici, poiché il maggior rischio di infezioni post-operatorie si ha entro circa 3 ore dalla contaminazione del tessuto, è in questo periodo che l’antibiotico deve rendersi efficace.
Negli interventi “puliti-contaminati” è consigliabile una durata dell’antibiotico-profilassi per un tempo adeguatamente calibrato. Abitualmente si fa riferimento alle seguenti categorie:
a) ultra-short-term (mono-somministrazione pre-operatoria, 1-2 ore prima dell’intervento);
b) short-term (1 somministrazione pre-operatoria 1-2 ore prima, proseguita per 24-48 ore).
Numerosi studi hanno rivelato l’inutilità di somministrazioni prolungate di antibiotici a scopo profilattico, specie negli interventi con basso rischio infettivo13,14.
Uno scorretto uso degli antibiotici può determinare fenomeni di selezione di ceppi batterici resistenti, con tutte le immaginabili conseguenze e complicanze di difficile gestione. Una corretta profilassi antibiotica deve porsi come obiettivo anche quello di non creare fenomeni di resistenza batterica. Gli schemi posologici sopra riportati sono quelli che minimizzano questo rischio e ottengono la massima copertura anti-infettiva efficace13-22.
Le Tabelle 3 e 4 riassumono i concetti sin qui esposti.
 Il controllo del dolore e dell’edema
Il controllo del dolore e dell’edema
Ogni atto chirurgico determina una reazione infiammatoria dei tessuti cruentati, la cui intensità è di solito proporzionale all’entità del trauma; il dolore e l’edema post-operatorio sono le dirette conseguenze di tale reazione flogistica. Ecco perché in chirurgia orale si presenta spesso la necessità di alleviare la sintomatologia algica e l’edema post-operatori.
Perciò è indicato l’uso di farmaci per il controllo della flogosi e del dolore. I tipi di farmaci consigliabili per tale scopo nella chirurgia orale sono elencati in Tabella 543-60.
 Farmaci antinfiammatori non steroidei (fans)
Farmaci antinfiammatori non steroidei (fans)
I FANS formano una vasta ed eterogenea categoria di sostanze, con in comune la mancanza di una struttura steroidea e la capacità di intervenire sul processo flogistico principalmente attraverso il blocco della produzione delle prostaglandine (PGs), tramite l’inibizione dell’enzima cicloossigenasi indotto nel tessuto infiammato (COX2).
Altri meccanismi d’azione antiflogistica, diversi a seconda del farmaco, sono:
inibizione della migrazione e attivazione dei fagociti;
inibizione dei fattori flogogeni del complemento;
inibizione degli enzimi lisosomiali, radicali liberi ossidanti e altro ancora.
Le molecole che sono in grado di attraversare la barriera ematoencefalica bloccano anche la produzione di prostaglandine ipotalamiche, esplicando un effetto antipiretico58-60.
Le PGs sono tra le principali sostanze ad attività flogogena diretta e indiretta; tuttavia, nella genesi della flogosi concorrono anche altri fattori (sistema istaminergico e serotoninergico, complemento, chinine, leucotrieni, enzimi lisosomiali, radicali dell’ossigeno, sistema immunitario ecc.) che solo in parte possono essere influenzati dai FANS. Perciò, la loro efficacia antiflogistica è inferiore rispetto ai cortisonici56,58-60.
Clinicamente, si osservano differenze non trascurabili, in termini sia di efficacia che di effetti collaterali, tra i vari FANS. Peraltro, esiste anche per un medesimo FANS una discreta variabilità individuale di efficacia e di complicanze, solo in parte giustificabile con l’effetto placebo. Le spiegazioni di questo fenomeno non sono completamente chiare, anche se indubbiamente entrano in gioco fattori farmacocinetici e farmacogenomici. Le modalità e la specificità dell’azione inibitoria sulle cicloossigenasi (COX1 – COX2) e le caratteristiche farmacocinetiche delle varie sostanze sono in gran parte responsabili della possibile diversità dell’effetto antiinfiammatorio e della maggiore o minore incidenza di effetti collaterali (Tabella 6).
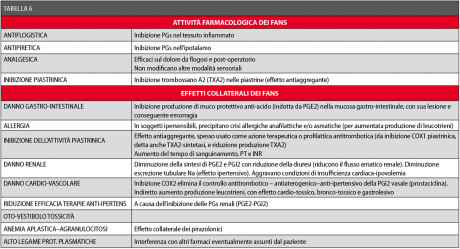 Questi ultimi sono principalmente legati all’inibizione dell’enzima cicloossigenasi costituzionale COX1, responsabile della fisiologica produzione di PGs a livello vasale (azione antitrombotica della prostaciclina PGI2), piastrinico (azione aggregante del trombossano TXA2), gastro-intestinale (regolazione produzione HCl e muco da parte della PGE2), renale (aumento del flusso ematico, della diuresi e dell’escrezione tubulare di Na)49,58-63.
Questi ultimi sono principalmente legati all’inibizione dell’enzima cicloossigenasi costituzionale COX1, responsabile della fisiologica produzione di PGs a livello vasale (azione antitrombotica della prostaciclina PGI2), piastrinico (azione aggregante del trombossano TXA2), gastro-intestinale (regolazione produzione HCl e muco da parte della PGE2), renale (aumento del flusso ematico, della diuresi e dell’escrezione tubulare di Na)49,58-63.
Peraltro, anche isoforme dell’enzima inducibile COX2 sarebbero costitutive in alcuni distretti vascolari (ove presiederebbe alla sintesi della prostaciclina PGI2, che svolge una fondamentale azione fisiologica antitrombotica), a livello renale (regolazione del flusso ematico) e a livello della mucosa gastro-intestinale (ove favorisce i meccanismi di riparazione). Inoltre, l’inibizione dell’enzima COX incrementa indirettamente la produzione di leucotrieni, poiché aumenta la quantità di substrato disponibile (acido arachidonico) per l’enzima lipoossigenasi.
Questi fatti sembrerebbero alla base della tossicità generale dei FANS e, in particolare, degli effetti collaterali cardiovascolari di alcuni recenti farmaci inibitori specifici dell’enzima COX2 (Coxib®)64-74.
Riguardo a questi ultimi, dobbiamo evidenziare che fino al 2001 la F.D.A. (Food and Drug Association) non ha approvato alcun Coxib per uso analgesico. Diversi studi successivi hanno dimostrato una netta correlazione tra eventi avversi cardio-vascolari e l’uso più o meno prolungato dei Coxib®. Peraltro, un recente studio ha dimostrato come il rischio cardio-vascolare non sia ristretto solo alla categoria dei Coxib, ma anche ai comuni FANS (con l’eccezione del naproxene) usati nella pratica clinica per patologie croniche (ibuprofene, diclofenac). In particolare, il rischio d’infarto miocardico acuto sarebbe dose-dipendente per tutti i farmaci sopra citati mentre per il diclofenac e il rofecoxib il rischio persisterebbe anche a basse dosi. Questi fatti ne sconsigliano l’uso indiscriminato che ne viene spesso fatto75.
In conclusione, lo spettro di attività dei FANS è legato alla dose e alla più o meno selettiva inibizione delle varie isoforme degli enzimi COX1 e COX2. Gli inibitori selettivi della COX1 riducono la sintesi piastrinica di trombossano A2 e sono perciò antitrombotici (FANS aspirino-simili); essi causano anche una diminuzione della produzione di PGE2 gastro-intestinali. Tuttavia, il maggior effetto gastro-lesivo si osserva con i FANS-COX inibitori non selettivi (anti-COX1 e anti-COX2) poiché anche la produzione fisiologica di PGE2 nell’intestino è legata all’attività dell’enzima COX2. Per questo i FANS non selettivi possiedono sia azione antinfiammatoria e analgesica che tossicità gastrointestinale e renale. Gli inibitori selettivi della COX2, come i Coxib®, sviluppati per ridurre gli effetti avversi gastrointestinali aumentano il rischio cardiovascolare, attraverso un aumento della pressione arteriosa, dell’aterogenesi e della trombifilia; ciò perché l’enzima COX2 presiede la sintesi di PgI2 (prostaciclina vasodilatrice e antitrombotica, inibita dai Coxib) nelle cellule endoteliali vasali che contrasta l’azione del TXA2 prodotto nelle piastrine dalla COX1 (azione trombotica e aggregante piastrinica, non inibita dai Coxib)76-77.
L’evidenza di recenti dubbi sul profilo di sicurezza cardiovascolare dei Coxib giustifica una particolare cautela nel loro uso, per cui questi inibitori selettivi della cicloossigenasi-2 non dovrebbero essere preferiti ai FANS non selettivi, a meno che non vi sia un’indicazione specifica (per esempio, in caso di rischio molto elevato di ulcera, perforazione o sanguinamento gastrointestinale) e comunque soltanto dopo un’attenta valutazione del rischio cardiovascolare. Dosi elevate nel trattamento a lungo termine con i FANS non selettivi comportano un lieve aumento del rischio di eventi trombotici (come infarto miocardico e ictus). Il diclofenac e l’etoricoxib aumentano il rischio trombotico, mentre il naprossene è associato a un rischio inferiore. Dosi elevate di ibuprofene (2-4 g al giorno) possono determinare un lieve aumento di rischi trombotici, mentre dosi basse del farmaco (1-2 g al giorno o meno) non aumentano il rischio di infarto miocardico78. Le diverse raccomandazioni emanate a tal proposito dalle agenzie regolatorie, quali EMEA e FDA, possono sinteticamente riassumersi nella raccomandazione generale di utilizzare i FANS o gli inibitori selettivi della cicloossigenasi 2, nel trattamento sintomatico, alla dose minima efficace e per il periodo più breve possibile. Molti studi, anche recenti, indicano che l’uso dei FANS (soprattutto ad alte dosi) a lungo termine può essere associato a un aumento del rischio di eventi trombotici arteriosi. Uno studio evidenzia che anche l’uso a breve termine (meno di una settimana) dei FANS può essere associato a un aumentato rischio di morte e di infarto miocardico (IM) in pazienti con pregresso IM. Un altro studio suggerisce che l’uso dei FANS può essere associato a un aumentato rischio di fibrillazione atriale o di flutter atriale79.
Tutti i FANS sono associati a tossicità gastrointestinale grave; il rischio maggiore è per gli anziani80.
In sintesi, i FANS sono farmaci da utilizzare con cautela, non solo nei soggetti con ipersensibilità specifiche, ma anche negli anziani (che hanno un aumento della frequenza di reazioni avverse ai FANS, specialmente emorragie e perforazioni gastrointestinali), negli ipertesi, nei pazienti in terapia anticoagulante, nei cardiopatici, nei nefropatici, negli asmatici, nei pazienti con colite ulcerosa o ulcera gastro-duodenale. L’uso concomitante di agenti protettori (misoprostolo e/o inibitori di pompa protonica) deve essere considerato per questi ultimi pazienti e anche per soggetti che assumono basse dosi di aspirina come antiaggregante o altri farmaci che possono aumentare il rischio di eventi gastrointestinali (corticosteroidi orali, anticoagulanti come warfarin, inibitori selettivi della ricaptazione della serotonina). Se queste categorie di pazienti si sottopongono a interventi chirurgici orali, il controllo del dolore post-operatorio è più efficacemente ottenuto con analgesici centrali o con associazioni che consentano di ridurre il dosaggio dei FANS e dei loro effetti collaterali (ad esempio, l’associazione analgesici centrali con paracetamolo). In sintesi, nella scelta di un FANS adeguato si dovrà tenere conto di alcuni parametri81-83:
- specificità dell’azione antiinfiammatoria, espressa solo a livello della flogosi, preferibilmente nei soli tessuti orali, senza influenzare le cicloossigenasi costituzionali di altri distretti corporei;
- molteplice meccanismo d’azione antiinfiammatorio, legato non solo al blocco della produzione delle PGs ma esteso anche a tutti gli altri fattori che sostengono la flogosi;
- bassa tossicità (non lesività gastrica e renale, non influenza sulla coagulazione);
- caratteristiche farmacocinetiche tali da consentire una comoda posologia.
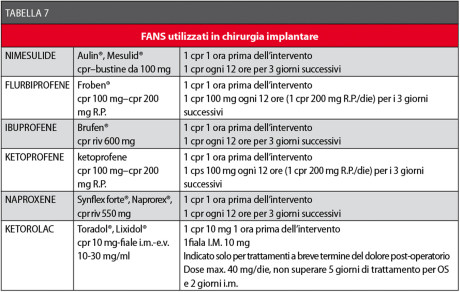
Purtroppo, nessuno dei farmaci attualmente disponibili presenta tutte queste caratteristiche ideali, per cui la scelta si dovrà basare sui principali dati farmacologici e clinici attualmente a disposizione58-62,81-90. In Tabella 7 sono elencati i FANS utili negli interventi chirurgici orali, con relativa posologia81-97.
 L’indicazione alla somministrazione pre-operatoria dei FANS trova la sua giustificazione farmacologica nel fatto che la loro capacità di antagonizzare la produzione delle prostaglandine è maggiore prima dell’insorgenza della flogosi; infatti, i FANS
L’indicazione alla somministrazione pre-operatoria dei FANS trova la sua giustificazione farmacologica nel fatto che la loro capacità di antagonizzare la produzione delle prostaglandine è maggiore prima dell’insorgenza della flogosi; infatti, i FANS
non sono in grado in genere di bloccare gli effetti delle PGs sui loro recettori, eccezion fatta per alcuni fenamati59-61.
Farmaci antiinfiammatori steroidei (cortisonici)
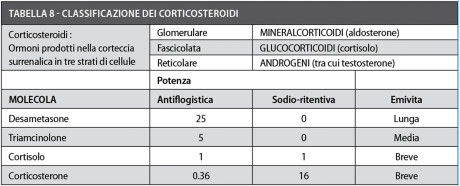
Sono sostanze a struttura steroidea i cui effetti sono simili a quelli degli ormoni glucocorticoidi, sintetizzati dalla corteccia surrenale (Tabella 8).
 Inoltre, esplicano un potente effetto antiflogistico e antiallergico.
Inoltre, esplicano un potente effetto antiflogistico e antiallergico.
Sono, infatti, in grado di bloccare il processo infiammatorio in tutte le sue fasi, indipendentemente dalla causa che lo ha provocato.
Il meccanismo d’azione principale è legato all’induzione della sintesi di una proteina, la lipocortina, che inibisce l’enzima fosfolipasi A2, che a sua volta rende disponibile l’acido arachidonico dai fosfo-lipidi delle membrane cellulari. L’acido arachidonico è il substrato che viene trasformato da altri due enzimi:
- la cicloossigenasi (COX1 – COX2) che sintetizza le prostaglandine (PGs) e i trombossani;
- la lipoossigenasi che sintetizza i leucotrieni.
I cortisonici possiedono inoltre attività immunosoppressiva, per cui possono facilitare le sovra infezioni, specie negli interventi contaminati. Ritardano in genere la guarigione delle ferite per il loro effetto inibitorio sulla sintesi proteica55-57.
Nella Tabella 9 sono riassunte le azioni dei corticosteroidi53,55-57.
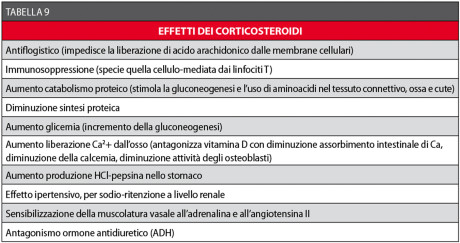 Possono essere classificati in base alla loro emivita in composti a breve, intermedia e lunga durata d’azione. Quelli a emivita lunga e intermedia sono dotati del maggior potere antiflogistico e della più bassa azione sodio-ritentiva. In particolare, nella nostra esperienza il desametasone (Soldesam Forte® fiale 2 ml/8 mg) è il farmaco più indicato e una fiala può essere somministrata pre-operatoriamente i.m. o nella zona operatoria anestetizzata localmente.
Possono essere classificati in base alla loro emivita in composti a breve, intermedia e lunga durata d’azione. Quelli a emivita lunga e intermedia sono dotati del maggior potere antiflogistico e della più bassa azione sodio-ritentiva. In particolare, nella nostra esperienza il desametasone (Soldesam Forte® fiale 2 ml/8 mg) è il farmaco più indicato e una fiala può essere somministrata pre-operatoriamente i.m. o nella zona operatoria anestetizzata localmente.
Recenti studi clinici controllati (in doppio cieco con placebo) hanno evidenziato che l’effetto della premedicazione con desametasone, somministrato un’ora prima dell’intervento, ha aumentato il tasso di successo nell’ambito sia della chirurgia endodontale98 che periodontale99, riducendo significativamente edema e dolore. Ulteriori studi sono tuttavia necessari per validare questi risultati in casistiche più numerose, e per chiarire se la premedicazione con steroidi comporti un reale vantaggio rispetto a quella con Coxib100 o con FANS101.
I criteri generali sull’uso dei cortisonici come antiflogistici sono riassunti in Tabella 10. Teoricamente, il loro sfavorevole effetto sul metabolismo osseo costituisce una contro-indicazione relativa negli interventi di chirurgia orale rigenerativa. Tuttavia, per il loro uso peri-operatorio limitato nel tempo a pochi giorni, non è mai stato dimostrato uno specifico effetto negativo degli steroidi sull’osteo-integrazione, in particolare negli impianti dentali102.
 Viceversa, numerosi vantaggi clinici sono stati descritti, laddove il trauma chirurgico è stato intenso, come in interventi di chirurgia implantare associata a innesti ossei particolarmente complessi52,53,55-57,102-105.
Viceversa, numerosi vantaggi clinici sono stati descritti, laddove il trauma chirurgico è stato intenso, come in interventi di chirurgia implantare associata a innesti ossei particolarmente complessi52,53,55-57,102-105.
Farmaci analgesici centrali
Sono sostanze in grado di controllare solo il sintomo algico, senza agire sulla flogosi che ne è la causa.
Tuttavia, il loro potere analgesico è in grado di alleviare il dolore anche in assenza di FANS o cortisonici, ai quali peraltro possono essere associati.
In questo modo, possono essere ridotti drasticamente i dosaggi degli antiflogistici non steroidei, diminuendone così anche i loro effetti collaterali, particolarmente sfavorevoli in alcune categorie di pazienti, come sopra richiamato a proposito dei FANS44,123-125. I farmaci analgesici centrali si possono classificare come oppiacei e non oppiacei (Tabella 11).
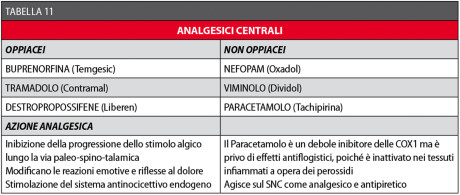 Entrambe le categorie di farmaci presentano vantaggi e svantaggi che dovranno essere valutati caso per caso.
Entrambe le categorie di farmaci presentano vantaggi e svantaggi che dovranno essere valutati caso per caso.
In generale, nei pazienti che sono sottoposti a interventi di chirurgia implantare non vi sono controindicazioni assolute all’uso di questi farmaci.
È bene ricordare, però, che generalmente queste sostanze (a eccezione del paracetamolo) alterano anche altre modalità sensoriali oltre a quella nocicettiva, per cui è consigliabile per questi pazienti non guidare veicoli o svolgere lavori pericolosi dopo la loro assunzione.
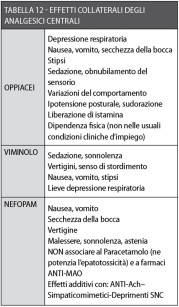
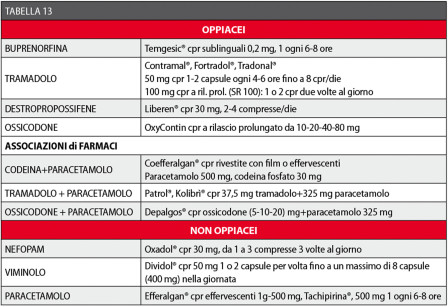
Gli effetti collaterali sono riassunti in Tabella 12, mentre in Tabella 13 sono elencati i farmaci consigliabili in chirurgia orale con le relative posologie43,44,46,106-113.
 Controllo dell’ansia
Controllo dell’ansia
Nella pratica clinica odontoiatrica è talvolta necessario utilizzare farmaci sedativi, per ottenere nei pazienti ansiosi la collaborazione necessaria all’espletamento dell’intervento. Inoltre, l’uso di strumenti di lavoro potenzialmente pericolosi in un ambiente ristretto e generalmente di difficile accesso come il cavo orale rende necessaria la collaborazione del paziente.
Un soggetto eccessivamente ansioso è un ostacolo alle cure dentarie.
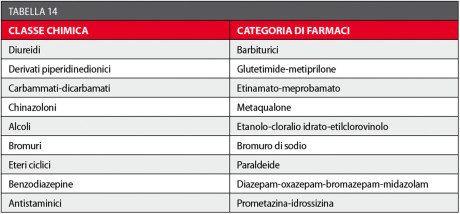
L’ansia è definita come una reazione fisiologica psico-motoria finalizzata ad affrontare situazioni imminenti di minaccia o paura. Quando la risposta a uno stimolo ambientale è eccessiva, non porta a un miglioramento delle capacità psico-fisiche ma a una serie di comportamenti che nel loro complesso costituiscono la reazione ansiosa di tipo patologico. I pazienti odontoiatrici ansiosi si comportano generalmente in modo da evitare le cure dentali a loro necessarie, o da renderle particolarmente difficili all’odontoiatra. Il controllo dell’ansia si può ottenere con farmaci sedativi-ipnotici; i due termini indicano le situazioni cliniche nelle quali queste categorie di farmaci possono essere usate. Vi sono molte sostanze con effetto sedativo e ipnotico (induzione del sonno) ed è possibile classificarle in base alla loro struttura chimica114,115 (Tabella 14).
 Nella pratica clinica odontoiatrica è preferibile usare farmaci sedativi che presentano caratteristiche farmacocinetiche e farmacodinamiche tali da rendere la sedazione facilmente inducibile, modulabile o comunque di breve durata e senza effetti collaterali pericolosi.
Nella pratica clinica odontoiatrica è preferibile usare farmaci sedativi che presentano caratteristiche farmacocinetiche e farmacodinamiche tali da rendere la sedazione facilmente inducibile, modulabile o comunque di breve durata e senza effetti collaterali pericolosi.
Le categorie di farmaci ritenuti efficaci nella terapia dell’ansia in Odontoiatria sono:
- protossido d’azoto;
- farmaci sedativi-ipnotici (benzodiazepine-antistaminici)116.
Le benzodiazepine e il protossido d’azoto sono i più idonei nel controllo dell’ansia in chirurgia orale per diversi motivi, quali:
- presentano un elevato indice terapeutico;
- sono ben tollerate;
- non causano in genere alcun effetto collaterale sistemico.
Per interventi particolarmente complessi si preferisce ricorrere all’anestesia generale, gestita da uno specialista in strutture idonee.
Protossido d’azoto
La sedazione-analgesica con protossido d’azoto e ossigeno in Odontoiatria è una tecnica molto valida e assai diffusa negli USA e nei paesi Nord Europei. L’indicazione principale dell’analgesia sedativa, come già ribadito, è la paura e l’ansia che accompagnano l’atto chirurgico117.
Il protossido d’azoto è un gas inorganico ininfiammabile, non irritante, incolore e di odore dolce. È utilizzato a volte in anestesia generale per l’induzione e in Odontoiatria come sedativo. Ha una scarsa solubilità nel sangue e non si lega alle proteine plasmatiche.
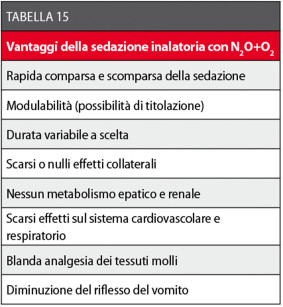
Queste caratteristiche facilitano il raggiungimento di un rapido equilibrio tra la sua pressione parziale nel sangue polmonare e quella nell’alveolo polmonare, da cui deriva una veloce comparsa e ripresa dell’effetto sedativo (2-3 minuti). La sedazione inalatoria con protossido d’azoto e ossigeno (N2O+O2) effettuata mediante mascherina nasale è una tecnica sedativa molto efficace, che presenta in Odontoiatria numerosi vantaggi rispetto a una farmaco-sedazione per via orale o parenterale118-124 (Tabella 15).
 Controindicazioni
Controindicazioni
Non esistono controindicazioni assolute, l’importante è che il paziente sia in grado di respirare con il naso. Sono da considerarsi controindicazioni relative infezioni polmonari acute, gravidanza, scompensi cardio-circolatori gravi, severe patologie neurologiche e/o psichiatriche in trattamento farmacologico.
Effetti collaterali
Una recente rassegna degli effetti collaterali riscontrati nei milioni di pazienti trattati negli Stai Uniti ha dimostrato che essi sono poco frequenti e non gravi, e che N2O è un farmaco valido, sicuro e maneggevole. I rari effetti collaterali sono dose-dipendenti e sono rappresentati principalmente da: eccitazione e perdita di coscienza, nausea, vomito, iperacusie, reazioni psicologiche spiacevoli125,126.
Benzodiazepine
Le benzodiazepine sono i farmaci ansiolitici oggi più diffusi, soprattutto perché dotate di un elevato indice terapeutico; consentono di controllare gli stati di tensione, di paura soggettiva, i comportamenti fobici e ossessivi, diminuendo la sintomatologia organica associata114,115.
È anche possibile associare tali farmaci con il protossido d’azoto, ottenendo una migliore ansiolisi.
Qualora la sedazione con benzodiazepine orali fosse insufficiente, specie nei casi in cui l’assorbimento del farmaco per via orale si rivela variabile o troppo incompleto, è possibile nel paziente adulto ricorrere alle benzodiazepine per via parenterale (midazolam, diazepam), tipicamente I.V. o I.M.
Il diazepam parenterale presenta tuttavia diversi svantaggi rispetto al midazolam: la sua liposolubilità necessita di un solvente irritante per i tessuti che talora può essere causa di flebite.
Inoltre, il diazepam presenta un’emivita molto lunga dovuta alla presenza di metaboliti attivi. Il midazolam è, invece, una molecola idrosolubile scarsamente irritante e presenta un’emivita più breve.
Per entrambe queste benzodiazepine si consiglia un’accurata titolazione; in caso di sovradosaggio, è disponibile un antagonista specifico (flumazenile)127-138.
Tutte le benzodiazepine esplicano effetti qualitativamente simili, riconducibili al potenziamento dell’effetto inibitore del neurotrasmettitore GABA (Acido Gamma-Ammino-Butirrico) sulla conduzione degli stimoli nervosi nel Sistema Nervoso Centrale. Le BDZ si legano a un sito recettoriale specifico (recettore delle BDZ) sul recettore del GABA-A, nell’interfaccia tra le sue subunità alfa e beta. Sono state identificate numerose isoforme del recettore GABA-A, caratterizzate da varie subunità recettoriali (GABA-A alfa, beta, gamma, delta ecc.); queste possono essere presenti in varie combinazioni, per cui
è possibile caratterizzare un recettore GABA-A in diversi sottotipi in base alle sue subunità
(ad esempio, alfa-1, alfa-2, alfa-3 e alfa-5).
Si ritiene che la stimolazione selettiva di questi siti sia responsabile di un preciso effetto; ad esempio, il recettore GABA-A contenente il sito alfa-1 medierebbe effetti sedativi,
ipnotici e amnesici, mentre i recettori GABA-A alfa-2 e alfa-3 sarebbero responsabili di
effetti ansiolitici mentre il blocco della subunità alfa-5 del recettore GABA-A alfa-5 sembrerebbe in relazione al potenziamento delle facoltà cognitive139-141.
Poiché le BDZ sono agonisti non selettivi di questi tipi recettoriali, vi sono notevoli differenze tra gli spettri farmacodinamici delle varie BDZ e le loro caratteristiche farmacocinetiche. Queste ultime, assieme alle varie affinità con i diversi siti specifici del recettore GABA-A cerebrale, contribuiscono a determinare i diversi effetti dei vari tipi di benzodiazepine; ciò significa che ciascuno degli effetti sedativi, ipnotici, miorilassanti, ansiolitici e anticonvulsivanti di una benzodiazepina può essere più o meno evidente a seconda della propria cinetica e a seconda della maggiore affinità con le del suddetto recettore. Gli effetti delle BDZ sono in gran parte dovuti alla loro azione sul sistema nervoso centrale.
Solo due effetti si esplicano a livello periferico, la coronaro-dilatazione dopo somministrazione e.v. di dosi terapeutiche e il blocco neuromuscolare dopo dosi molto elevate.
Comunque, le benzodiazepine non sono deprimenti neuronali generali e non provocano iperalgesia a differenza dei barbiturici114,115.
Dal punto di vista farmacocinetico, un primo criterio di scelta è quello della via di somministrazione: la via orale è quella più consigliabile nella grande maggioranza dei casi, anche se i livelli plasmatici efficaci di farmaco possono maggiormente variare da soggetto a soggetto e con essi l’efficacia della sedazione (Tabella 16).
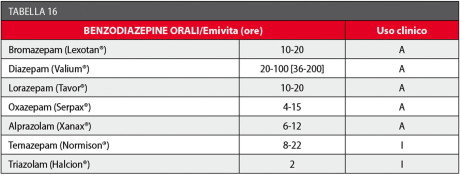 Nell’utilizzo odontoiatrico è preferibile usare benzodiazepine a breve emivita rispetto a quelle che posseggono una lunga durata e/o dei metaboliti attivi che prolungano notevolmente il loro effetto.
Nell’utilizzo odontoiatrico è preferibile usare benzodiazepine a breve emivita rispetto a quelle che posseggono una lunga durata e/o dei metaboliti attivi che prolungano notevolmente il loro effetto.
Quindi, sulla base delle caratteristiche farmacocinetiche i farmaci benzodiazepinici più indicati per interventi di chirurgia orale sono quelli che presentano le seguenti caratteristiche:
rapido ed elevato assorbimento gastro-intestinale quando somministrate per via orale;
breve emivita (metaboliti inattivi).
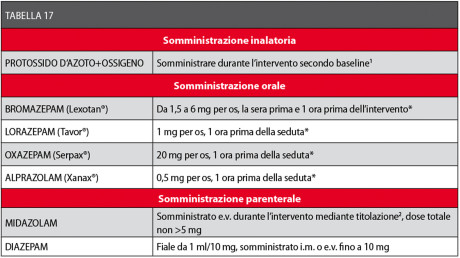
In Tabella 17 sono elencati gli ansiolitici più indicati con i relativi dosaggi.
 BIBLIOGRAFIA
BIBLIOGRAFIA
1. Bernard HR, Cole WR. The Prophylaxis of Surgical Infection: The Effect of Prophylactic Antimicrobial Drugs on the Incidence of Infection Following Potentially Contaminated Operations. Surgery 1964; 56:151-7.
2. Kaiser AB. Antimicrobial prophylaxis in surgery. N Engl J Med 1986; 315:1129-38.
3. Norris LH, Doku HC. Antimicrobial prophylaxis in oral surgery. Curr Opin Dent 1992; 2:85-92.
4. Peterson LJ. Antibiotic prophylaxis against wound infections in oral and maxillofacial surgery. J Oral Maxillofac Surg 1990; 48:617-20.
5. Chapter IV Factors Influencing the Incidence of Wound Infection. Ann Surg 1964; 160:32-81.
6. Burke JF. The effective period of preventive antibiotic action in experimental incisions and dermal lesions. Surgery 1961; 50:161-8.
7. Crossley K, Gardner LC. Antimicrobial prophylaxis in surgical patients. JAMA 1981; 245:722-6.
8. Culver DH, Horan TC, Gaynes RP, Martone WJ, Jarvis WR, Emori TG, et al. Surgical wound infection rates by wound class, operative procedure, and patient risk index. National Nosocomial Infections Surveillance System. Am J Med 1991; 91:152S-7S.
9. Dent CD, Olson JW, Farish SE, Bellome J, Casino AJ, Morris HF, et al. The influence of preoperative antibiotics on success of endosseous implants up to and including stage II surgery: a study of 2,641 implants. J Oral Maxillofac Surg 1997; 55:19-24.
10. Guglielmo BJ, Hohn DC, Koo PJ, Hunt TK, Sweet RL, Conte JE, Jr. Antibiotic prophylaxis in surgical procedures. A critical analysis of the literature. Arch Surg 1983; 118:943-55.
11. Nichols RL. Postoperative wound infection. N Engl J Med 1982; 307:1701-2.
12. Nichols RL. Antibiotic prophylaxis in surgery. J Chemother 1989; 1:170-8.
13. Classen DC, Evans RS, Pestotnik SL, Horn SD, Menlove RL, Burke JP. The timing of prophylactic administration of antibiotics and the risk of surgical-wound infection. N Engl J Med 1992; 326:281-6.
14. Scher KS, Wroczynski AF, Jones CW. Duration of antibiotic prophylaxis. An experimental study. Am J Surg 1986; 151:209-12.
15. Craig CP. Preparation of the skin for surgery. Infect Control 1986; 7:257-8.
16. Morgan JP, 3rd, Haug RH, Kosman JW. Antimicrobial skin preparations for the maxillofacial region. J Oral Maxillofac Surg 1996; 54:89-94.
17. Dineen P. Hand-washing degerming: a comparison of povidone-iodine and chlorhexidine. Clin Pharmacol Ther 1978; 23:63-7.
18. Jones CG. Chlorhexidine: is it still the gold standard? Periodontol 2000 1997; 15:55-62.
19. Davies A. The mode of action of chlorhexidine. J Periodontal Res Suppl 1973; 12:68-75.
20. Addy M. Chlorhexidine compared with other locally delivered antimicrobials. A short review. J Clin Periodontol 1986; 13:957-64.
21. Ciancio SG. Agents for the management of plaque and gingivitis. J Dent Res 1992; 71:1450-4.
22. Loe H, Schiott CR. The effect of mouthrinses and topical application of chlorhexidine on the development of dental plaque and gingivitis in man. J Periodontal Res 1970; 5:79-83.
23. Overholser CD, Jr. Longitudinal clinical studies with antimicrobial mouthrinses. J Clin Periodontol 1988; 15:517-9.
24. Jensen JE. Binding of dyes to chlorhexidine-treated hydroxyapatite. Scand J Dent Res 1977; 85:334-40.
25. Solheim H, Roksvaag P, Eriksen HM, Nordbo H. Oral retention and discoloration tendency from a chlorhexidine mouth rinse. Acta Odontol Scand 1983; 41:193-6.
26. Solheim H, Eriksen HM, Nordbo H. Chemical plaque control and extrinsic discoloration of teeth. Acta Odontol Scand 1980; 38:303-9.
27. National Institutes of Health consensus development conference statement: oral complications of cancer therapies: diagnosis, prevention, and treatment. J Am Dent Assoc 1989; 119:179-83.
28. Field EA, Nind D, Varga E, Martin MV. The effect of chlorhexidine irrigation on the incidence of dry socket: a pilot study. Br J Oral Maxillofac Surg 1988; 26:395-401.
29. Van Dyke TE, Offenbacher S, Place D, Dowell VR, Jones J. Refractory periodontitis: mixed infection with Bacteroides gingivalis and other unusual Bacteroides species. A case report. J Periodontol 1988; 59:184-9.
30. Walker CB, Pappas JD, Tyler KZ, Cohen S, Gordon JM. Antibiotic susceptibilities of periodontal bacteria. In vitro susceptibilities to eight antimicrobial agents. J Periodontol 1985; 56:67-74.
31. Brook I, Calhoun L, Yocum P. Beta-lactamase-producing isolates of Bacteroides species from children. Antimicrob Agents Chemother 1980; 18:164-6.
32. Mombelli A, Mericske-Stern R. Microbiological features of stable osseointegrated implants used as abutments for overdentures. Clin Oral Implants Res 1990; 1:1-7.
33. Alcoforado GA, Rams TE, Feik D, Slots J. Microbial aspects of failing osseointegrated dental implants in humans. J Parodontol 1991; 10:11-8.
34. Hayes C, Antczak-Bouckoms A, Burdick E. Quality assessment and meta-analysis of systemic tetracycline use in chronic adult periodontitis. J Clin Periodontol 1992; 19:164-8.
35. Weersink A, Visser M, Vos A, Hulstaert P, ten Berge I, Muijsken M, et al. Amoxicillin-clavulanate prophylaxis against wound infections after clean-contaminated surgery. A controlled, randomized, prospective study. Eur J Surg 1991; 157:271-5.
36. Demolon IA, Persson GR, Moncla BJ, Johnson RH, Ammons WF. Effects of antibiotic treatment on clinical conditions and bacterial growth with guided tissue regeneration. J Periodontol 1993; 64:609-16.
37. Nowzari H, Matian F, Slots J. Periodontal pathogens on polytetrafluoroethylene membrane for guided tissue regeneration inhibit healing. J Clin Periodontol 1995; 22:469-74.
38. Kirst HA, Sides GD. New directions for macrolide antibiotics: pharmacokinetics and clinical efficacy. Antimicrob Agents Chemother 1989; 33:1419-22.
39. Rodvold KA, Piscitelli SC. New oral macrolide and fluoroquinolone antibiotics: an overview of pharmacokinetics, interactions, and safety. Clin Infect Dis 1993; 17 Suppl 1:S192-9.
40. Peters DH, Friedel HA, McTavish D. Azithromycin. A review of its antimicrobial activity, pharmacokinetic properties and clinical efficacy. Drugs 1992; 44:750-99.
41. Adam D. Clinical use of the new macrolides, azalides, and streptogramins in pediatrics. J Chemother 1992; 4:371-5.
42. Graham EM. Erythromycin. Obstet Gynecol Clin North Am 1992; 19:539-49.
43. Conway AC, Mitchell CL. Analgesic studies with nefopam hydrochloride. Arch Int Pharmacodyn Ther 1977; 226:156-71.
44. Bergman SA, Wynn RL, Myers DE, Rudo FG. Low dose naloxone enhances buprenorphine in a tooth pulp antinociceptive assay. Arch Int Pharmacodyn Ther 1988; 291:229-37.
45. Gustafsson I, Nystrom E, Quiding H. Effect of preoperative paracetamol on pain after oral surgery. Eur J Clin Pharmacol 1983; 24:63-5.
46. Beaver WT. Combination analgesics. Am J Med 1984; 77:38-53.
47. Tolman KG. Hepatotoxicity of antirheumatic drugs. J Rheumatol Suppl 1990; 22:6-11.
48. Rainsford KD. The comparative gastric ulcerogenic activities of non-steroid anti-inflammatory drugs. Agents Actions 1977; 7:573-7.
49. Linton AL. Adverse effects of NSAIDs on renal function. Can Med Assoc J 1984; 131:189-91.
50. Larkai EN, Smith JL, Lidsky MD, Sessoms SL, Graham DY. Dyspepsia in NSAID users: the size of the problem. J Clin Gastroenterol 1989; 11:158-62.
51. Grennan DM, Aarons L, Salisbury R. Problems with demonstrating NSAID concentration-response relationships. Agents Actions Suppl 1985; 17:163-8.
52. Luyk NH, Anderson J, Ward-Booth RP. Corticosteroid therapy and the dental patient. Br Dent J 1985; 159:12-7.
53. Gersema L, Baker K. Use of corticosteroids in oral surgery. J Oral Maxillofac Surg 1992; 50:270-7.
54. Baxter JD, Rousseau GG. Glucocorticoid hormone action: an overview. Monogr Endocrinol 1979; 12:1-24.
55. Di Rosa M, Calignano A, Carnuccio R, Ialenti A, Sautebin L. Multiple control of inflammation by glucocorticoids. Agents Actions 1986; 17:284-9.
56. Swartz SL, Dluhy RG. Corticosteroids: clinical pharmacology and therapeutic use. Drugs 1978; 16:238-55.
57. Bahn SL. Glucocorticosteroids in dentistry. J Am Dent Assoc 1982; 105:476-81.
58. Bollet AJ. Nonsteroidal anti-inflammatory drugs. 2nd ed. Philadelphia; 1985.
59. Goodwin JS. Immunologic effects of nonsteroidal anti-inflammatory drugs. Am J Med 1984; 77:7-15.
60. Abramson SB, Weissmann G. The mechanisms of action of nonsteroidal antiinflammatory drugs. Arthritis Rheum 1989; 32:1-9.
61. Minta JO, Williams MD. Some nonsteroidal antiinflammatory drugs inhibit the generation of superoxide anions by activated polymorphs by blocking ligand-receptor interactions. J Rheumatol 1985; 12:751-7.
62. Day RO, Brooks PM. Variations in response to non-steroidal anti-inflammatory drugs. Br J Clin Pharmacol 1987; 23:655-8.
63. Brune K. Comparative pharmacology of ‘non-opioid’ analgesics. Med Toxicol 1986; 1 Suppl 1:1-9.
64. Frampton JE, Keating GM. Celecoxib: a review of its use in the management of arthritis and acute pain. Drugs 2007; 67:2433-72.
65. Layton D, Souverein PC, Heerdink ER, Shakir SA, Egberts AC. Evaluation of risk profiles for gastrointestinal and cardiovascular adverse effects in nonselective NSAID and COX-2 inhibitor users: a cohort study using pharmacy dispensing data in The Netherlands. Drug Saf 2008; 31:143-58.
66. Abraham NS, Hartman C, Castillo D, Richardson P, Smalley W. Effectiveness of national provider prescription of PPI gastroprotection among elderly NSAID users. Am J Gastroenterol 2008; 103:323-32.
67. Abraham NS, Castillo DL, Hartman C. National mortality following upper gastrointestinal or cardiovascular events in older veterans with recent nonsteroidal anti-inflammatory drug use. Aliment Pharmacol Ther 2008; 28:97-106.
68. Juby AG, Davis P. Utility of published guidelines on the use of nonsteroidal anti-inflammatory drugs in the elderly. Clin Rheumatol 2008; 27:1191-4.
69. Layton D, Souverein PC, Heerdink ER, Shakir SA, Egberts AG. Prescriber adoption of newly approved selective COX-2 inhibitors. Pharmacoepidemiol Drug Saf 2008; 17:1168-74.
70. Marnett LJ. The COXIB experience: a look in the rearview mirror. Annu Rev Pharmacol Toxicol 2009; 49:265-90.
71. Scheiman JM, Fendrick AM. Summing the risk of NSAID therapy. Lancet 2007; 369:1580-1.
72. McGettigan P, Henry D. Cardiovascular risk and inhibition of cyclooxygenase: a systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase 2. JAMA 2006; 296:1633-44.
73. Zhang J, Ding EL, Song Y. Adverse effects of cyclooxygenase 2 inhibitors on renal and arrhythmia events: meta-analysis of randomized trials. JAMA 2006; 296:1619-32.
74. Britain RPSoG. British National Formulary. In: Publishing BMJaRPS, editor.; 2007.
75. Varas-Lorenzo C, Riera-Guardia N, Calingaert B, Castellsague J, Salvo F, Nicotra F, et al. Myocardial infarction and individual nonsteroidal anti-inflammatory drugs meta-analysis of observational studies. Pharmacoepidemiol Drug Saf; 22:559-70.
76. Tanaka A, Hase S, Miyazawa T, Ohno R, Takeuchi K. Role of cyclooxygenase (COX)-1 and COX-2 inhibition in nonsteroidal anti-inflammatory drug-induced intestinal damage in rats: relation to various pathogenic events. J Pharmacol Exp Ther 2002; 303:1248-54.
77. Grosser T, Fries S, FitzGerald GA. Biological basis for the cardiovascular consequences of COX-2 inhibition: therapeutic challenges and opportunities. J Clin Invest 2006; 116:4-15.
78. McGettigan P, Henry D. Cardiovascular risk with non-steroidal anti-inflammatory drugs: systematic review of population-based controlled observational studies. PLoS Med; 8:e1001098.
79. Schmidt M, Christiansen CF, Mehnert F, Rothman KJ, Sorensen HT. Non-steroidal anti-inflammatory drug use and risk of atrial fibrillation or flutter: population based case-control study. BMJ; 343:d3450.
80. Tanaka A, Hase S, Miyazawa T, Takeuchi K. Up-regulation of cyclooxygenase-2 by inhibition of cyclooxygenase-1: a key to nonsteroidal anti-inflammatory drug-induced intestinal damage. J Pharmacol Exp Ther 2002; 300:754-61.
81. Brater DC. Clinical pharmacology of NSAIDs. J Clin Pharmacol 1988; 28:518-23.
82. Verbeeck RK. Pharmacokinetic drug interactions with nonsteroidal anti-inflammatory drugs. Clin Pharmacokinet 1990; 19:44-66.
83. Vane J. The evolution of non-steroidal anti-inflammatory drugs and their mechanisms of action. Drugs 1987; 33 Suppl 1:18-27.
84. Chapman PJ. Postoperative pain control for outpatient oral surgery. Int J Oral Maxillofac Surg 1987; 16:319-24.
85. Dionne RA. New approaches to preventing and treating postoperative pain. J Am Dent Assoc 1992; 123:26-34.
86. Gobetti JP. Controlling dental pain. J Am Dent Assoc 1992; 123:47-52.
87. Holmes A, Davidson LE. Reye’s syndrome and analgesic choice in dentistry. Br Dent J 1989; 167:345-6.
88. Brogden RN. Non-steroidal anti-inflammatory analgesics other than salicylates. Drugs 1986; 32 Suppl 4:27-45.
89. Seymour RA. The use of pain scales in assessing the efficacy of analgesics in post-operative dental pain. Eur J Clin Pharmacol 1982; 23:441-4.
90. Campbell WI, Kendrick RW. Postoperative dental pain–a comparative study of anti-inflammatory and analgesic agents. Ulster Med J 1991; 60:39-43.
91. Perala D, Chapman R, Gelfand J. Complement activation by dental implants. Int J Oral Maxillofac Implants 1991; 6:136-41.
92. Giglio JA, Laskin DM. Double-blind comparison of meclofenamate sodium plus codeine, meclofenamate sodium, codeine, and placebo for relief of pain following surgical removal of third molars. J Oral Maxillofac Surg 1990; 48:785-90.
93. Fricke JR, Jr., Angelocci D, Fox K, McHugh D, Bynum L, Yee JP. Comparison of the efficacy and safety of ketorolac and meperidine in the relief of dental pain. J Clin Pharmacol 1992; 32:376-84.
94. Cooper SA, Reynolds DC, Reynolds B, Hersh EV. Analgesic efficacy and safety of (R)- ketoprofen in postoperative dental pain. J Clin Pharmacol 1998; 38:11S-8S.
95. Forbes JA, Beaver WT, Jones KF, Kehm CJ, Smith WK, Gongloff CM, et al. Effect of caffeine on ibuprofen analgesia in postoperative oral surgery pain. Clin Pharmacol Ther 1991; 49:674-84.
96. Ragot JP, Monti T, Macciocchi A. Controlled clinical investigation of acute analgesic activity of nimesulide in pain after oral surgery. Drugs 1993; 46 Suppl 1:162-7.
97. Sunshine A, Roure C, Olson N, Laska EM, Zorrilla C, Rivera J. Analgesic efficacy of two ibuprofen-codeine combinations for the treatment of postepisiotomy and postoperative pain. Clin Pharmacol Ther 1987; 42:374-80.
98. Shahi S, Mokhtari H, Rahimi S, Yavari HR, Narimani S, Abdolrahimi M, et al. Effect of premedication with ibuprofen and dexamethasone on success rate of inferior alveolar nerve block for teeth with asymptomatic irreversible pulpitis: a randomized clinical trial. J Endod; 39:160-2.
99. Steffens JP, Santos FA, Sartori R, Pilatti GL. Preemptive dexamethasone and etoricoxib for pain and discomfort prevention after periodontal surgery: a double-masked, crossover, controlled clinical trial. J Periodontol; 81:1153-60.
100. Peres MF, Ribeiro FV, Ruiz KG, Nociti-Jr FH, Sallum EA, Casati MZ. Steroidal and non-steroidal cyclooxygenase-2 inhibitor anti-inflammatory drugs as pre-emptive medication in patients undergoing periodontal surgery. Braz Dent J; 23:621-8.
101. Lin S, Levin L, Emodi O, Abu El-Naaj I, Peled M. Etodolac versus dexamethasone effect in reduction of postoperative symptoms following surgical endodontic treatment: a double-blind study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 101:814-7.
102. Fujimoto T, Niimi A, Sawai T, Ueda M. Effects of steroid-induced osteoporosis on osseointegration of titanium implants. Int J Oral Maxillofac Implants 1998; 13:183-9.
103. Schmelzeisen R, Frolich JC. Prevention of postoperative swelling and pain by dexamethasone after operative removal of impacted third molar teeth. Eur J Clin Pharmacol 1993; 44:275-7.
104. Pedersen A. Decadronphosphate in the relief of complaints after third molar surgery. A double-blind, controlled trial with bilateral oral surgery. Int J Oral Surg 1985; 14:235-40.
105. Skjelbred P, Lokken P. Post-operative pain and inflammatory reaction reduced by injection of a corticosteroid. A controlled trial in bilateral oral surgery. Eur J Clin Pharmacol 1982; 21:391-6.
106. Liashek P, Jr., Desjardins PJ, Triplett RG. Effect of pretreatment with acetaminophen-propoxyphene for oral surgery pain. J Oral Maxillofac Surg 1987; 45:99-103.
107. Quiding H, Lundqvist G, Boreus LO, Bondesson U, Ohrvik J. Analgesic effect and plasma concentrations of codeine and morphine after two dose levels of codeine following oral surgery. Eur J Clin Pharmacol 1993; 44:319-23.
108. Forbes JA, Bates JA, Edquist IA, Burchfield WH, Smith FG, Schwartz MK, et al. Evaluation of two opioid-acetaminophen combinations and placebo in postoperative oral surgery pain. Pharmacotherapy 1994; 14:139-46.
109. Frigerio G. [Viminol in the treatment of pain. Double-blind, controlled, multicentric trial]. Minerva Med 1974; 65:687-703.
110. Sacco S, Vespa N, Damonte G. [Controlled observations on the use of viminol in the treatment of the painful-apprehensive states in dental practice]. Riv Ital Stomatol 1974; 29:353-60.
111. Shook JE, Kallman MJ, Dewey WL. The discriminative stimulus properties of the R2 isomer of viminol. Pharmacol Biochem Behav 1984; 20:59-62.
112. Cinelli M, Costa V, Ventresca GP, Lodola E. Viminol R2 analgesic activity in patients with postoperative pain: comparison with pentazocine. Int J Clin Pharmacol Ther Toxicol 1986; 24:232-5.
113. Likar R, Sittl R, Gragger K, Pipam W, Blatnig H, Breschan C, et al. Peripheral morphine analgesia in dental surgery. Pain 1998; 76:145-50.
114. Rall TW. The Pharmacological Basis of Therapeutics. 8th ed. New York: Gilman; 1992.
115. Meyers FH, Jawetz E, Goldfien A. Review of medical Pharmacology. 7th ed: Lange Medical Publications; 1980.
116. Coulthard P. Conscious sedation guidance. Evid Based Dent 2006; 7:90-1.
117. Ayer WA, Jr., Domoto PK, Gale EN, Joy ED, Jr., Melamed BG. Overcoming dental fear: strategies for its prevention and management. J Am Dent Assoc 1983; 107:18-27.
118. Koren G, Sloan I. The pharmacokinetics of inhaled N2O in children. Res Commun Chem Pathol Pharmacol 1985; 49:95-108.
119. Hallonsten AL, Koch G, Schroder U. Nitrous oxide-oxygen sedation in dental care. Community Dent Oral Epidemiol 1983; 11:347-55.
120. Cooper J, Jobling D, Edmunds DH. Sedation for minor oral surgery: inhalation sedation with 25 per cent nitrous oxide. J Dent 1978; 6:265-7.
121. Griffin GC, Campbell VD, Jones R. Nitrous oxide–oxygen sedation for minor surgery. Experience in a pediatric setting. JAMA 1981; 245:2411-3.
122. Crawford AN. The use of nitrous oxide-oxygen inhalation sedation with local anaesthesia as an alternative to general anaesthesia for dental extractions in children. Br Dent J 1990; 168:395-8.
123. Shaw AJ, Meechan JG, Kilpatrick NM, Welbury RR. The use of inhalation sedation and local anaesthesia instead of general anaesthesia for extractions and minor oral surgery in children: a prospective study. Int J Paediatr Dent 1996; 6:7-11.
124. Eger EI, 2nd. Factors affecting the rapidity of alteration of nitrous oxide concentration in a circle cystem. Anesthesiology 1960; 21:348-55.
125. Roche Y, Cavaillon JP. [Use of conscious sedation by inhalation in dental practice and oral surgery]. Chir Dent Fr 1990; 60:61-3.
126. Duncan GH, Moore P. Nitrous oxide and the dental patient: a review of adverse reactions. J Am Dent Assoc 1984; 108:213-9.
127. Ogden GR. Midazolam in dentistry. Br Dent J 1984; 156:386.
128. McGimpsey JG, Kawar P, Gamble JA, Browne ES, Dundee JW. Midazolam in dentistry. Br Dent J 1983; 155:47-50.
129. Loper KA, Ready LB, Brody M. Patient-controlled anxiolysis with midazolam. Anesth Analg 1988; 67:1118-9.
130. O’Boyle CA, Harris D, Barry H, McCreary C, Bewley A, Fox E. Comparison of midazolam by mouth and diazepam i.v. in outpatient oral surgery. Br J Anaesth 1987; 59:746-54.
131. Mandelli M, Tognoni G, Garattini S. Clinical pharmacokinetics of diazepam. Clin Pharmacokinet 1978; 3:72-91.
132. Roelofse JA, van der Bijl P. Comparison of rectal midazolam and diazepam for premedication in pediatric dental patients. J Oral Maxillofac Surg 1993; 51:525-9.
133. Skelly AM, Nelson IA. Clinical assessment of a new dilution of midazolam hydrochloride for dental sedation. Br Dent J 1986; 160:99-100.
134. Lundgren S. Serum concentration and drug effect after intravenous and rectal administration of diazepam. Anesth Prog 1987; 34:128-33.
135. Skelly AM, Boscoe MJ, Dawling S, Adams AP. A comparison of diazepam and midazolam as sedatives for minor oral surgery. Eur J Anaesthesiol 1984; 1:253-67.
136. Wood N, Sheikh A. Midazolam and diazepam for minor oral surgery. Br Dent J 1986; 160:9-12.
137. Ryder W, Wright PA. Dental sedation. A review. Br Dent J 1988; 165:207-16.
138. Stephens AJ, Sapsford DJ, Curzon ME. Intravenous sedation for handicapped dental patients: a clinical trial of midazolam and propofol. Br Dent J 1993; 175:20-5.
139. Atack JR. GABAA receptor subtype-selective modulators. II. alpha5-selective inverse agonists for cognition enhancement. Curr Top Med Chem; 11:1203-14.
140. Atack JR. GABAA receptor subtype-selective modulators. I. alpha2/alpha3-selective agonists as non-sedating anxiolytics. Curr Top Med Chem; 11:1176-202.
141. Dawson GR, Maubach KA, Collinson N, Cobain M, Everitt BJ, MacLeod AM, et al. An inverse agonist selective for alpha5 subunit-containing GABAA receptors enhances cognition. J Pharmacol Exp Ther 2006; 316:1335-45.





