Luca Ginocchio1, Luca De Micheli2
1Programma formazione post-universitaria, coordinatore dottor Sandro Siervo, Istituto Stomatologico Italiano, Milano
2Reparto di parodontologia e implantologia, Istituto Stomatologico Italiano, Milano
Riassunto
Gli elementi dentali affetti da malattia parodontale non trattata subiscono una distruzione dell’apparato di attacco che ne compromette progressivamente la stabilità fino all’avulsione degli stessi. L’obiettivo della terapia parodontale consiste innanzitutto nell’arrestare la progressione della malattia, ma a partire dagli anni Ottanta anche nel tentativo sempre più determinato di rigenerare i tessuti di sostegno distrutti. L’evoluzione delle procedure chirurgiche ha portato a introdurre e valutare clinicamente – e ove possibile istologicamente – tutta una serie di materiali e biodispositivi, quali membrane e adeguati sostituti ossei per guidare la guarigione della ferita verso una ricostituzione dell’attacco parodontale, abbinati a numerosi prodotti per il condizionamento delle superfici radicolari decontaminate e a procedure a lembo dedicate. Scopo del lavoro è fornire un quadro delle conoscenze attuali in materia di chirurgia parodontale rigenerativa e descrivere un caso di difetto osseo angolare in zona estetica trattato con lembo ampio a preservazione di papilla semplificata, riempimento del difetto con una miscela di β-fosfato tricalcico e idrossiapatite a granulometria fine e protezione dello stesso con una membrana riassorbibile in collagene.
Summary
Periodontal regenerative surgery of an angular bone defect in the aesthetic zone: a literature review and a case report
The teeth affected by untreated periodontal disease present an attachment complex destruction which progressively compromise their stability up to their avulsion. The target of periodontal therapy lies first of all in arresting the disease progression, but starting from the ‘80s in the better and better defined attempt of regenerating the destroyed support tissues as well. The evolution of surgical procedures lead to introduce and clinically – but when possible histologically as well – evaluate a great deal of materials and biological devices such as membranes and particulate grafts of bone or appropriate bone surrogates to drive the wound healing towards the reconstitution of periodontal attachment, in combination with a lot of products for the root surface conditioning and with increasingly effective dedicated flap techniques. The goal of this work is to provide a picture of current knowledge about periodontal regenerative surgery and to present a case of an angular bone defect in the aesthetic zone, treated with a large simplified papilla preservation flap, filling of the defect by means of a fine granulosity Tri-Calcium β-Phosphate and hydroxyapatite blend and covering it with a resorbable collagen membrane.
La malattia parodontale non trattata conduce alla perdita dei denti attraverso la distruzione dell’apparato di attacco e dei tessuti di sostegno. L’obiettivo della terapia parodontale consiste non solo nell’arrestare la progressione della malattia, ma anche, ove possibile, nella rigenerazione delle strutture perdute a seguito della patologia stessa. Qualsiasi trattamento parodontale parte sempre da un’anamnesi accurata e dalla raccolta di tutti i dati clinici, fotografici e radiografici finalizzati alla definizione di una diagnosi complessiva e di una dente-per-dente. La classificazione diagnostica da noi adottata per valutare ciascun elemento dentale di un paziente sulla base dell’esame clinico e radiografico è quella descritta da Lindhe e Nyman e poi semplificata a uso del clinico1-3. La diagnosi così definita consente anche di esprimere un giudizio prognostico circa la mantenibilità a lungo termine di ciascun elemento da un punto di vista parodontale, così come indicato in tabella 1.

Gli approcci chirurgici tradizionali (per esempio il courettage a cielo aperto) continuano a dimostrarsi tecniche affidabili e predicibili per creare accesso alle superfici radicolari, ridurre la profondità delle tasche e ottenere una migliore architettura dei tessuti parodontali, così modificando in modo spesso sostanziale la prognosi degli elementi trattati. Tuttavia queste tecniche offrono solo un limitato e incostante potenziale di ripristino dei tessuti originari distrutti nelle fasi precoci della malattia4-6. A partire dagli anni Novanta sono state sviluppate, studiate e impiegate nella realtà clinica alcune procedure chirurgiche finalizzate a un migliore e più predicibile recupero delle strutture di sostegno del dente e dei livelli di attacco parodontale simili a quelli originali: queste tecniche costituiscono la chirurgia parodontale rigenerativa. La rigenerazione consiste nella riproduzione o ricostituzione di una parte perduta o danneggiata, in contrasto con la riparazione che descrive invece la guarigione di una ferita tramite un tessuto che non ripristina del tutto l’architettura e la funzione della parte. L’American Academy of Periodontology definisce la rigenerazione parodontale da un punto di vista istologico come la rigenerazione dei tessuti di sostegno del dente, e cioè dell’osso alveolare, del legamento parodontale e del cemento radicolare attorno a una superficie radicolare con pregressa patologia7-9. Fino a un recente passato si utilizzava erroneamente il termine di tecniche rigenerative riferendosi a procedure quali la levigatura radicolare e il lembo di Widman modificato, che in realtà portavano a un modello di guarigione caratterizzato da riduzione della profondità di sondaggio prevalentemente dovuta a recessione gengivale e a un minimo guadagno di attacco clinico e di neoformazione ossea.
Il guadagno di attacco clinico era imputabile istologicamente soprattutto a un attacco epiteliale lungo, e quindi a un modello di guarigione per riparazione. Infatti fino agli anni Ottanta l’unico approccio terapeutico a tasche parodondali profonde sia sopraossee che intraossee consisteva in interventi a lembo, con o senza resezione ossea e/o con riempimento dei difetti angolari con biomateriale autogeno o allogeno10,11. Solo nel 1976 l’ipotesi di Melcher dimostrò come la natura dell’attacco riformatosi sulla superficie radicolare dopo terapia chirurgica dipendeva strettamente dal tipo cellulare in grado di colonizzare il coagulo ematico12. Le linee cellulari coinvolte nella guarigione di una ferita parodontale comprendono le cellule dell’epitelio gengivale, i fibroblasti del connettivo sopracrestale, le cellule dell’osso alveolare e quelle del legamento parodontale. In condizioni normali le cellule epiteliali migrano molto velocemente lungo la superficie radicolare concorrendo a creare un epitelio giunzionale lungo e, di fatto, impedendo una vera restitutio ad integrum dei tessuti parodontali; l’idea di precludere l’accesso al coagulo alle cellule epiteliali mediante idonei biodispositivi quali membrane/barriera aprì la strada alla rigenerazione guidata dei difetti parodontali intraossei (GTR). Ellegaard con la sua pubblicazione del 1979 suggerì di riempire il difetto mediante osso autologo e di proteggerlo con un innesto epitelio-connettivale13. L’applicazione clinica della GTR iniziò nel 1982, quando Nyman et al. pubblicarono il primo caso di difetto angolare trattato con introduzione di una membrana in acetato di cellulosa che consentisse alle cellule del legamento parodontale e dell’osso di colonizzare il coagulo escludendo selettivamente l’epitelio gengivale14. Seguirono ulteriori case report e gli studi istologici confermarono l’effettiva formazione di cemento radicolare e attacco parodontale con fibre collagene orientate funzionalmente e inserite nel cemento stesso e nell’osso alveolare neoformato15-17.
Negli anni Novanta la GTR ha trovato conferma negli studi clinici randomizzati affermandosi pertanto come metodica basata sull’evidenza18-20. Nello stesso tempo, la migliore comprensione dei meccanismi biologici sottesi alla guarigione della ferita parodontale e una crescente attenzione alla stabilità e alla protezione del coagulo hanno condotto a un’evoluzione delle tecniche chirurgiche di realizzazione del lembo: per prevenire l’esposizione della membrana, assai frequente con l’approccio chirurgico convenzionale (50-100%21,22), nel 1985 Takei introdusse un disegno di lembo con preservazione della papilla gengivale, specifico per terapia rigenerativa, che consentiva una chiusura della ferita per prima intenzione con completa protezione del difetto e degli eventuali materiali/dispositivi rigenerativi utilizzati23.
Il limite di questa tecnica consisteva nel fatto che l’intera papilla al di sopra del difetto veniva scollata con il lembo primario vestibolare, rendendo così poi difficile la chiusura primaria in caso di spostamento coronale dei lembi al di sopra di un biomateriale innestato, dal momento che i lembi linguale o palatale, a meno di applicare opportune tecniche dedicate, scorrono molto difficilmente o non scorrono affatto in senso coronale. Studiando l’uso di membrane rinforzate in titanio, il suddetto limite fu superato dall’introduzione della tecnica modificata di preservazione della papilla (MPPT) da parte di Cortellini, Pini Prato e Tonetti (1995)24: essi proposero di incidere alla base e orizzontalmente la papilla da preservare sull’aspetto vestibolare e di ribaltarla con il lembo linguale. L’esigenza di mobilizzare il tessuto gengivale al di sotto del punto di contatto limita però l’indicazione della tecnica ai casi con spazio interdentale superiore a 2,5 mm. Per ovviare a questa limitazione, lo stesso gruppo di Autori propose nel 1999 la tecnica semplificata di preservazione della papilla (SPPF): l’incisione diagonale vestibolare che divide in 2 parti la papilla consente di ribaltarne lingualmente la parte maggiore attraverso spazi interdentali anche inferiori a 2 mm25. Un’ulteriore evoluzione della tecnica, per i casi indicati, è rappresentata dalla procedura minimamente invasiva o MIST introdotta ancora da Cortellini e Tonetti nel 2007 al fine di aumentare la stabilità del coagulo e ridurre la morbilità per il paziente26: essa comporta un’incisione vestibolare della papilla secondo il disegno del MPPT o del SPPF e il successivo ribaltamento linguale della sola papilla interessata, senza coinvolgere nel lembo le papille gengivali contigue. Sempre gli stessi Autori nel 2009 hanno proposto una variante di questa tecnica ulteriormente meno traumatica per il paziente, resa possibile dall’uso del microscopio operatorio che comporta l’incisione e lo scollamento esclusivamente di un lembo primario vestibolare in gengiva aderente, conservando in situ l’apice della papilla e il lembo linguale a maggior stabilizzazione dello spazio per la rigenerazione (M-MIST)27.
La prognosi della terapia varia a seconda della morfologia del difetto e, in particolare, dipende dal suo angolo, dalla sua profondità, dal numero di pareti ossee residue ai suoi diversi livelli e dalla sua estensione lungo gli aspetti vestibolare e linguale/palatale della radice interessata28-30. Questi aspetti peraltro si riflettono tutti sulla possibilità di disporre di uno spazio adeguato a contatto con la radice ammalata e poi decontaminata per stabilizzare il coagulo che dovrà trasformarsi in un nuovo attacco parodontale.
Come già accennato, tale possibilità può essere già insita nella morfologia del difetto oppure migliorata o consentita ex-novo dall’adozione di adeguati sistemi biocompatibili: questi comprendono i cosiddetti endoscheletri, e cioè materiali particolati quali osso autologo (dello stesso individuo), osso omologo (proveniente da altri individui della stessa specie), osso xenologo o eterologo (da donatori di una specie diversa) e materiali alloplastici (inerti, sintetici o di origine naturale), e i cosiddetti esoscheletri e cioè le membrane. Queste ultime in particolare sono realizzate dall’industria in una grandissima varietà di materiali diversi riassorbibili e non riassorbibili, ma le più comunemente usate al giorno d’oggi sono le membrane non riassorbibili in politetrafluoroetilene espanso (e-PTFE) o denso (d-PTFE) con anima di rinforzo in titanio (che richiedono pertanto una seconda chirurgia per la rimozione della membrana) o in assoluto le membrane riassorbibili in collagene o in pericardio.
Moltissima letteratura valuta l’influenza del trattamento della superficie radicolare sull’efficacia della rigenerazione dei difetti intraossei: se è unanime il consenso circa la necessità di scaling e root planing della superficie radicolare contaminata (ma non dei fasci di fibre parodontali demineralizzate ma ancora inserite!)31, a tutt’oggi non esistono esperimenti controllati in grado di dimostrare un effettivo miglioramento dei parametri clinici grazie al condizionamento della dentina radicolare mediante acido citrico e tetraciclina32,33, né mediante acido etilendiamminotetraacetico (EDTA)34. Per quanto riguarda invece l’applicazione sulla radice decontaminata di matrice proteica dello smalto o enamel matrix derivative (EMD), Koop e colleghi hanno recentemente pubblicato una revisione della letteratura selezionando 20 studi sul trattamento di difetti intraossei, 1 sul trattamento di forcazioni e 6 lavori sul trattamento di recessioni: da questa revisione emerge che l’uso di EMD nei difetti intraossei e nelle forcazioni porta a una rigenerazione maggiore rispetto ai casi di controllo ma sovrapponibile a quella ottenuta con membrane riassorbibili. Nel trattamento delle recessioni l’EMD in combinazione con un lembo avanzato coronalmente consente un incremento dell’efficacia della ricopertura radicolare rispetto ai controlli, ma in questo caso sovrapponibile all’effetto prodotto dall’associazione del lembo avanzato coronalmente con un innesto di tessuto connettivo35. Ulteriori interessanti vantaggi potrebbero essere offerti in futuro anche dall’applicazione, da soli o in combinazione con altri materiali o dispositivi, di fattori di crescita di origine piastrinica (PDGF, già immessi in commercio in Canada e negli Stati Uniti), oppure di concentrato piastrinico o PRP (contenente diversi fattori di crescita tra cui PDGF, TGF-β e IGF) o ancora di fattore di crescita fibroblastico 2 (FGF-2), sebbene gli studi relativi alla loro efficacia non mostrino ancora in modo univoco differenze statisticamente significative tra gruppi test e gruppi controllo36-39. La terapia rigenerativa trova oggi le sue indicazioni nel trattamento di difetti ossei angolari (tipicamente descritti a livello clinico e radiografico come difetti in cui l’attacco sul dente del difetto sia localizzato almeno 3 mm apicalmente rispetto al contiguo dente di cresta, oppure come difetti semicirconferenziali palatali/linguali o vestibolari), di recessioni vestibolari e di forcazioni con compromissione di secondo o terzo grado su molari inferiori. Il suo obiettivo è la guarigione della ferita parodontale con riduzione della profondità di sondaggio grazie alla maggiore quantità possibile di guadagno di attacco clinico e di neoformazione ossea, contro una recessione gengivale minima o assente, e quindi anche miglior preservazione dell’estetica dento-gengivale.
Presentazione del caso clinico
Il paziente, un maschio di 39 anni, si è presentato alla nostra attenzione lamentando dolore, tumefazione, arrossamento e sanguinamento allo spazzolamento nella regione del canino superiore di destra. La raccolta dell’anamnesi ha consentito di escludere l’esistenza di qualsiasi patologia sistemica o allergia specifica nota, oltre che di condizioni o eventi traumatici locali predisponenti. L’esame clinico e quello radiografico hanno permesso di constatare la presenza di un ascesso parodontale a carico della gengiva interprossimale tra gli elementi 1.3 e 1.2, escludendo così altre ipotesi diagnostiche quali quelle di patologia cariosa, endodontica o di una frattura radicolare.
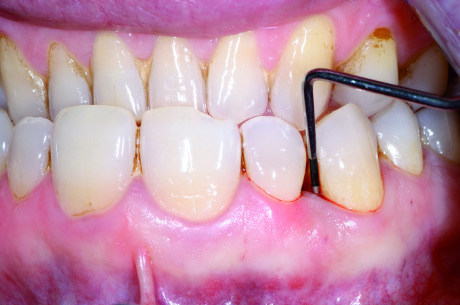
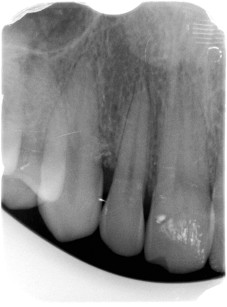
Al sondaggio si dimostrava la presenza di una tasca profonda fino a 9 mm mesialmente all’elemento 1.3, con forte sanguinamento ed essudazione purulenta ma in assenza di mobilità (Figura 1). Non si apprezzava l’esistenza di alcuna problematica occlusale, con buon allineamento degli elementi, I classe molare e canina e presenza di una efficace guida incisiva e canina. Il paziente effettuava sedute semestrali di igiene orale superficiale durante le quali non è mai emersa l’esistenza di alcuna condizione patologica; l’igiene professionale, unitamente a quella domiciliare, garantivano un discreto controllo degli agenti eziologici locali: la rilevazione dell’indice di placca ha indicato un valore di FMPS (full mouth plaque score) di 38%. La visita parodontale e i sondaggi hanno mostrato l’assenza di tasche e recessioni di profondità significativa in tutta la bocca a eccezione degli elementi 1.3 e 1.2, tra i quali era presente un difetto osseo angolare con dente del difetto corrispondente al canino e dente di cresta l’incisivo laterale. L’indice di sanguinamento FMBS (full mouth bleeding score) si attestava intorno al 32%. È stata pertanto formulata la diagnosi generale di parodontite cronica localizzata (tipo 2 della classificazione del 1999 dell’American Academy of Periodontology40).
Pur tenendo conto della sovrastima dei sondaggi dovuti alla flogosi acuta e alla colliquazione del connettivo sopracrestale, la diagnosi per elemento è stata di parodontite gravis per 1.2 e parodontite gravis et complicata per 1.3. La prognosi a lungo termine di questi due elementi è pertanto dubbia. Data l’elevata rilevanza estetica della regione trattata e la presenza di un difetto osseo angolare si è scelto di effettuare una terapia rigenerativa composta, come qualsiasi terapia parodontale chirurgica, da 3 fasi imprescindibili: terapia eziologica, fase chirurgica specifica e terapia parodontale di mantenimento o SPC (supportive periodontal care). Si è pertanto programmata ed eseguita una terapia eziologica intensiva ma conservativa costituita da 4 sedute, a distanza di una settimana, di strumentazione sopra e sottogengivale effettuata esclusivamente con strumenti ultrasonici e apposite punte parodontali con irrigazione mediante soluzione di iodopovidone. Si è scelto di non utilizzare strumenti a lama per non rischiare di ledere e compromettere il trofismo dei tessuti molli interprossimali, la cui integrità e sanità è fondamentale per preservare l’estetica del settore frontale e per consentire un’affidabile chiusura per prima intenzione della ferita chirurgica che non permetta l’esposizione della membrana rigenerativa.
Contemporaneamente si è prescritto al paziente l’uso di un colluttorio a base di clorexidina 0,12% per 2 volte al dì da protrarre per tutto il tempo della preparazione iniziale, mentre non è stata somministrata alcuna terapia antibiotica. La preparazione iniziale così applicata ha condotto alla fase di rivalutazione portando alla risoluzione della flogosi acuta: scomparsa la suppurazione della tasca, persistente ma ridotto il sanguinamento al sondaggio, ridotti l’edema e l’iperemia del parodonto superficiale e cessata la sintomatologia algica. Ridotte in parte anche le profondità di sondaggio grazie alla riorganizzazione dei fasci collagene del connettivo sopracrestale, si è effettuata pertanto la mappatura dettagliata del difetto osseo in prospettiva pre-operatoria con un sondaggio a 8 punti per dente al fine di descrivere meglio la morfologia interprossimale e vestibolare/linguale delle tasche (Figura 2).
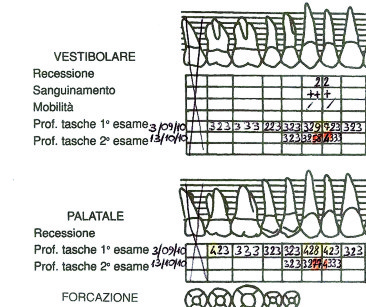
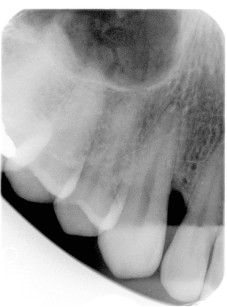
La componente intraossea misurabile del difetto era di 3-4 mm, con profondità ed estensione maggiore sullo spigolo mesio-palatale di 1.3, e angolo del difetto molto ampio che rendeva meno predicibile la rigenerazione dell’attacco distrutto dalla malattia (Figura 3). Era inoltre già presente anche una recessione di 2 mm della gengiva interprossimale tra incisivo laterale e canino, non correggibile chirurgicamente ma che non rappresentava soggettivamente per il paziente un grave problema estetico. La perdita di attacco complessiva mesiale a 1.3 era di 10 mm sul versante vestibolare.
Si è proceduto pertanto con la fase chirurgica, e cioè con il disegno di un lembo ampio, esteso da 1.5 a 2.1, per la necessità di posizionare un biomateriale e una membrana al di sopra del difetto, con preservazione della papilla secondo lo schema del SPPF (simplified papilla preservation flap) descritto da Cortellini e Tonetti25.
La papilla tra laterale e canino è stata sezionata diagonalmente mentre tutte le altre incisioni erano rigorosamente intrasulculari ed eseguite anche mediante lama 12.
La papilla del difetto è stata scollata e ribaltata con il lembo primario palatino, mentre tutte le altre papille coinvolte sono state incise e scollate ma conservando il connettivo sopracrestale adeso al periostio interprossimale (Figura 4).
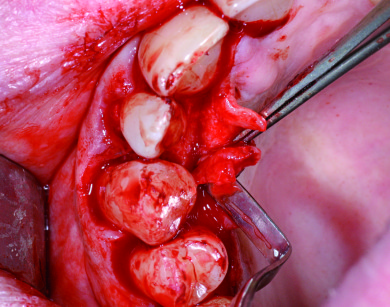
Mediante curettes è stato rimosso il tessuto di granulazione e le superfici radicolari sono state deterse e levigate mediante strumenti ultrasonici e curettes, avendo cura di non levigare le fibre parodontali ancora inserite nel cemento radicolare della porzione esposta più apicale delle radici di 1.3 e 1.2.
Il difetto si configurava ora chiaramente come una combinazione di 1 e 3 pareti. È stata quindi preparata e sagomata una dima in carta, più volte provata in bocca per adattarla all’ampiezza M-D e allo spessore V-P della cresta interdentale, e in base a questa ritagliata una membrana riassorbibile in collagene (Geistlich Bio-Gide, Geistlich Pharma AG, Wolhusen, Switzerland) (Figura 5). Solo a questo punto, per limitare al minimo l’esposizione della zona edemigena e ridurre la morbilità post-operatoria, si è proceduto a parzializzare il lembo primario vestibolare su due piani: uno profondo, subito al di sopra del periostio, e uno più superficiale al fine di disinserire le inserzioni muscolari che esercitavano una trazione apicale sul lembo vestibolare, il quale deve essere invece perfettamente passivo per prevenire un accidentale fallimento della chiusura per prima intenzione (Figura 6).

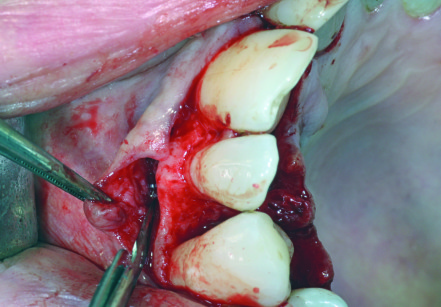
L’estremità maggiore della membrana è stata pertanto posizionata al di sotto del lembo palatino, l’istmo spinto attraverso lo spazio interdentale e l’altra estremità ribaltata coronalmente sui denti per consentire l’accesso al difetto (Figura 7). Quest’ultimo è stato quindi riempito con un idoneo biomateriale alloplastico a granulometria fine (Straumann Bone Ceramic 400-700 µm, Straumann Holding AG, Basel, Switzerland), comprimendo contemporaneamente il lembo palatino e la membrana sottostante sullo spigolo palatino della cresta ossea per prevenire una fuoriuscita del biomateriale sulla faccia palatale della cresta (Figura 8).
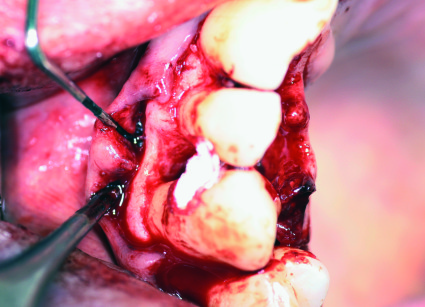
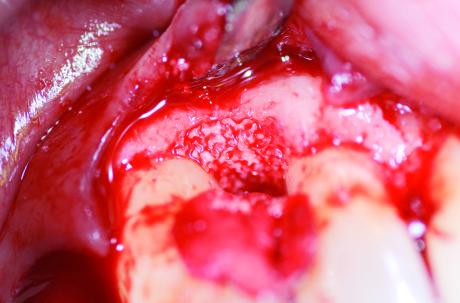
L’estremità vestibolare della membrana è stata poi ribaltata a copertura del difetto. Avendo cura di non spostare accidentalmente la membrana, si è proceduto alla sutura dei lembi: il primo punto è una sutura a materassaio verticale off-set vestibolare e palatale, alla base della papilla tra laterale e canino, fatta correre lungo la radice del dente di cresta al fine di coronalizzare il lembo vestibolare e comprimere la membrana sul difetto, ma senza provocarne il collasso nella zona più profonda del difetto stesso. Si è continuato con la sutura delle altre papille con punti a materassaio verticale al centro delle papille, in questo scostandoci leggermente dalla codifica originaria dell’SPPF, ed è stato posizionato infine un punto semplice staccato per immobilizzare la punta della papilla preservata e garantire la chiusura del lembo per prima intenzione (Figura 9).
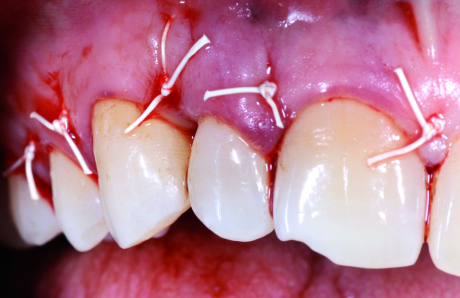
Si è raccomandato al paziente di non spazzolare la zona operata per un mese e non usare alcun mezzo di pulizia interdentale, di non addentare i cibi e si è prescritto ibuprofene 600 mg 3 volte al dì a scopo antalgico e clorexidina in gel 2 volte al dì quale terapia antimicrobica topica della zona operata. Il paziente è stato rivisto settimanalmente nel corso del primo mese e le suture sono state rimosse a 7 gg lateralmente alla zona del difetto e a 14 gg sulla papilla preservata. A ogni seduta è stato effettuato scaling superficiale e lucidatura con gommino e gel di clorexidina per eliminare la placca e le stesse pigmentazioni da clorexidina. Dopo il primo mese si è indicato al paziente di riprendere lo spazzolamento delicato della zona con tecnica Roll e spazzolino morbido post-chirurgico, effettuando ancora due controlli a distanza di 15 giorni e poi mensili. Dopo il secondo mese il paziente ha reintrodotto anche l’uso quotidiano del filo interdentale. La radiografia a 2 mesi mostra l’avvenuto riempimento del difetto con il biomateriale innestato (Figura 10).
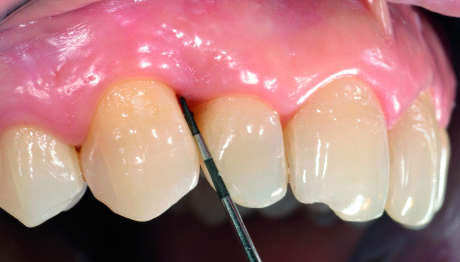
L’esame clinico a 8 mesi ha mostrato la stabilità e la salute dei tessuti molli interprossimali, che hanno mantenuto la recessione di 2 mm già presente in sede pre-operatoria senza alcun peggioramento dell’estetica. In questa seduta è stato effettuato anche il sondaggio di controllo: la sonda non penetrava nel solco gengivale più di 3 mm né vestibolarmente né palatalmente, contro i circa 9 mm del sondaggio iniziale (Figura 11). Il paziente è stato quindi inserito in un programma di mantenimento (SPC) inizialmente trimestrale di scaling e lucidatura superficiale, ma con periodicità ogni volta rivalutata sulla base di sanguinamento e profondità di sondaggio.
Conclusioni
La terapia attiva posta in atto nei confronti del paziente ha prodotto i risultati sperati: la prognosi degli elementi 1.3 e 1.2 è mutata da dubbia a favorevole, poiché esiste adesso la possibilità di un mantenimento igienico a lungo termine degli stessi con igiene domiciliare e professionale periodica. Altrettanto importante, l’estetica del sorriso è stata preservata poiché non vi è stato alcun aumento della recessione gengivale rispetto al baseline. Possibili alternative terapeutiche includevano il semplice scaling e root planing periodico non chirurgico, un lembo per accesso di Widman modificato secondo Ramfjord e Nissle41 oppure un lembo di chirurgia ossea resettiva (ORS); tuttavia, il primo rende difficile il mantenimento a lungo termine di un elemento con profondità di sondaggio così elevata, mentre il lembo di Widman modificato può migliorare la detersione delle superfici radicolari ma comporta un seppur limitato aumento della recessione e la letteratura indica consentire un minor guadagno di attacco clinico rispetto alla terapia rigenerativa42. Per quanto riguarda invece la chirurgia resettiva, essa è assolutamente da evitare perché controindicata in caso di difetti ossei angolari profondi e isolati e perché la sua attuazione porterebbe a una grave perdita di attacco sugli elementi contigui e a un gravissimo danno estetico, non recuperabile conservando gli elementi interessati. La chirurgia parodontale rigenerativa rimane la terapia di prima scelta per il trattamento di difetti angolari isolati specialmente in zona estetica, e risulta predicibile se eseguita correttamente da mani esperte. Una complicanza possibile e non infrequente riguarda l’esposizione della membrana, qualora impiegata, per il fallimento della chiusura dei lembi: la membrana in collagene utilizzata nel caso descritto non necessita di rimozione precoce in caso di deiscenza dei lembi, ma l’esposizione ai fluidi orali ne comporta un rapido riassorbimento nell’arco di pochi giorni e la cessazione della sua funzione. Se questo avviene in fase precoce la scarsa stabilità del coagulo porta a una dispersione parziale o totale del biomateriale innestato, qualora impiegato, il cui spazio viene rapidamente invaso dall’epitelio gengivale con riformazione della tasca e/o frequente aumento della recessione. Per questo acquistano importanza fondamentale la stabilità e la passività dei lembi e della sutura. L’efficacia della rigenerazione parodontale si conferma pertanto ancora molto operatore-dipendente.
Corrispondenza
Luca Ginocchio
Istituto Stomatologico Italiano
Reparto di parodontologia e implantologia
Via Pace, 21 – 20122 Milano
lucaginocchio81@libero.it
1. Nyman S, Lindhe J. Examination of patients with periodontal disease. In: Lindhe J, ed. Textbook of clinical periodontology, 2nd edn. Copenhagen: Munksgaard,310-22. 2. Polson AM, Goodson JM. Periodontal diagnosis. Current status and future needs. J Periodontol 1985;56:25-34. 3. Parakkal PF. Procedings of the Workshop on quantitative evaluation of periodontal diseases by physical measurement techniques. J Dent Res 1979;58:547-51. 4. Consensus report. Periodontal regeneration around natural teeth. Ann Periodontol 1996;1:667-670. 5. Bowers GM, Chadroff B, Carnevale R et al. Histologic evaluation of new attachment apparatus formation in humans. Part I. J Periodontol 1989;60:664-674. 6. Cole RT, Crigger M, Bogle G, Egelberg J, Selvig KA. Connective tissue regeneration to periodontally diseased teeth. A histological study. J Periodontal Res 1980;15:1-9. 7. 1999 International Workshop for a Classification of Periodontal Diseases and Conditions. Papers. Oak Brook, Illinois, October 30-November 2, 1999. Ann Periodontol. 1999 Dec;4(1):i, 1-112. 8. Armitage GC. Development of a classification system for periodontal diseases and conditions. Ann Periodontol 1999 Dec;4(1):1-6. 9. American Academy of Periodontology. Glossary of Periodontal Terms. Chicago: American Academy of Periodontology, 2001. 10. Schallhorn RG, Hiatt WH, Boyce W. Iliac transplants in periodontal therapy. J Periodontol 1970;41:566-80. 11. Caton J, Nyman S, Zander H. Histometric evaluation of periodontal surgery. II. Connective tissue attachment levels after four regenerative procedures. J Clin Periodontol 1980;7:224-31. 12. Melcher AH. On the repair potential of periodontal tissues. J Periodontol 1976;47:256-260. 13. Ellegaard B. Treatment of intrabony defects. Dtsch Zahnarztl Z 1979;34:310-2. 14. Nyman S, Lindhe J, Karring T, Rylander H. New attachment following surgical treatment of human periodontal disease. J Clin Periodontol 1982;9:290-296. 15. Cortellini P, Pini Prato G, Baldi C, Clauser C. Guided tissue regeneration with different materials. Int J Periodont Rest Dent 1990;10:137. 16. Schallhorn RG, Mc Clain PK. Combined osseous composite grafting, root conditioning, and guided tissue regeneration. Int J Periodont Rest Dent 1988;4:9. 17. Gottlow J, Nyman S, Karring T, Lindhe J. New attachment formation as the result of controlled tissue regeneration. J Clin Periodontol 1984;11:494-503. 18. Cortellini P, Pini Prato G, Tonetti MS. Periodontal regeneration of human infrabony defects with titanium reinforced membranes. A controlled clinical trial. J Periodontol 1995;66:797. 19. Cortellini P, Pini Prato G, Tonetti MS. Periodontal regeneration of human infrabony defects with bioresorbable membranes. A controlled clinical trial. J Periodontol 1996;67:217. 20. Cortellini P, Carnevale G, Sanz M, Tonetti MS. Treatment of deep and shallow intrabony defects. A multicenter randomized controlled clinical trial. J Clin Periodontol 1998;25:981. 21. Murphy KG. Postoperative healing complications associated with Gore-Tex Periodontal Material. Part I. Incidence and characterization. Int J Periodontics Restorative Dent 1995;15:363-75. 22. De Sanctis M, Zucchelli G, Clauser C. Bacterial colonization of barrier material and periodontal regeneration. J Clin Periodontol 1996;23:1039-46. 23. Takei HH, Han TJ, Carranza FA, Kenney EB, Lekovic V. Flap technique for periodontal bone implants. Papilla preservation technique. J Periodontol 1985;56:204-10. 24. Cortellini P, Pini Prato G, Tonetti MS. The modified papilla preservation technique. A new surgical approach for interproximal regenerative procedures. J Periodontol 1995;66:261-6. 25. Cortellini P, Pini Prato G, Tonetti MS. The simplified papilla preservation flap. A novel surgical approach for the management of soft tissues in regenerative procedures. Int J Periodontics Restorative Dent 1999;19:589-99. 26. Cortellini P, Tonetti MS. A minimally invasive surgical technique with an enamel matrix derivative in the regenerative treatment of intra-bony defects: a novel approach to limit morbidity. J Clin Periodontol 2007 Jan;34(1):87-93. 27. Cortellini P, Tonetti MS. Clinical and radiographic outcomes of the modified minimal invasive surgical technique with and without regenerative materials: a randomized-controlled trial in intra-bony defects. J Clin Periodontol 2011 Apr;38(4):365-73. 28. Tsitoura E, Tucker R, Suvan J, Laurell L, Cortellini P, Tonetti M. Baseline radiographic defect angle of the intrabony defect as a prognostic indicator in regenerative periodontal surgery with esame matrix derivative. J Clin Periodontol 2004;31:643-47. 29. Tonetti MS, Pini Prato G, Cortellini P. Factors affecting the healing response of intrabony defects following guided tissue regeneration and access flap surgery. J Clin Periodontol 1996;23:548-56. 30. Goldman H, Cohen W. The infrabony pocket: classification and treatment. J Periodontol 1958;29:272-91. 31. Garrett S. Root planning: a perspective. Journal of Periodontology 1977;48:553-7. 32. Moore JA, Ashley FP, Watermann CA. The effect on healing of the application of citric acid during replaced flap surgery. J Clin Periodontol 1987;14:130-5. 33. Fuentes P, Garrett S, Nilveus R, Egelberg J. Treatment of periodontal furcation defects. Coronally positioned flaps with or without citric acid root conditioning in class II defects. J Clin Periodontol 1993;20:425-430. 34. Sculean A, Berakdar M, Willershausen B, Arweiler NB, Becker J, Schwarz F. Effect of EDTA root conditioning on the healing of intrabony defects treated with an enamel matrix protein derivative. J Periodontol 2006 Jul;77(7):1167-72. 35. Koop R, Merheb J, Quirynen M. Periodontal regeneration with Enamel Matrix Derivative (EMD) in reconstructive periodontal therapy. A systematic review. J Periodontol 2011 Nov;3. Epub ahead of print. 36. Nevins M, Giannobile WV, McGuire MK et al. Platelet-derived growth factor stimulates bone fill and rate of attachment level gain: results of a large multicenter randomized controlled trial. J Periodontol 2005;76:2205-15. 37. Ridgway HK, Mellonig JT, Cochran DL. Human histologic and clinical evaluation of recombinant human platelet-derived growth factor and beta-tricalcium phosphate for the treatment of periodontal intraosseous defects. Int J Periodontics Restorative Dent 2008;28:171-9. 38. Demir B, Sengun D, Berberoglu A. Clinical evaluation of platelet-rich plasma and bioactive glass in the treatment of intra-bony defects. J Clin Periodontol 2007;34:709-15. 39. Kitamura M, Akamatsu M, Machigashira M, Hara Y, Sakagami R, Hirofuji T et al. FGF-2 stimulates periodontal regeneration: result of a multi-center randomized clinical trial. J Dent Res 2011;90:35-40. 40. Armitage GC. Development of a classification system for periodontal diseases and conditions. Ann Periodontol 1999 Dec;4(1):1-6. 41. Ramfjord SP, Nissle RR. The modified Widman flap. J Periodontol 1974 Aug;45(8):601-7. 42. Tonetti MS, Pini Prato G, Cortellini P. Factors affecting the healing response of intrabony defects following guided tissue regeneration and access flap surgery. J Clin Periodontol 1996 Jun;23(6):548-56.





