di Barbara Zavan
 Laureata in scienze biologiche con 110/110 e lode, dottorato in «Ingegneria dei tessuti e dei trapianti» presso l’Università degli Studi di Padova.
Laureata in scienze biologiche con 110/110 e lode, dottorato in «Ingegneria dei tessuti e dei trapianti» presso l’Università degli Studi di Padova.
Professoressa presso il Dipartimento di Scienze Biomediche dell’Università degli Studi di Padova dove dirige il laboratorio di Ingegneria dei tessuti e Medicina Rigenerativa. La sua attività di ricerca si svolge nell’ambito dell’ingegneria dei tessuti mediante l’utilizzo di biomateriali naturali e sintetici come supporti per la creazione in vitro di tessuti artificiali quali: pelle, cartilagine, osso, polpa dentaria.
Fra i vari biomateriali studiati si ricordano spugne di collagene, scaffold di idrossiapatite, l’estere benzilico dell’acido ialuronico, superfici di titanio nanostrutturate o biofunzionalizzate.
Si occupa dello studio delle cellule staminali come strumento per ricostruzione di tessuti da utilizzare nella pratica clinica, per la validazione di nuovi materiali e come farmaci in terapie immunomodulanti. Le staminali utilizzate vengono isolate da tessuti
adulti come polpa dentale, pelle, midollo osseo, tessuto adiposo.
Dental pulp stem cells
Lo studio condotto sulle proprietà biologiche delle DPSCs, cellule staminali umane adulte della polpa dentale, ha confermato che le stesse rappresentano uno strumento interessante per la rigenerazione tissutale anche per donatori di età avanzata.
Riassunto
Introduzione. L’ingegneria dei tessuti è un campo interdisciplinare in cui si uniscono conoscenze di biologia, di medicina e di ingegneria. L’uso combinato di cellule staminali adulte, come le cellule staminali della polpa dentale (DPSCs), e biomateriali fornisce nuovi strumenti per la medicina rigenerativa.
Scopo. Scopo del presente lavoro è stato lo studio delle proprietà biologiche, come la capacità proliferativa e la staminalità, delle cellule staminali umane adulte della polpa dentale (DPSCs) in relazione all’età dei donatori.
Materiali e metodi. Sono state estratte polpe dentali da soggetti adulti in salute con età dai 16 anni agli over 66 anni. Sono state isolate e coltivate cellule staminali adulte in presenza di terreni differenziativi. È stata indagata la capacità proliferativa delle cellule staminali per ciascun gruppo d’età, attraverso il calcolo del time doubling e analisi immunoistochimiche per specifici marcatori.
Risultati. DPSCs estratte da donatori giovani mostrano una buona proliferazione cellulare e una elevata staminalità anche dopo numerosi passaggi in vitro, mentre le colture di DPSCs isolate da donatori più vecchi mantengono queste caratteristiche solo nei primi passaggi in vitro.
Conclusioni. Questi risultati confermano l’idea che le DPSCs siano un strumento interessante per la rigenerazione tissutale anche per donatori più anziani.
Summary
Introduction. Tissue engineering is an emerging multidisciplinary field involving biology, medicine and engineering. Combining adult stem cells, such as dental pulp stem cells (DPSCs), with biomaterial scaffolds provides new tools for regenerative medicine.
Aim. Aim of the present work has been the study of the biological properties such as proliferation and stemness ability of human adult dental pulp stem cells (DPSCs) in relation to the age of the donors.
Materials and methods. Human dental pulps were extracted from molar teeth of healthy adult subjects aged 16–over 66 years. Adult stem cells have been isolated and cultured in presence of differentiative medium. Proliferation ability by means of time doubling calculation and immunohistochemical analyses for tissue specific marker have been performed for each group.
Results. DPSCs from younger donor showed good proliferative and stemness ability also in long term cultures whether DPSCs of aged donor maintain these characteristics only during the early in vitro passage.
Conclusions. These results enforce the notion that DPSCs are a promising tool for tissue regeneration also for aged donors.
La polpa dentale è un tessuto connettivo lasso, contenuto all’interno della camera pulpare della corona e dei canali radicolari; comunica con il parodonto tramite uno o più forami apicali e attraverso i canali laterali accessori delle radici. La polpa è composta da cellule immerse in una matrice intercellulare caratterizzata da una sostanza fondamentale e da fibre (soprattutto fibre collagene tipo I e III). La matrice organica rappresenta circa il 25%, mentre il restante 75% è costituito da acqua. La massa centrale della polpa è formata da cellule e da matrice intercellulare.
All’interno della polpa sana si trovano: fibroblasti, fibrociti, cellule mesenchimali staminali, linfociti, macrofagi-istiociti e rare mast cell. La matrice intercellulare, che circonda e supporta le strutture, è composta da fibre collagene, di tipo I e in misura minore di tipo III, e da sostanza fondamentale, formata da acqua e proteoglicani. La sostanza fondamentale rappresenta il mezzo attraverso cui i metaboliti e i prodotti di rifiuto si diffondono nella polpa.
Con l’avanzare dell’età si assiste a una progressiva diminuzione della popolazione cellulare e a un aumento numerico e volumetrico delle fibre collagene soprattutto nei 2/3 apicali della radice.
Cellule staminali
Quando parliamo delle cellule staminali della polpa dentale ci riferiamo a una specifica tipologia di cellule staminali: le mesenchimali. Si definisce cellula staminale quella cellula che ha la capacità di dividersi continuamente sia per dare origine a una cellula staminale uguale (capacità di autorinnovamento), sia per produrre cellule specializzate che possono differenziarsi in vari altri tipi di cellule o tessuti (plasticità differenziativa). Le cellule staminali presentano un grande potenziale proliferativo, sono capaci di autorinnovamento, possiedono ampie potenzialità differenziative e sono presenti in tutti gli stadi di sviluppo. Queste caratteristiche e la possibilità di manipolarle a livello genetico le ha rese oggetto di grande interesse in diversi ambiti di ricerca e di medicina rigenerativa.
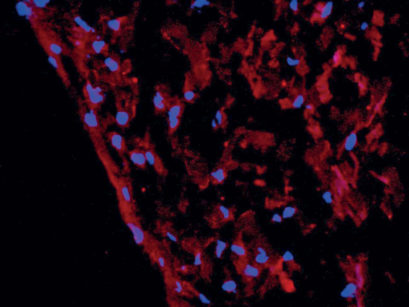
Si distinguono due diversi tipi di cellule staminali: le cellule staminali embrionali (ESCs-Embryonic Stem Cells) e le cellule staminali adulte (ASCs-Adult Stem Cell).
Le ESCs vengono ottenute direttamente da embrioni umani. Fino a 3-4 giorni dopo la fecondazione (zigote e blastomeri della morula), le cellule staminali sono totipotenti: presentano infatti capacità morfogenetica, ovvero sono in grado di dare origine a un individuo completo, hanno illimitata capacità moltiplicativa e proliferativa (immortalità cellulare) e possono differenziarsi in tutti i tipi cellulari (capacità differenziativa).
Le cellule della massa cellulare interna delle blastocisti sono pluripotenti, perché possono dare origine a tutti i tessuti cellulari dell’embrione, ma non ai tessuti extraembrionali1.
Le ASCs sono multipotenti, hanno cioè un potenziale differenziativo inferiore, potendo dare origine solo a una o ad alcune linee cellulari. Le cellule staminali adulte risiedono in molti organi già completamente sviluppati e sono anche conosciute come cellule staminali postnatali. Il prelievo di ASCs è in molti casi minimamente invasivo e l’impiego di ASCs autologhe non implica in genere problematiche di natura etica.
Le cellule staminali mesenchimali (MSCs-Mesenchymal Stem Cells) sono ASCs di origine mesodermica. Dopo la scoperta e la caratterizzazione delle MSCs del midollo osseo (BMMSCs-Bone Marrow MSCs), la ricerca di MSCs in specifici tessuti ha portato negli scorsi decenni all’isolamento di una varietà di cellule staminali in ogni organo e tessuto del corpo umano2-4. Le MSCs si riscontrano infatti in numerosi tessuti, tra i quali il midollo osseo, il tessuto adiposo, il cordone ombelicale e la polpa dentale.
Le MSCs possono differenziarsi in cellule di derivazione mesodermica come osteociti, condrociti e adipociti, ma possono anche dare origine a linee cellulari dei tre diversi foglietti embrionali. Per esempio, sono in grado di differenziarsi in vitro in neuroni e astrociti5-7. Oltre alla loro elevata plasticità differenziativa rispetto alle altre ASCs, le MSCs sono facili da isolare e da coltivare in vitro.
L’utilizzo clinico di cellule derivate dal midollo osseo è limitato per numerosi problemi, tra cui il prelievo doloroso e l’esiguo numero di cellule raccolte. È per questo motivo che i ricercatori hanno investigato tessuti alternativi come fonte più abbondante e accessibile di MSCs, tra cui il terzo molare.
Il primo tipo di cellule staminali del dente è stato isolato dalla polpa dentale (DPSCs-Postnatal Dental Pulp Stem Cells)8-10. Successivamente sono stati isolati e caratterizzati quattro altri tipi di ASCs di derivazione dentale: cellule staminali da denti decidui esfoliati (SHED)11, cellule staminali del legamento parodontale (PDLSCs)12, cellule staminali dalla papilla apicale (SCAP)13 e cellule precursori del follicolo dentale (DFPCs)14.
Eccetto le SHED, le altre vengono isolate da denti permanenti. Tutte queste cellule sono multipotenti e sono capaci di rigenerare molteplici tessuti dentali e parodontali in vitro e in vivo. Inoltre, possono essere criopreservate e conservate per un lungo periodo senza perdere la loro multipotenzialità di differenziazione15.
La possibilità che la polpa potesse contenere cellule staminali fu all’inizio suggerita dall’osservazione che lesioni dentali severe, interessanti anche gli strati profondi della dentina e la polpa, stimolassero un processo riparativo naturale, grazie al quale venivano formati nuovi odontoblasti e veniva prodotta nuova dentina, detta terziaria o di riparazione16-18.
Le DPSCs furono identificate e isolate per la prima volta da Gronthos e collaboratori nel 2000 da terzi molari permanenti; prestavano elevata proliferazione e frequenza di sviluppare colonie che producevano sporadici, ma densi noduli calcificati. Infatti, dimostrarono che le DPSCs potevano differenziarsi in odontoblasti, con corpo polarizzato e processo citoplasmatico incluso in tubuli dentinali.
Oltre alle potenzialità dentinogeniche, sottopopolazioni di DPSCs possiedono anche potenzialità adipogeniche e neurogeniche, evidenti a livello morfologico e genetico, grazie ai relativi marker espressi. Più recentemente le DPSCs sono state anche indotte a differenziarsi verso altre linee cellulari in vitro (differenziazione osteogenica, condrogenica e miogenica).
Le DPSCs, quando trapiantate in vivo in topi immunocompromessi mescolate con idrossiapatite/tricalciofosfato (HA/TCP), formano complessi pulpo-dentinali simili19.
Di recente il gruppo di Laino ha identificato una sottopopolazione di DPSCs (SBP-DPSCs-Stromal Bone Producing Dental Pulp Stem Cells). Queste cellule presentano una grande capacità di autorinnovamento e differenziamento in pre-osteoblasti. Le SBP-DPSCs producono in vitro living autologous fibrous bone (LAB) tissue e se trapiantate in topi immunocompromessi formano osso lamellare contenente osteociti.
In questa condizione le SBP-DPSCs producono osso ed esprimono marker genetici propri dell’osso (osteocalcina, RUNX-2, collagene I, fosfatasi alcalina) e non della dentina (DSPP-Dentin Sialo Phospho Protein). È stato inoltre osservato che circa il 30% delle SBP-DPSCs diventano cellule endoteliali, che si ritrovano nelle pareti dei vasi neoformati.
Dopo il trapianto in vivo, si verifica la completa integrazione dei vasi nell’osso, portando alla formazione di tessuto osseo vascolarizzato20, 21. Ci sono numerose aree di ricerca per le quali le DPSCs offrono nuove prospettive per la rigenerazione tessutale. Queste includono l’uso delle cellule per riparare tessuti dentali, come dentina, legamento parodontale e polpa dentale. Ha avuto successo anche l’ingegneria tissutale dello smalto22, così come l’uso delle cellule staminali dentali come fonte di cellule per facilitare la riparazione di tessuti non dentali come osso e tessuto nervoso23.
Per quanto riguarda la risposta rigenerativa del dente a delle lesioni, solo lo smalto è incapace di rigenerare la propria struttura originale, mentre i tessuti rimanenti possiedono tale capacità in grado variabile, in correlazione con numerosi fattori.
La polpa dentale gioca il ruolo principale nella rigenerazione del dente dopo un insulto, partecipando al processo conosciuto come dentinogenesi. Basti pensare all’incappucciamento diretto della polpa con Mineral Trioxide Aggregate (MTA) o idrossido di calcio, che promuovono l’attivazione della dentinogenesi con produzione di dentina terziaria. Questo strato appena mineralizzato preserva l’integrità pulpare e serve come barriera all’insulto.
Quando il dente è maggiormente compromesso si ricorre attualmente alla terapia endodontica, a scapito della vitalità del dente.
Una forma ideale di terapia potrebbe consistere in un approccio rigenerativo in cui la lesione o la polpa necrotica vengano rimosse e sostituite da tessuto pulpare rigenerato, tramite rigenerazione parziale in situ della polpa o sintesi de novo della polpa totalmente riposizionata.
Un altro campo di applicazione delle cellule staminali del dente risulta essere la gestione di difetti parodontali, per velocizzare i processi di guarigione ossea e gengivale.
A livello di chirurgia implantare, l’osso autologo derivato dalle cellule staminali potrebbe sostituire gli attuali materiali usati per la rigenerazione ossea guidata (GBR). Inoltre, sembra suscitare l’interesse di molti ricercatori la possibilità di avere ligament-anchored implants, ovvero impianti attorniati da tessuto parodontale, prodotto grazie all’ingegneria tissutale, tra osso e superficie implantare24.
Nonostante i numerosi progressi avvenuti in questi ultimi anni, rimane la maggior parte delle problematiche connesse allo sviluppo di un approccio semplice, riproducibile e di facile applicazione clinica basato sull’uso delle cellule staminali per la riparazione e rigenerazione di tessuti dentali e di sostegno.
Negli ultimi anni, un nuovo interessante campo dell’ingegneria tissutale si è aperto dopo l’osservazione che cellule pluripotenti, come le cellule staminali mesenchimali, sono in grado di differenziarsi in vitro in numerose tipologie cellulari quali per esempio condroblasti, osteoblasti, adipociti e fibroblasti. Durante lo sviluppo embrionale, dalla moltiplicazione di una cellula totipotente iniziale si genera un gruppetto di cellule che contiene numerose cellule ancora totipotenti chiamate cellule embrionali staminali (ESCs), preposte alla formazione di cellule mature dell’organismo.
Col procedere dello sviluppo embrionale le ESCs generano cellule progressivamente sempre più differenziate, tra cui le cellule staminali tessuto specifiche o somatiche, il cui compito è produrre le cellule mature del tessuto in cui risiedono. Il numero di cellule staminali somatiche declina progressivamente con lo sviluppo dell’organismo e raggiunge valori minimi e stabili in età adulta. A questo stadio, tali cellule assumono la funzione di mantenere l’integrità strutturale e funzionale dei tessuti mediante la sostituzione delle cellule mature danneggiate.
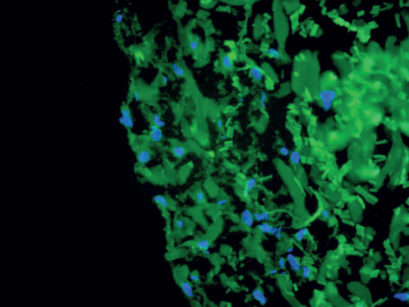
La capacità rigenerativa di tessuti adulti dipende quindi dall’esistenza, al loro interno, di cellule staminali somatiche che per tutta la vita conservano caratteristiche funzionali molto diverse da quelle della loro progenie matura. Quest’ultima è invece specializzata nelle funzioni specifiche del tessuto di appartenenza. Il primo carattere distintivo delle cellule staminali somatiche è il loro stato altamente differenziato. In generale, infatti, queste cellule staminali non possiedono le caratteristiche morfologiche, strutturali, molecolari o antigeniche che si ritrovano nelle cellule differenziate del loro tessuto di appartenenza.
In secondo luogo, una cellula o una popolazione cellulare può essere definita staminale solo se possiede la cosiddetta capacità di automantenimento o autorinnovamento, ossia se è in grado di perpetuare se stessa indefinitamente o, almeno, per tutta la durata dell’organismo di appartenenza.
È importante notare che questo modello di autorinnovamento garantisce la conservazione di un numero stabile di cellule staminali e la concomitante produzione di un elevato numero di cellule differenziate nel tessuto di residenza. Il numero di cellule staminali non potrà mai aumentare a prescindere dal numero di cicli effettuati da ciascuna cellula staminale. Le cellule staminali dei vertebrati compiono divisioni simmetriche in cui le due cellule figlie sono identiche (divisione espansiva) o, in alternativa, diverse dalla cellula madre staminale (divisione differenziativa). L’automantenimento è, perciò, garantito dall’equilibrio numerico tra i due tipi di divisione simmetrica all’interno della popolazione.
Il processo differenziativo avviene a diversi livelli molecolari e cellulari, permettendo la formazione di tessuti altamente specializzati. Tali tessuti sono costituiti da diverse tipologie cellulari, necessarie per lo svolgimento dell’attività funzionale e che, grazie alla distribuzione nei diversi strati, gli conferiscono un proprio spessore e una propria funzionalità.
Proprietà delle staminali della polpa dentale
legate all’età del donatore
Recentemente il nostro gruppo di ricerca ha rivolto la propria attenzione allo studio delle proprietà biologiche delle cellule staminali della polpa dentale correlandole all’età del donatore. Al fine di raggiungere tale scopo, le polpe dentali di pazienti sono state isolate e analizzate da un punto di vista biologico (proliferazione cellulare e capacità differenziativa) con tecniche previste dalla medicina rigenerativa.
Per definizione, il principale scopo della medicina rigenerativa è di rimpiazzare o restituire la normale funzione cellulare, tissutale e degli organi danneggiati, attraverso l’uso di cellule e biomateriali da soli o in combinazione.
Le cellule utilizzate per questo obiettivo sono ottenute da piccole biopsie tissutali, poste in coltura, espanse e utilizzate nel paziente per la rigenerazione di tessuti danneggiati. Tale operazione richiede l’abbinamento delle colture cellulari con appositi scaffold in grado di consentire la crescita tridimensionale delle cellule e la loro organizzazione in condizioni fisiologiche. In questi ultimi anni, la biologia delle cellule staminali si è distinta come uno degli ambiti emergenti della medicina rigenerativa. In questo contesto, l’odontoiatria ha assunto un ruolo di rilievo per quanto riguarda la potenziale applicazione clinica.
A livello endodontico, è stato coniato il termine endodonzia rigenerativa e si riferisce al tentativo di capire le proprietà e la gestione delle cellule staminali e di utilizzarle nella pratica ambulatoriale per rigenerare tessuti come la polpa e la dentina.
Fino a oggi, le cellule staminali progenitrici di derivazione dentale sono state usate per studi di ingegneria tissutale in animali di grossa taglia per provarne il potenziale in applicazioni pre-cliniche.
Un maggiore approfondimento della biologia delle cellule staminali è un prerequisito per comprendere la loro efficacia per la medicina rigenerativa.
Il nostro ambito di interesse è quello implantologico-chirurgico; sempre più persone si rivolgono a tali procedure per riabilitare la propria condizione orale. Molto spesso la qualità e la quantità d’osso presenti in sede implantare sono insufficienti e portano i pazienti ad accettare compromessi estetici o lunghi periodi di trattamento. Si ricorre all’uso di impianti corti, biomateriali, osso autologo prelevato da sede intra o extraorale, osso omologo, GBR (Guided Bone Regeneration).

Alla luce di tali considerazioni, in questo lavoro abbiamo studiato la staminalità delle DPSCs in relazione all’età dei donatori, raggruppati in 5 differenti gruppi in base alla variabile età. Per ciascun gruppo di età abbiamo isolato e coltivato le DPSCs in terreni differenziativi in senso osteogenico, endoteliale, neurogenico e gliale. È stata verificata la loro capacità proliferativa attraverso il calcolo del time doubling e attraverso analisi immunoistochimiche per la ricerca di specifici marker tissutali.
Sono state estratte 120 polpe dentali da terzi molari di persone adulte sane dell’età compresa tra 16 anni e over 67 anni (20 denti per ciascuno dei seguenti gruppi di donatori: 16-25, 26-35; 36-45; 46-55; 56-66; over 67).
Prima dell’estrazione, è stata fatta l’anamnesi medica e odontoiatrica a ciascun soggetto. Solamente le persone prive di patologie sono state selezionate per l’analisi della polpa. Ciascun paziente si è sottoposto per una settimana a igiene dentale professionale. Prima dell’estrazione, la corona del dente è stata ricoperta per 2 minuti con gel a base di clorexidina al 0.3% (Forhans, New York, NY).
Sono stati utilizzati per questo lavoro solamente i denti per i quali non era stato necessario eseguire l’odontotomia durante le manovre chirurgiche.
Una volta avulsi, i denti sono stati fratturati meccanicamente. In ambiente sterile, con una fresa a pallina montata su turbina, è stato eseguito un solco circumferenziale a livello della giunzione amelocementizia, immergendo lo strumentario e il dente all’interno di una contenitore reniforme con acqua fisiologica sterile. La refrigerazione ha permesso di evitare il surriscaldamento della polpa e la conseguente necrosi cellulare. Con delle pinze sono stati poi separati i due frammenti dentali, con esposizione della polpa, la quale è stata rimossa con degli escavatori dentinali o delle curette di Gracey.
Isolamento
Una volta prelevata la polpa, è stata delicatamente immersa in una soluzione digestiva: penicillina 100 U/ml/streptomicina 100 mg/ml, 0.6 ml claritromicina 500 mg/ml in 4 ml PBS 1M, con 3 mg/ml collagenase tipo I, 4 mg/ml dispase tipo II per 1 ora a 37,8 C°.
Trascorso il tempo di digestione, l’azione della collagenasi viene bloccata con un ugual volume di DMEM (Dulbecco’s Modified Eagle Medium completo, ovvero con 10% FBS Fetal Bovine Serum e 1% P/S penicillina+streptomicina) e separata in tubi falcon da 50 ml per essere centrifugata a 1200 rpm per 4 minuti.
I pellet vengono quindi raccolti in una singola falcon e lavati con PBS. Al fine di rimuovere ogni traccia di materiale non digerito, la sospensione cellulare viene filtrata con una garza sterile e l’eluato centrifugato un’ultima volta per ottenere il pellet di cellule da seminare.
Differenziamento
Abbiamo utilizzato diversi terreni differenziativi (neuronale, gliale, endoteliale e osseo). La scelta di tali terreni di coltura è stata dettata dall’osservazione che in vivo queste sono le principali vie differenziative delle cellule staminali della polpa.

Attività proliferativa
L’attività proliferativa delle cellule è stata analizzata mediante la valutazione del population dubling time (pdt) che è un indicatore della velocità di duplicazione cellulare.
Nel presente studio sperimentale è stato analizzato il pdt delle colture di DPSCs in presenza di un terreno non differenziativo.
È stato calcolato il pdt per ogni gruppo d’età e a tre differenti passaggi (p) in vitro delle colture al fine di valutare sia l’invecchiamento in vivo (correlato all’età del donatore) che in vitro (correlato al passaggio cellulare):
- p2: passaggio precoce (cellule giovani);
- p5: passaggio intermedio;
- p8: passaggio a lungo termine (cellule invecchiate).
Come è già noto per le colture primarie, anche nelle nostre colture abbiamo rilevato che, quando le cellule invecchiano (passaggi lunghi in vitro (p8)), la loro capacità di proliferare diminuisce (gruppo sopra i 67 anni). Questa proprietà non è così evidente per cellule staminali derivate da donatori giovani (fino ai 25 anni), il cui elevato valore di pdt, mantenuto in tutti i passaggi, conferma il buon livello di capacità proliferativa delle cellule staminali. Dopo i 25 anni d’età, la capacità proliferativa diminuisce in relazione all’aumento del tempo di coltura.
È interessante notare come fino ai 56 anni d’età siano rilevabili alti livelli di proliferazione nei passaggi precoci (p2).
Staminalità
La staminalità delle cellule è stata valutata mediante la capacità di esprimere specifici marcatori in presenza di specifici fattori esterni differenziativi ed è stata effettuata un’analisi sia di tipo qualitativo che quantitativo.
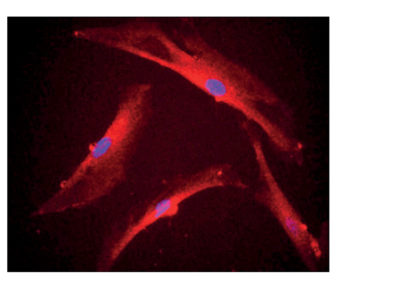
La staminalità delle DPSCs è stata analizzata tramite analisi immunoistologiche per la ricerca di marcatori specifici, a seguito di induzione di differenziamento in vitro in senso endoteliale, osteocitario, nervoso.
Sono stati rilevati marker per tre differenti tessuti adulti come il tessuto endoteliale, osseo e nervoso.
Differenziamento endoteliale
Il differenziamento verso la linea cellulare endoteliale è stato rilevato in ogni gruppo d’età preso in esame. Questo comportamento è mantenuto anche quando le cellule invecchiano, infatti anche al passaggio p5 le cellule mantengono una quasi invariata percentuale di differenziamento. Questo evento è riscontrabile per ogni gruppo di età. Quando le cellule invecchiano in vitro p8, perdono questa capacità e questo meccanismo è molto marcato quando le cellule derivano da donatori più vecchi.
Differenziamento osseo
È stato ben documentato un marcato differenziamento in vitro delle DPSCs per ciascuno passaggio e per ciascun gruppo di età. I nostri risultati dimostrano che circa l’80% delle DPSCs a p2 e a p5 può acquisire un fenotipo osseo, quando le cellule staminali derivano da pazienti al di sotto dei 55 anni di età. Al di sopra di questa età è comunque evidente un buon differenziamento (circa 70%) fino al passaggio più tardivo (p8).
Differenziamento neuronale
Cellule positive a marcatori neuronali sono presenti ai più alti livelli (100% della popolazione) in vitro durante il passaggio precoce (p2, barre nere) nei donatori fino ai 36 anni di età.
Conclusioni dello studio
Le cellule staminali sono responsabili della crescita, dell’omeostasi e della riparazione dei tessuti. Queste cellule sono generalmente classificate in cellule staminali embrionali (ESCs), che sono considerate pluripotenti grazie alla loro capacità di dare origine a ogni tipo di cellule, e in cellule staminali adulte (ASCs) che sono definite multipotenti, per una minore gamma di linee differenziative a cui possono dare origine. All’interno di quest’ultimo gruppo, le più studiate sono le cellule staminali mesenchimali (MSCs), che sono riscontrabili in molti tessuti adulti come la cute, il midollo osseo, il tessuto adiposo, il cordone ombelicale, i denti. Le cellule staminali mesenchimali adulte sono attualmente considerate quale strumento terapeutico utilizzabile in diversi ambiti clinici. Le MSCs, oltre a essere multipotenti, sono facili da isolare e da coltivare in vitro e non presentano nessun problema etico grazie alla loro sede di origine.
In questa ampia lista di tessuti che forniscono MSCs, il più vicino al campo odontoiatrico è costituito dalla polpa dentale.
Per quanto riguarda la polpa dentale, molti studi hanno già dimostrato l’esistenza di una popolazione di cellule staminali post-natali o DPSCs (Dental Pulp Stem Cells), che gioca un ruolo rilevante nella formazione di dentina reattiva. Le DPSCs possono essere considerate come una popolazione eterogenea di MSCs, dal momento che la polpa dentale è composta sia da componenti mesenchimali che ectodermici. Nonostante la multipotenzialità di queste cellule, il loro primario differenziamento sembra essere finalizzato alla formazione di cellule che producono tessuto mineralizzato. Ciononostante le DPSCs hanno dimostrato di essere capaci di generare neuroni funzionalmente attivi sotto la spinta di determinate condizioni ambientali.
Infine, altre interessanti proprietà delle DPSC, comuni a tutte le MSCs, sono rappresentate dalla loro capacità di migrare verso aree di tessuto danneggiate e posseggono proprietà immunosoppressive.
Tutti questi vantaggi hanno permesso il successo del trapianto, sia autologo che eterologo, di DPSCs.
Alla luce di tali evidenze, scopo del presente lavoro è stato una dettagliata caratterizzazione della staminalità delle DPSCs in relazione all’età del paziente e all’invecchiamento in vitro, al fine di definire un semplice protocollo per il reclutamento della maggior quantità di cellule staminali per l’uso clinico.
Il nostro primo obiettivo è stato la definizione dell’abilità proliferativa delle DPSCs in relazione all’età del paziente e al tempo della coltura in vitro, partendo dall’assioma della biologia cellulare che «la capacità proliferativa delle cellule si riduce quando le cellule sono invecchiate o quando le cellule staminali hanno perso la propria staminalità».
Nelle nostre colture di DPSCs abbiamo trovato una buona capacità proliferativa in tutte le classi di età scelte. Questa capacità è mantenuta ad alti livelli nelle prime fasi della coltura in vitro e nell’invecchiamento in vitro solo in caso di cellule derivanti da donatori giovani (fino ai 25 anni di età), mentre si riduce in relazione all’aumento d’età. La diminuzione del doubling time, infatti, è fortemente correlata all’incremento del numero di passaggi in vitro.
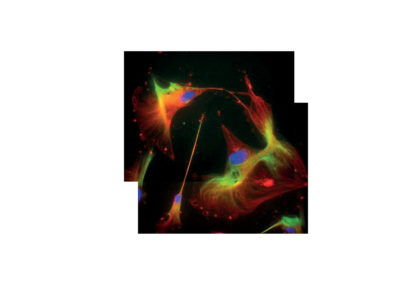
Il secondo obiettivo è stato l’analisi delle capacità differenziative delle DPSCs attraverso studi qualitativi e quantitativi. Sono state effettuate analisi immunoistologiche con lo scopo di mettere in evidenza specifici marker tissutali, quali quelli neuronali, endoteliali e dell’osso. Le cellule sono in grado di esprimere tutti gli specifici marker se coltivate in presenza dei relativi terreni differenziativi. Abbiamo riscontrato reazioni positive per CD31, il più importante marker cellulare per il differenziamento endoteliale, per l’osteonectina, indicatore per il tessuto osseo, per proteine neuronali e per fenotipi gliali.
Una volta stabilita la capacità delle cellule di differenziarsi in linee cellulari diverse, abbiamo effettuato analisi quantitative della staminalità delle cellule per ogni gruppo di età e ciascun passaggio in vitro, con l’obiettivo di determinare la percentuale di cellule staminali isolate in grado di mantenere la propria capacità differenziativa. Per ogni specifico marker cellulare abbiamo effettuato una valutazione quantitativa (attraverso la conta di cellule positive rispetto al numero totale di cellule) della percentuale di cellule differenziate verso uno specifico fenotipo. Per tutte le classi selezionate (in termini di età del paziente e in termini di passaggio in vitro) abbiamo trovato alte percentuali di differenziamento. Infatti, per quanto riguarda il differenziamento endoteliale si è visto che circa il 40% delle cellule esprime marcatori endoteliali in tutti i gruppi d’età selezionati. Quando le cellule invecchiano in vitro, perdono questa capacità; infatti, tale capacità differenziativa si riduce quando le cellule derivano da donatori più vecchi. Tali percentuali differenziative raggiungono valori più elevati, fino all’80%, quando si tratta di differenziamento osteogenico. Pure in tal caso, queste alte percentuali si riscontrano anche in individui al di sopra dei 55 anni.
Comportamento simile lo si osserva, inoltre, nei differenziamenti gliale e neuronale, dove si riscontra un differenziamento rispettivamente dell’80% e del 100% in donatori fino ai 36 anni.
Queste evidenze ci hanno fornito due importanti informazioni. La prima è relativa alla possibilità di isolare cellule staminali adulte da donatori di tutte le età, inclusi pazienti più vecchi (sopra i 67 anni). Nel caso di pazienti più anziani, sarebbe preferibile utilizzare «cellule giovani».
La seconda importante conclusione è che le cellule isolate da tutti i pazienti mantengono in vitro la propria staminalità per un lungo periodo. Le DPSCs sembrano avere la tendenza a differenziarsi soprattutto in cellule neuronali e ossee più che in cellule endoteliali. Alla luce di tali osservazioni, quindi, si potrebbe definire il seguente semplice protocollo: le cellule di donatore giovane possono amplificarsi in vitro per molto tempo ed essere utilizzate anche per ricostruzione di tessuti prima in vitro e poi in vivo; per quanto riguarda i donatori più anziani, si dovrebbero trapiantare cellule staminali sottoposte a un numero esiguo di passaggi in vitro.
Applicazioni
Lo studio delle applicazioni cliniche delle cellule staminali adulte rappresenta senza ombra di dubbio l’ultima frontiera dell’odontoiatria. Lo stoccaggio sicuro e a bassi costi di DPSCs costituisce un passo cruciale nell’introduzione quotidiana di pratiche legate alla medicina rigenerativa. Sono molto interessanti le prospettive dell’impiego delle DPSCs per la rigenerazione ossea a fini implantoprotesici. I progressi della biologia molecolare hanno consentito di chiarire i meccanismi fondamentali della guarigione ossea e il potenziale rigenerativo dell’osso stesso, aprendo la strada all’ingegneria tissutale ossea.
Per evitare di ricorrere ai tradizionali prelievi di osso autologo da sedi intra ed extraorali, molti ricercatori si sono orientati sull’impiego delle cellule staminali della polpa dentale per rigenerazioni ossee. L’osso autologo è considerato il gold standard per innesti di tessuto osseo per le sue proprietà osteogeniche, assenti nell’osso omologo o eterologo. Il discomfort post-operatorio legato al sito del prelievo (sinfisi mentoniera, branca mandibolare, calvaria, cresta iliaca…), limita però il suo utilizzo per innesti onlay, innesti inlay, GBR, rialzi di seno mascellare. L’impiego di cellule staminali potrebbe in futuro eliminare gli svantaggi correlati al prelievo di osso autologo, permettendo però una migliore e rapida rigenerazione dei difetti ossei, accorciando quindi i tempi per il carico degli impianti.
Quando impiantate su matrici tridimensionali ricche di pori e concavità, le cellule staminali pulpari colonizzano rapidamente gli spazi porsi dello scaffold, proliferando all’interno di esso e differenziandosi in osteoblasti in grado di deporre osso immaturo. La geometria del substrato sembra condizionare fortemente la risposta cellulare, secondo un meccanismo di induzione geometrica della formazione ossea. Le DPSCs danno luogo già in coltura a osso contenente una grande quantità di vasi, dopo il trapianto in vivo si verifica la completa integrazione dei vasi nell’osso, portando alla formazione di tessuto osseo vascolarizzato.
Si è visto, inoltre, che la crescita di osso varia anche in funzione della superficie degli impianti in titano, che differiscono per forma e dimensione dei pori25. A livello implantologico sembra suscitare l’interesse di molti ricercatori anche la possibilità di avere ligament-anchored implant, ovvero impianti attorniati da tessuto parodontale, prodotto grazie all’ingegneria tissutale, tra osso e superficie implantare.
La maggiore differenza tra impianto osteointegrato e dente consiste rispettivamente nell’assenza o presenza del legamento parodontale, che permette al dente un ruolo più dinamico rispetto all’anchilosi o all’osteointegrazione implantare.
I «ligaplant» potrebbero indurre la crescita di nuovo osso in presenza di ampi difetti ossei, potrebbero essere più compatibili con residui di crescita delle ossa mascellari, permettendo l’inserimento di impianti anche in età di sviluppo, potrebbero consentire il movimento dell’unità ligaplant-struttura protesica durante spostamenti ortodontici e potrebbero sopportare maggiori carichi funzionali. Gault ha sperimentato per la prima volta sull’uomo i ligaplant. Ha isolato cellule del PDL di denti avulsi, le ha espanse in vitro, le ha distribuite sulla superficie implantare e ha inserito gli impianti rivestiti di cellule nei rispettivi donatori. Attualmente questa tecnica è estremamente costosa, richiede tempi eccessivi e non è predicibile; potrebbe essere però un prototipo per future applicazioni cliniche.
Un altro interessante ambito di applicazione delle cellule staminali potrebbe essere in futuro la terapia rigenerativa dei tessuti parodontali. La chirurgia parodontale rigenerativa riguarda le procedure tese in modo specifico al restauro delle porzioni dell’apparato di supporto del dente andate perdute, ponendo l’attacco epiteliale in una posizione più coronale rispetto a quella pre-trattamento. Attualmente le tecniche più impiegate consistono nel posizionamento di membrane-barriera al fine di guidare la rigenerazione del tessuto (GTR: Guided Tissue Regeneration) e nell’utilizzo di fattori di crescita o di amelogenine (EMD: derivato della matrice dello smalto).
Per ottenere i migliori risultati con la GTR, il caso clinico dovrà avere una minima recessione gengivale, un difetto osseo verticale con minimo coinvolgimento della papilla interdentale e della formazione, che dovrà essere poco esposta. Anche l’Emdogain trova la sua migliore indicazione nei difetti stretti e profondi, a 3 pareti. In futuro le cellule staminali potrebbero permettere di eseguire con maggiore predicibilità interventi di chirurgia rigenerativa, anche in forcazioni di grado III, forcazioni mascellari di grado II o difetti ossei larghi e poco profondi. In generale ci si auspica di ottenere, grazie all’impiego delle cellule staminali, un maggior guadagno di attacco clinico e in tempi più brevi.
Un altro promettente ambito di interesse è quello della rigenerazione di interi denti o porzioni di denti, visto l’aumento di pazienti con esigenze estetiche e funzionali che si rivolgono all’odontoiatra per terapie restaurative e per sostituzione di elementi mancanti in arcata. I denti hanno una struttura complessa, che assicura durezza e stabilità nel tempo. Tuttavia, questa struttura è vulnerabile a traumi e infezioni batteriche. Quando il dente è danneggiato, ma ancora riparabile, la rigenerazione di parte della struttura può prevenire o ritardare la perdita del dente.
Questo fatto è di notevole importanza, perché la perdita dei denti influenza non solo la funzione masticatoria, ma anche l’estetica e la qualità di vita. Le risposte rigenerative dei denti agli insulti e alla degenerazione strutturale sono diverse, dal momento che i denti sono costituiti sia da tessuti vivi (legamento parodontale, cemento, polpa), sia da tessuti privi di cellule (smalto, dentina).
Di tutti questi tessuti dentali, solamente lo smalto non è capace di rigenerare, mentre le restanti strutture lo sono in grado variabile, in relazione a molteplici fattori. Quando la polpa dentale è esposta a causa della perdita della dentina sovrastante, l’incappucciamento della polpa con idrossido di calcio o MTA (Mineral Trioxide Aggregate) promuove la dentinogenesi e la formazione di dentina terziaria. Quando il dente è più compromesso si deve ricorre alla terapia endodontica, con disinfezione e sagomatura dei canali e successivo riempimento con guttaperca.
Una forma ideale di terapia potrebbe consistere in un approccio rigenerativo, in cui la polpa infiammata o necrotica venga rimossa e sostituita da tessuto pulpare rigenerato. In futuro il successo dell’endodonzia rigenerativa dipenderà dall’abilità di produrre tessuto pulpare e di posizionarlo all’interno del sistema dei canali radicolari, correttamente detersi e sagomati. Questo potrebbe essere ottenuto con un approccio in vivo, grazie a rigenerazione pulpare in situ attraverso i canali radicolari, oppure attraverso un trattamento ex vivo, che implichi una polpa ottenuta de novo attraverso l’ingegneria tissutale con la triade di DPSCs, scaffold e fattori di crescita. Oltre all’ambito endodontico, anche la sostituzione di elementi mancanti in arcata per agenesie, traumi o pregresse estrazioni, potrebbe essere uno scenario non troppo lontano negli anni a venire. Le attuali ricerche sono dirette alla creazione di interi denti, che dovrebbero essere simili per morfologia e funzione ai denti mancanti da sostituire.
Ci sono diverse strategie di ricerca volte a ottenere questo obiettivo. I denti si formano per continue interazioni tra mesenchima ed epitelio orale. Alcuni ricercatori utilizzano degli scaffold tridimensionali per supportare questi due diversi tipi cellulari, altri utilizzano i fondamenti dell’embriologia sperimentale dello sviluppo e della biologia molecolare per stimolare la formazione del germe dentale. In particolare, uno studio giapponese ha dimostrato la possibilità di rigenerare denti funzionalmente efficienti su animali. Questo risultato, a dir poco entusiasmante, è frutto del lavoro di un gruppo di ricercatori dell’Università della Scienza di Tokyo, guidati da Takashi Tsuji.
Questi ricercatori propongono la tecnologia usata nel loro studio sperimentale come un modello per future terapie di sostituzione di denti. Riportano nel loro studio una sostituzione dentale in un topo adulto, ottenuta attraverso il trapianto di un germe dentale creato in vitro26 e impiantato nell’osso alveolare nella regione edentula. Il dente creato bioingegnericamente, che è erotto e in occlusione, presenta una corretta morfologia e durezza dei tessuti mineralizzati, è dotato di fibre che lo connettono all’osso, risponde a stimoli meccanici ed è sensibile al dolore. I continui miglioramenti nell’isolamento, nella caratterizzazione e nella modulazione del comportamento delle DPSCs, in stretto rapporto con i progressi nella scienza dei biomateriali, inequivocabilmente faciliteranno l’applicazione dell’ingegneria tissutale in ambito odontoiatrico. Sono in fase di attuazione progetti che prevedono la creazione di banche cellulari, attraverso crioconservazione di DPSCs prelevate per esempio da ottavi o denti decidui estratti. Queste cellule conservate potrebbero rappresentare fonte di cellule staminali per una rigenerazione ossea parodontale o peri-implantare nello stesso paziente a distanza di anni.
Corrispondenza
barbara.zavan@unipd.it
2. Baksh D, Song L, Tuan RS. Adult mesenchymal stem cells: characterization, differentiation, and application in cell and gene therapy. J Cell Mol Med 2004 Jul-Sep; 8(3):301–16.
3. Porada CD, Zanjani ED, Almeida-Porad G. Adult mesenchymal stem cells: a pluripotent population with multiple applications. Curr Stem Cell Res Ther 2006 Sep; 1(3):365-9.
4. Kolf C, Cho E, Tuan R. Mesenchymal stromal cells. Biology of adult mesenchymal stem cells: regulation of niche, self-renewal and differentiation. Arthritis Res Ther 2007; 9(1):204.
5. Biella G, Di Febo F, Goffredo D, Moiana A, Taglietti V, Conti L, Cattaneo E, Toselli M. Differentiating embryonic stem-derived neural stem cells show a maturation-dependent pattern of voltage-gated sodium current expression and graded action potentials. Neuroscience 2007 Oct 12; 149(1):38-52.
6. Arthur A, Rychkov G, Koblar SA, Gronthos S. Adult human dental pulp stem cells differentiate toward functionally active neurons under appropriate environmental cues. Stem Cell 2008 Jul; 26(7):1787-95.
7. Kadar K, Kiraly M, Porcsalmy B, Molnar B, Racz GZ, Blazsek J, Kallo K, Szabo EL, Gera I, Gerber G, Varga G. Differentiation potential of stem cells from human dental origin-promise for tissue engineering. J Physiol Pharmacol 2009 Dec; 60 (Suppl 7):167-75.
8. Gronthos S, Arthur A, Bartold PM, Shi S. A method to isolate and culture expand human dental pulp stem cells. Methods Mol Biol 2011; 698:107-21.
9. Gronthos S, Brahim J, Li W, Fisher LW, Cherman N, Boyde A, et al. Stem cell properties of human dental pulp stem cells. J Dent Res 2002 Aug; 81(8):531-5.
10. Gronthos S, Mangani M, Brahim J, Robey PG, Shi S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proc Natl Acad Sci USA 2000 Dec 5; 97(25):13625-30.
11. Miura M, Gronthos S, Zhao M, Lu B, Fisher LW, Robey PG, Shi S. SHED: stem cells from human exfoliated deciduous teeth. Proc Natl Acad Sci USA 2003 May; 100(10):5807-12.
12. Seo BM, Miura M, Gronthos S, Bartold PM, Batouli S, Brahim J, Young M, Robey PG, Wang CY, Shi S. Investigation of multipotent postnatal stem cells from human periodontal ligament. Lancet 2004 Jul 10-16; 364(9429):149-55.
13. Sonoyama W, Liu Y, Fang D, Yamaza T, Seo BM, Zhang C, Liu H, Gronthos S, Wang CY, Shi S, Wang S. Mesenchymal stem cell-mediated functional tooth regeneration in swine. PLoS One 2006 Dec 20; 1:e 79.
14. Morsczeck C, Gotz W, Schierholz J, Zeilhofer F, Kuhn U, Mohl C, Sippel C, Hoffmann KH. Isolation of precursor cells (PCs) from human dental follicle of wisdom teeth. Matrix Biol 2005 Apr; 24(2):155-65.
15. Laino G, D’Aquino R, Graziano A, Lanza V, Carinci F, Naro F, Pirozzi G, Papaccio G. A new population of human adult dental pulp stem cells: a useful source of living autologous fibrous bone tissue (LAB). J Bone Miner Res 2005 Aug; 20(8):1394-1402.
16. Smith AJ, Cassidy N, Perry H, Bègue-Kirn C, Ruch JV, Lesot H. Reactionary dentinogenesis. Int J Dev Biol 1995 Feb; 39(1):273-80.
17. Smith AJ, Lesot H. Induction and regulation of crown dentinogenesis: embryonic events as a template for dental tissue repair? Crit Rev Oral Biol Med 2001; 12(5):425-37.
18. Smith CE, Wazen R, Hu Y, Zalzal SF, Nanci A, Simmer JP, Hu JC. Consequences for enamel development and mineralization resulting from loss of function of ameloblastin or enamelin. Eur J Oral Sci 2009 Oct; 117(5): 485-97.
19. Batouli S, Miura M, Brahim J, Tsutsui TW, Fisher LW, Gronthos S, Robey PG, Shi S. Comparison of stem cell-mediated osteogenesis and dentinogenesis. J Dent Res 2003 Dec; 82(12):976–81.
20. Carinci F, Papaccio G, Laino G, Palmieri A, Brunelli G, D’Aquino R, Graziano A, Lanza V, Scapoli L, Martinelli M, Pezzetti F. Comparison between genetic portraits of osteoblasts derived from primary cultures and osteoblasts obtained from human pulpar stem cells. J Craniofac Surg 2008 May; 19(3):616–25.
21. d’Aquino R, De Rosa A, Lanza V, Tirino V, Laino L, Graziano A, Desiderio V, Laino G, Papaccio G. Human mandible bone defect repair by the grafting of dental pulp stem/progenitor cells and collagen sponge biocomplexes. Eur Cell Mater 2009 Nov 12; 18:75-83.
22. Honda MJ, Shinmura Y, Shinohara Y. Enamel tissue engineering using subcultured enamel organ epithelial cells in combination with dental pulp cells Cells Tissues Organs 2009; 189(1-4):261-7.
23. Volponi AA, Pang Y, Sharpe PT. Stem cell-based biological tooth repair and regeneration. Trends Cell Biol 2010 Dec; 20(12):715-22.
24. Giannobile WV. Getting to the Root of dental implant tissue engineering. J Clin Periodontol 2010 Aug 1; 37(8):750-8.
25. Mangano C, De Rosa A, Desiderio V, d’Aquino R, Piattelli A, De Francesco F, Tirino V, Mangano F, Papaccio G. The osteoblastic differentiation of dental pulp stem cells and bone formation on different titanium surface textures. Biomaterials 2010 May; 31(13):3543-51.
26. Nakao K, Morita R, Saji Y, Ishida K, Tomita Y, Ogawa M, Saitoh M, Tomooka Y, Tsuji T. The development of a bioengineered organ germ method. Nat Methods 2007 Mar; 4(3):227-30.