Quando si deve intervenire su un paziente potenzialmente allergico, il primo passo è capire se è veramente allergico e, se sì, a quale anestetico. Nei pazienti realmente ipersensibilizzati, è opportuno valutare tramite test allergologici se si può impiegare una molecola differente da quella che ha causato il problema, eventualmente associando una premedicazione con corticosteroidi. Un’alternativa potrebbe essere costituita dall’uso off-label di alcuni farmaci o, come ulteriore opzione, si possono considerare altre tecniche alternative di anestesia come la crioanestesia, la TENS e l’agopuntura.
 Laureato in Odontoiatria e Protesi dentaria, si è specializzato in Ortognatodonzia presso l’Università degli Studi di Milano. Nello stesso ateneo, per più quindici anni, ha collaborato come professore a contratto all’attività didattica, di ricerca e clinica della Scuola di specializzazione in Ortognatodonzia. Dal 2011 è responsabile del team ortodontico del Reparto di Riabilitazione orale dell’Università di Milano, presso l’Istituto Stomatologico Italiano. È relatore a corsi e congressi e autore di pubblicazioni scientifiche nazionali e internazionali. Svolge la libera professione occupandosi principalmente di ortodonzia, gnatologia e protesi.
Laureato in Odontoiatria e Protesi dentaria, si è specializzato in Ortognatodonzia presso l’Università degli Studi di Milano. Nello stesso ateneo, per più quindici anni, ha collaborato come professore a contratto all’attività didattica, di ricerca e clinica della Scuola di specializzazione in Ortognatodonzia. Dal 2011 è responsabile del team ortodontico del Reparto di Riabilitazione orale dell’Università di Milano, presso l’Istituto Stomatologico Italiano. È relatore a corsi e congressi e autore di pubblicazioni scientifiche nazionali e internazionali. Svolge la libera professione occupandosi principalmente di ortodonzia, gnatologia e protesi. Laureato con lode in Odontoiatria e Protesi dentaria, si è specializzato nel 2004 in Ortognatodonzia presso l’Università degli Studi di Milano. Svolge la libera professione occupandosi principalmente di ortodonzia, odontoiatria conservativa, endodonzia e protesi. Collabora come tutor presso la Cattedra di Odontoiatria conservativa ed endodonzia dell’Università Statale di Milano e dal 2011 collabora per la parte ortodontica con il Reparto Universitario di Odontoiatria estetica presso l’Istituto Stomatologico Italiano. È relatore di congressi nazionali e internazionali.
Laureato con lode in Odontoiatria e Protesi dentaria, si è specializzato nel 2004 in Ortognatodonzia presso l’Università degli Studi di Milano. Svolge la libera professione occupandosi principalmente di ortodonzia, odontoiatria conservativa, endodonzia e protesi. Collabora come tutor presso la Cattedra di Odontoiatria conservativa ed endodonzia dell’Università Statale di Milano e dal 2011 collabora per la parte ortodontica con il Reparto Universitario di Odontoiatria estetica presso l’Istituto Stomatologico Italiano. È relatore di congressi nazionali e internazionali. Laureata con lode nel 2018 in Odontoiatria e Protesi dentaria presso l’Università degli Studi di Milano. Frequentatrice del Reparto Universitario presso l’Istituto Stomatologico Italiano e dei reparti di Odontoiatria e Protesi dentaria della Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico. Autrice di articoli nazionali e poster presentati al 24° e 25° Congresso nazionale del Collegio dei Docenti universitari di Discipline odontostomatologiche, al 47° e 48° Congresso internazionale SIDO. Vincitrice del primo premio per il poster presentato al 35° Congresso nazionale AIOP.
Laureata con lode nel 2018 in Odontoiatria e Protesi dentaria presso l’Università degli Studi di Milano. Frequentatrice del Reparto Universitario presso l’Istituto Stomatologico Italiano e dei reparti di Odontoiatria e Protesi dentaria della Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico. Autrice di articoli nazionali e poster presentati al 24° e 25° Congresso nazionale del Collegio dei Docenti universitari di Discipline odontostomatologiche, al 47° e 48° Congresso internazionale SIDO. Vincitrice del primo premio per il poster presentato al 35° Congresso nazionale AIOP.
Riassunto
Gli anestetici locali sono farmaci molto sicuri che raramente danno manifestazioni allergiche. Esistono tuttavia pazienti che riferiscono di aver avuto sensibilizzazione nei loro confronti. La diagnosi differenziale principale va fatta con le reazioni tossiche, molto più frequenti. La reale allergia si può accertare con una serie di test specifici, che permettono eventualmente anche di individuare differenti molecole di anestetico che non dovrebbero causare reazioni crociate. Nei pazienti in cui non sembra prudente impiegare un anestetico locale, una soluzione può essere costituita dall’operare in anestesia generale. Chiaramente questo approccio è ragionevole per interventi odontoiatrici estesi. Per procedure minori si può cercare di dare analgesia con tecniche alternative. Tra queste si possono considerare: l’iniezione di antistaminici usati come anestetici, la crioanestesia, la TENS e l’agopuntura.
Gli anestetici locali vengono ampiamente utilizzati in odontoiatria; a titolo di esempio si può citare una ricerca eseguita in Canada nel 20091 che riporta come, in quell’anno, ogni dentista abbia effettuato più di 1.600 anestesie locali. Gli anestetici locali sono farmaci molto sicuri e i fenomeni di reale allergia sono molto rari2,3,4,5, ma, quando si presentano, possono dare manifestazioni serie e particolarmente gravi.
Le reazioni avverse provocate dall’anestesia locale si distinguono in due categorie: reazioni tossiche e reazioni allergiche. Quando si deve decidere quale condotta tenere in un paziente che riferisce di essere allergico agli anestetici locali si deve innanzitutto capire se i problemi a cui è andato incontro sono dovuti a una “vera” reazione allergica o a una reazione tossica.
Nei pazienti realmente ipersensibilizzati, che tipicamente spesso riferiscono allergie a “tutte-le-caine”, può essere indicato optare per una molecola di anestetico differente da quella che ha causato il problema, eventualmente associando una premedicazione con corticosteroidi. Un’alternativa potrebbe essere costituita dall’uso off-label di alcune molecole antistaminiche, che iniettate localmente presentano una certa attività anestetica. Come ulteriore opzione si possono considerare altre tecniche alternative di anestesia come la crioanestesia, la TENS e l’agopuntura.
Principale diagnosi differenziale: reazioni tossiche
Le reazioni tossiche vengono spesso confuse con reazioni allergiche; la sintomatologia trae in inganno il paziente, dato che gli effetti tossici degli anestetici si possono manifestare con agitazione, bradicardia, tremori e talvolta anche convulsioni, depressione respiratoria e collasso cardiovascolare.
Se nella soluzione iniettata è presente un vasocostrittore, questo può provocare tachicardia, aumento della pressione, convulsioni o perdita di coscienza. Anche le reazioni vaso-vagali del paziente possono generare dubbi, manifestandosi con iperventilazione, nausea, vertigini, pallore e sudorazione. Le reazioni tossiche sono di gran lunga più frequenti di quelle allergiche; già nel 1989 il Memorandum per la diagnostica di allergia a farmaci riportava che solo l’uno percento delle reazioni riferite dal paziente come “allergiche” sarebbe imputabile a un vero meccanismo allergico, studi più recenti confermano questa percentuale6.
Le reazioni tossiche più frequenti sono causate da problemi di funzionamento epatico o renale o da un’errata somministrazione dell’anestetico, tipicamente da una sua iniezione intravascolare4. Molto importante è la pratica di aspirare sempre e ripetutamente con la carpule prima di iniettare l’anestetico, in modo da essere sicuri di non aver posizionato la punta dell’ago all’interno di un vaso7. Se durante la manovra di aspirazione fluisce sangue nella fiala (Figura 1), sarà opportuno spostare la siringa di qualche millimetro prima di iniettare il farmaco. La procedura di aspirazione va comunque ripetuta per essere sicuri di essersi allontanati a sufficienza. Per poter discriminare con sicurezza tra una reazione tossica e una reale manifestazione allergica potrebbe essere indicato ricorrere a test allergologici specifici per gli anestetici locali.

Reazioni allergiche e allergeni presenti negli anestetici locali
Le reazioni allergiche agli anestetici locali possono essere immediate (di tipo I di Gell e Coombs) o ritardate (di tipo IV di Gell e Coombs). Come noto, i sintomi vanno da manifestazioni cutanee (prurito, rush, angioedemi mucosi), a respiratorie (broncospasmo) e fino anche a cardiovascolari, che possono culminare con uno shock anafilattico. Nella fiala degli anestetici locali, oltre alla molecola dell’anestetico, possono essere presenti anche dei vasocostrittori (adrenalina, epinefrina) e dei conservanti come i metabisolfiti e i parabeni (para-idrossibenzoico).
I metabisolfiti sono impiegati anche nell’industria alimentare come conservanti e antiossidanti e possono causare reazioni allergiche nei soggetti sensibili ai solfiti. Normalmente vengono indicati con la sigle E221-E227. Nelle preparazioni degli anestetici hanno lo scopo di prevenire l’ossidazione dell’adrenalina. Una particolare precauzione quindi va riservata a quei pazienti che riportano fenomeni allergici accertati nei confronti dei cibi conservati8. I metabisolfiti sono frequentemente impiegati anche come eccipienti in alcune compresse a base di paracetamolo. Pazienti che riportano di aver avuto manifestazioni atopiche dopo assunzione di tale farmaco potrebbero in realtà aver avuto reazioni nei confronti dei metabisolfiti.
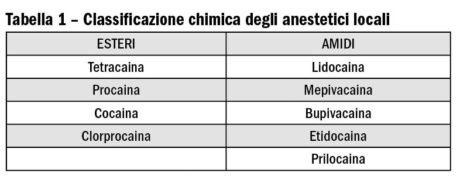
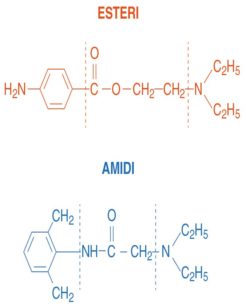
I parabeni sono impiegati abbastanza raramente come conservanti negli anestetici locali, dato che è ormai nota una loro certa facilità a sensibilizzare i soggetti che li assumono. Gli anestetici locali, da un punto di vista chimico, si dividono in due grandi gruppi: gli esteri e gli amidi (Tabella 1, Figura 2). In linea di massima gli esteri sono più allergizzanti degli amidi e quindi meno impiegati. Come per gli antibiotici, all’interno di ciascuna famiglia è possibile una certa reattività crociata, ma non esiste necessariamente una reattività crociata tra i due gruppi9. Come conseguenza, in un paziente con accertata sensibilizzazione agli esteri si dovrebbe poter impiegare un’amide e viceversa9. È rilevante sapere che, quando vengono metabolizzati, gli esteri sono convertiti in acido para-aminobenzoico (PABA). Il PABA è chimicamente simile ai metil-parabeni e la produzione di questo catabolita spiegherebbe perché gli esteri tendono a essere più allergizzanti degli amidi8. Gli amidi infatti non danno origine al PABA quando vengono metabolizzati. Spesso i pazienti fanno confusione e non sanno quale molecola ha provocato loro dei problemi. Sono stati riportati anche casi in cui il paziente ha avuto una reazione di sensibilizzazione dovuta al lattice dei guanti chirurgici che è stata erroneamente attribuita all’anestetico impiegato4,10,11,12. Nelle situazioni dubbie è indicato eseguire dei test allergologici per capire quale anestetico è ragionevole impiegare con un basso margine di rischio ed eventualmente si può procedere con una pre-medicazione a base di corticosteroidi e antistaminici.
Test allergologici
Una diagnosi certa di allergia, così come una assoluta esclusione, non è mai possibile dato che qualsiasi test ha una certa possibilità di mostrare falsi positivi o falsi negativi. Inoltre la sensibilizzazione a un allergene può avvenire in qualsiasi momento; di conseguenza un soggetto non allergico potrebbe d’improvviso diventarlo13. È opportuno che i test allergologici siano necessariamente eseguiti da operatori esperti presso centri attrezzati per far fronte all’eventualità che si presenti una reazione anafilattica potenzialmente letale14. Si noti come nei casi in cui i sintomi manifestati dal paziente successivamente alla somministrazione dell’anestetico lascino pochi dubbi riguardo a una reazione allergica, ma i test diagnostici mostrino risultati negativi, è suggerito ripetere le procedure diagnostiche a distanza di 4-6 settimane. È infatti possibile che con il passare del tempo si possa avere una progressiva diminuzione della capacità dell’organismo di reagire all’anestetico. Durante la prima procedura diagnostica, il soggetto subisce una risensibilizzazione all’antigene e potrebbe quindi mostrare risultati positivi ai test eseguiti dopo 4-6 settimane. Ciò è noto come effetto booster14.
Si hanno oggi a disposizione diversi test. La scelta deve essere effettuata considerando il rapporto costi/benefici; includendo nei costi sia quelli di natura economica, sia i rischi potenziali derivanti dall’esecuzione del test. Tra i benefici si annoverano l’attendibilità del risultato e la sensibilità del test stesso15.
Skin prick test
Spesso lo skin prick test è l’esame di prima scelta per valutare eventuali allergie agli anestetici per la buona affidabilità e perché permette di quantificare la severità della risposta16. Presenta una minima invasività e un minimo rischio (nell’ordine del 0,04%), la possibilità di poter testare diversi antigeni contemporaneamente e una buona riproducibilità17,18. Per contro oltre a essere operatore dipendente è in grado di rilevare solo le reazioni IgE-mediate e non quelle cellulo-mediate17. Lo skin prick test viene eseguito su cute sana sulla superficie volare dell’avambraccio mantenendo una distanza di almeno 5 cm dal polso e 3 cm dal gomito19. I disinfettanti utilizzati non devono contenere potenti antisettici o alcol. La cute viene quindi lavata con sapone e successivamente si attende almeno due minuti affinché si ristabilisca la normale vascolarizzazione superficiale. Con un pennarello vengono segnati con un codice i punti in cui verranno testati i farmaci, mantenendo tra loro una distanza di almeno 3 cm. In corrispondenza dei marker viene appoggiata sull’epidermide una goccia di ciascuna soluzione da testare. Infine vengono applicate due gocce controllo. Per il controllo negativo si utilizza soluzione fisiologica per quello positivo si impiega una soluzione di istamina 1/1.000. In corrispondenza delle gocce di soluzione la cute viene punta ripetutamente con una piccola lama della lunghezza di 1 mm senza causare sanguinamento che annullerebbe il test. Le varie soluzioni vengono lasciate agire per circa 5-10 minuti e quindi rimosse. Nel caso di un importante ed immediata reazione allergica la soluzione responsabile viene rimossa immediatamente. Si considera positiva all’allergene la risposta che produce un’area eritematosa circostante la zona di applicazione del diametro di almeno 3 mm. Vengono quindi misurati il diametro maggiore e quello minore di ogni spot e tra i due viene fatta una media per ottenere un diametro medio della zona di rush. I risultati letti vengono infine registrati e confrontati con la reazione ottenuta con il controllo positivo17.
Test intradermici
Se, in presenza di un’anamnesi positiva, il prick test mostra risultati negativi si può valutare un approfondimento diagnostico con l’esecuzione di un test intradermico. L’esame viene eseguito inoculando sottocute concentrazioni crescenti della sostanza da testare12. Si attende circa 20 minuti (periodo di assestamento) e si valutano i risultati. Viene considerato positivo il test in cui la differenza tra il diametro dell’area eritematosa che si sviluppa immediatamente dopo l’inoculazione e quello che permane dopo il periodo di assestamento è superiore ai 3mm20.
I test intradermici possono indagare un solo antigene per volta e sono meno specifici del prick test. Inoltre presentano un rischio maggiore di reazioni avverse. Per contro la loro sensibilità e ripetibilità è sicuramente maggiore rispetto al prick test14.
Patch test
Il patch test rientra nella categoria dei test cutanei e viene eseguito portando in contatto con la cute illesa l’antigene puro non diluito. Tale indagine permette, a differenza delle due precedenti, di testare un’ipersensibilità cellulo-mediata (tardiva). È più probabile che tale meccanismo di reazione si verifichi con l’utilizzo di esteri, ma è possibile anche con l’impiego dei derivati amidici21.
Ricerca dell’antigene spegifico IgE e delle mastcellule
Un ulteriore approfondimento diagnostico può essere la ricerca diretta delle IgE o di una concentrazione eccessiva di mastcellule (superiore a 10,5 µg/l), in seguito all’immissione in circolo dell’antigene legato a un contrasto22. Tale procedura, se da un lato garantisce una sensibilità elevatissima, anche superiore al 90%, dall’altro sottopone in paziente a un elevato rischio di sviluppare una reazione allergica17.
Drug provocation test (DPT)
In accordo con le direttive europee, questo test rappresenta il gold standard nella ricerca delle ipersensibilità ai farmaci23. Secondo le linee guida americane24 è ideale per definire la dose di farmaco tollerata da un dato paziente, permettendo di evitare sovradosaggi che potrebbero essere responsabili di razioni di ipersensibilità cellulo-mediate.
Il DPT è in grado di rilevare risposte di ipersensibilità indipendentemente dal meccanismo d’azione (IgE o cellulo-mediata). Il test viene eseguito iniettando sottocute quantità crescenti di allergene non diluito a intervalli di 30 minuti25. Il controllo negativo consiste nell’iniezione di soluzione salina. Questo test espone il paziente a rischi anche considerevoli; la decisione riguardo una sua esecuzione deve essere attentamente ponderata15. L’Accademia Europea di Allergologia e Immunologia Clinica ha stabilito delle linee guida per la sua prescrizione (Figura 3).
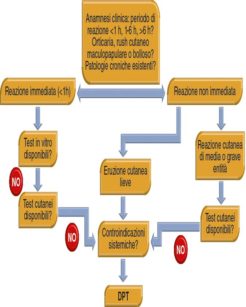
Il DPT può confermare una diagnosi di ipersensibilità, escludere una crossreattività, trovare un farmaco ben tollerato o escludere con maggior certezza una diagnosi di ipersensibilità nei pazienti che non hanno mai manifestato sintomi ascrivibili ad una reazione allergica all’anestetico15. Va comunque ricordato che un risultato negativo a tale test non può escludere una sensibilizzazione del soggetto al farmaco in futuro, ma semplicemente la esclude nel presente13. Infine è interessante evidenziare come a volte il peso molecolare degli anestetici locali sia tanto basso da non riuscire a provocare una risposta positiva con test cutanei nemmeno in soggetti potenzialmente allergici13; pertanto in questi casi la corretta diagnosi si può avere solo tramite il DPT26.
Pre-medicazione
La pre-medicazione può essere suggerita per poter limitare eventuali reazioni allergiche in soggetti problematici. Non è una procedura che garantisce con sicurezza che non si possa avere insorgenza di reazioni avverse, ma ne riduce la probabilità o per lo meno dovrebbe limitare la gravità del fenomeno27,28,29,30.
Esistono diversi protocolli. Per gli adulti, ad esempio, è possibile somministrare prednisone 25 mg, 2 compresse 13 ore prima dell’intervento, 2 compresse 7 ore prima dell’intervento e 2 compresse 1 ora prima dell’intervento e clorfenamina maleato (fiale 10mg/1ml), 1 fiala intramuscolo prima dell’intervento31,32,33.
Nei bambini è possibile somministrare prednisone (1 mg/kg) o betametasone (0,1 mg/kg) in 2 somministrazioni al giorno; cetirizina (1 goccia/2 kg) in una somministrazione al giorno (>2 anni); oxatomide 2,5% (1 goccia/2kg) in 2 somministrazioni al giorno (< 2 anni). In tutti i casi si inizia 2 giorni prima dell’intervento e si prosegue fino a 2 ore prima dell’anestesia28. Se ci si vuole assumere la responsabilità di effettuare questa procedura in ambiente “non protetto” può essere comunque consigliabile prepararsi una via di accesso venoso per essere preparati a intervenire il più tempestivamente possibile in caso di esiti non favorevoli.
Antistaminici impiegati come anestetici locali
Da lungo tempo è noto come alcune molecole di farmaci antistaminici, se iniettate localmente, hanno un effetto simile a quello che si ottiene con gli anestetici32,33. Nel mondo anglosassone esistono diverse indicazioni a usare tali farmaci in luogo degli esteri o delle amidi nei casi in cui si sia accertata una reazione atopica a entrambe queste molecole o quando non è possibile verificare con sicurezza quale sia la molecola responsabile della reazione avversa9.
Ci sono alcuni svantaggi a utilizzare un antistaminico come anestetico locale. Innanzitutto l’iniezione è più dolorosa34, in secondo luogo la lucidità e la prontezza di riflessi dopo la somministrazione non sono per nulla garantiti. La sonnolenza lieve o moderata è un effetto collaterale molto comune ed è frequentemente accompagnata da vertigini e difficoltà a compiere movimenti in modo coordinato. Un paziente che ha subito un’anestesia locale con i farmaci tradizionali può tranquillamente uscire dallo studio e ritornare a casa da solo, anche guidando la macchina; non ha infatti normalmente effetti sistemici neurologici ed è sufficientemente lucido per non incorrere in incidenti. Al contrario un paziente a cui è stata fatto un’anestesia con un farmaco antistaminico potrebbe presentare sonnolenza e obnubilamento: non è consigliabile che guidi la macchina ed è preferibile che sia accompagnato anche se a piedi. Inoltre nei bambini il dosaggio degli antistaminici va calibrato a seconda del peso con una tolleranza minore di quanto è concesso dagli anestetici locali tradizionali. Per questo motivo molte molecole antistaminiche non dispongono dell’autorizzazione ministeriale a essere impiegate nei minori di 12 anni. Gli antistaminici vanno utilizzati con cautela in alcune patologie, tra cui il glaucoma ad angolo chiuso, l’ulcera peptica stenosante, l’ipertrofia prostatica.
Negli Stati Uniti una molecola particolarmente impiegata e studiata nella sua capacità anestetica è la difenidramina, farmaco antistaminico di prima generazione appartenente al gruppo degli H1 antagonisti (Figura 4).

Una diluizione allo 1% produrrebbe in circa 5 minuti nello 80% dei pazienti un buon grado di analgesia per un periodo variabile tra un quarto d’ora e tre ore (9,35). Le fiale di difenidramina commercializzate sul territorio americano hanno normalmente una concentrazione al 5% e quindi si raccomanda di diluire opportunamente il prodotto con soluzione fisiologica. L’uso della difenidramina è stato giudicato accettabile sia in chirurgia orale36 che in endodonzia37,38, anche se le differenti ricerche evidenziano come gli anestetici locali siano comunque più efficaci.
Per ciò che riguarda la situazione italiana, il principale problema risiede nel fatto che non esiste una formulazione in fiale a base di difenidramina, presente solo come pomate, compresse o sciroppi.
Come soluzione iniettabile sono presenti dei preparati a base di prometazina (50 mg/2 ml) o di clorfenamina maleato (10 mg/1 ml).
La prometazina vanta probabilmente il primato di essere stata la prima molecola antistaminica testata come anestetico locale39 ed è possibile reperire alcune ricerche, peraltro non esattamente recenti e non in campo odontoiatrico40,41 che ne confermerebbero una certa validità. In uno studio del 196041 si è impiegata sottocute con concentrazioni tra il 1,25% e il 2,5% per interventi di piccola chirurgia sulla pelle, come biopsie e escissioni di piccoli tumori. Il volume massimo impiegato era di 2 ml. In questo studio si raccomandava di limitare l’iniezione al sottocute, evitando la penetrazione intradermica del farmaco per scongiurare i rischi di reazioni tissutali marcate e una possibile necrosi.
Rimane quindi il dubbio degli effetti che si potrebbero avere impiegando questa molecola nel cavo orale, con infiltrazione sottomucosa. Di fatto in Italia le fiale a base di prometazina sono autorizzate come iniettabile per via intramuscolare o (se diluito) per via endovenosa.
La clorfenamina non è stata così ampiamente indagata come la difenidramina per i suoi effetti di anestetico locale. È stata comunque condotta una ricerca42 che ne ha testato questa capacità sulla cute e ha concluso che gli effetti sembrerebbero comunque accettabili, anche se più brevi della lidocaina. In questo studio venivano impiegati 5 mg di clorfenamina maleato in un volume di 0,5 ml di soluzione salina.
In Italia le autorizzazioni prevedono la somministrazione sottocute della clorfenamina, ma gli Autori del presente articolo non sono a conoscenza di prodotti iniettabili a base di clorfenamina (o di altri antistaminici) autorizzati sul territorio nazionale come anestetici locali. Ci si espone quindo a un utilizzo “off label” del principio attivo43. La legislazione italiana prevede che i farmaci possano essere impiegati per il trattamento di disturbi non previsti (e quindi appunto “off label”) nel “riassunto delle caratteristiche del prodotto”, che fornisce informazioni su come utilizzare un medicinale “in modo sicuro ed efficace”. Somministrando farmaci per indicazioni terapeutiche diverse rispetto a quelle per cui vengono normalmente prescritti (e sono stati autorizzati) si dovrebbero utilizzare innanzitutto “…molecole conosciute e utilizzate da tempo, per le quali le evidenze scientifiche suggeriscono un loro razionale uso anche in situazioni cliniche non approvate da un punto di vista regolatorio”43. In secondo luogo deve essere palese la mancanza di alternative migliori44. L’Agenzia Italiana del Farmaco (AIFA) rende disponibile liste contenenti tutti i farmaci per i quali è previsto anche un utilizzo di tipo off-label. Al momento della stesura del presente articolo gli Autori non sono riusciti a reperire la clorfenamina in queste liste per l’utilizzo come anestetico locale. Sarà quindi importante valutare con attenzione per il singolo paziente l’effettiva necessità di impiagare questa molecola. Nel caso si decidesse in senso positivo, sarà fondamentale la redazione di un consenso informato scritto, imprescindibile in questi casi.
Crioanestesia
La crioanestesia consiste nell’ottenere l’effetto anestetico topico tramite l’abbassamento della temperatura. A oggi non è ancora ben chiaro il meccanismo che provoca l’effetto analgesico, ma sembra rilevante il fatto che il raffreddamento induce una riduzione della velocità di conduzione nelle fibre nervose45. Da molti anni viene impiegata per eseguire piccoli interventi di chirurgia sulla cute46,47. L’uso di tecniche crioanestetiche in odontoiatria è noto da parecchio tempo48, ma il loro impiego più comune (e più studiato) è come pre-anestesia per diminuire il fastidio dovuto all’iniezione di anestetici locali49,50,51,52,53. Si distinguono fondamentalmente tre sistemi per ottenere una crio-anestesia: il ghiaccio, gli spray iportermizzanti oppure piccoli pellet di cotone bagnati e congelati54.
L’articolo di Harbert del 198951 illustra l’uso di tubetti di ghiaccio per ridurre il fastidio da iniezione di anestetici locali nella regione palatina retro-incisiva. Nelle ricerche di Aminabadi50 e di Ghaderi53 si indaga l’effetto pre-anestetico indotto con l’uso di ghiaccio lasciato nel fornice. Tutte queste ricerche concludono considerando efficace la pre-anestesia con il raffreddamento per diminuire il fastidio causato dalla successiva inserzione dell’ago della siringa. Il tempo di contatto consigliato del ghiaccio con la mucosa varia tra 1 minuto e 5 minuti. Si raccomanda anche di asciugare sempre la mucosa prima di applicarvi il ghiaccio per evitare che questo si attacchi e diventi difficile da rimuovere senza provocare eventuali lacerazioni.
Lo studio di Lathwal52 ha messo a confronto l’uso di applicazioni di ghiaccio per 1 minuto con spray refrigeranti nebulizzati per cinque secondi e ha evidenziato come la prima tecnica fosse più efficace. Un tempo eccessivamente prolungato di nebulizzazione di spray refrigerante può provocare lesioni cutanee o mucose55, quindi da questo punto di vista l’impiego del ghiaccio sembrerebbe più sicuro. Diversi spray ipotermizzanti, normalmente impiegati per i test di vitalità pulpare, vengono commercializzati con l’indicazione per poter essere impiegati anche per “l’incisione di ascessi o nelle estrazioni di elementi parodontalmente compromessi e di denti decidui mobili”. Se gli elementi dentali sono trattenuti nel cavo orale praticamente solo dalla mucosa è in effetti possibile che questa metodica sia sufficiente. Non è possibile reperire ricerche scientifiche sulla crio-anestesia impiegata per estrazioni più impegnative o devitalizzazioni.
Qualche anno fa negli stati uniti è iniziata la commercializzazione di un prodotto chiamato “GumEase”® (BioMEDevice, Laguna Hills, California) (Figure 5- 7). Tale apparecchio è stato introdotto sul mercato come prodotto a uso odontoiatrico per eseguire crioanestesia e risulta approvato nel 2007 dall’FDA per la “riduzione del 90% del dolore” come “Registered Class 2 Medical Device”. L’apparecchio risulta costituito da una sorta di tubo di consistenza elastica, sagomato in modo da poter essere inserito nel fornice della cavità orale. Il “tubo” è prodotto con un materiale privo di lattice e contiene un liquido, fondamentalmente una soluzione salina chiaramente non tossica. Viene fornito in buste sterili. Prima dell’utilizzo GumEase deve essere conservato per circa 8 ore a -6° Celsius (22° Fahrenheit). Durante questo periodo il liquido all’interno di GumEase raggiunge la temperatura adeguata. Si ritiene che, una volta posto nel fornice, l’effetto anestetico (o eventualmente di ipoestesia) si possa ottenere dopo 4-6 minuti. Per eseguire procedure odontoiatriche il GumEase deve essere sostituito ogni 20 minuti circa. I materiali di cui GumEase è costituito permettono un rilascio graduale del freddo che minimizza il rischio di provocare lesioni da congelamento sulle mucose. Si raccomanda comunque di non impiegare più di due o tre apparecchi, quindi di non superare un tempo di 40-60 minuti. Il meccanismo di induzione dell’anestesia consisterebbe nella riduzione di temperatura delle terminazioni nervose che si portano dai nervi alveolare superiore e inferiore agli apici dentali, al legamento parodontale e alle mucose. Uno sorta di anestesia plessica ottenuta con il freddo e non con i farmaci. Gli autori del presente articolo non sono stati in grado di trovare lavori scientifici che indagano l’efficienza di GumEase, anche se in internet è possibile reperire, ad esempio su YouTube, alcuni filmati dove viene utilizzato per eseguire curettaggi, otturazioni, devitalizzazioni e anche estrazioni di radici. Si tratta sempre di “case report”, ovvero di procedure eseguite su singoli pazienti. Il “GumEase” è stato recentemente rebrandizzato; oggi il nome attribuito al medesimo prodotto è “OraChill”® (CryoDevices LLC, 3308 El Camino Ave #276, Sacramento CA 95821) e viene commercializzato anche come un dispositivo per uso domiciliare per ridurre il dolore nei giorni seguenti all’applicazione di un apparecchio ortodontico fisso o a una sua attivazione.

Fig. 5, 6. GumEase/OraChill
Fig. 7a, b. Posizionamento intraorale di GumEase OraChill
TENS, “elettroanalgesia”
L’uso di correnti a scopo terapeutico è molto antico, pare che già gli egizi utilizzassero quelle prodotte dagli elettrofori (comunemente chiamati “anguille elettriche”) per curare il mal di testa56. TENS è l’acronimo di Transcutaneous Electric Nerve Stimulation. È una procedura che consiste nella stimolazione dei nervi attraverso la cute tramite l’applicazione di micro-correnti. Si ritiene che tale nome sia stato definito per la prima volta nel 1974 in un articolo di Charles Burton e collaboratori57. La TENS era comunque già impiegata antecedentemente a questa data in vari campi della medicina e anche oggi viene comunemente utilizzata in più ambiti, con efficacia variabile58, per controllare sia il dolore acuto59 che cronico60. Nel 1972 la FDA (Food and Drug Administration) ha approvato la TENS come sistema utile ad alleviare il dolore. Il meccanismo tramite cui agisce non è completamente chiaro, sembra comunque che la stimolazione nervosa con microcorrenti riduca a livello locale la percezione del dolore.
Si sarebbero identificati almeno tre meccanismi di azione:
- la riduzione locale della conduzione nervosa delle fibre del dolore61;
- l’aumento di produzione di oppioidi nel sistema nervoso centrale62;
- la riduzione del tasso ematico di citochine pro-infiammatorie (scoperta più recentemente)63.
Pare che il pioniere dell’uso delle “microcorrenti” (la TENS, nel senso stretto del termine, arriverà più tardi) in odontoiatria sia un certo Dr. Francis56, che nella metà del 1800 a Philadelphia eseguì 164 estrazioni ponendo un elettrodo sul dente interessato e il secondo in mano al paziente. Il Dr. Francis nel 1858 brevettò questo suo sistema di anestesia, ma alla fine dello stesso anno il College of Dentist of London si pronunciò in modo estremante scettico su questo tipo di metodica56 che venne quindi praticamente abbandonata.
Nel 1952 Suzuki propose l’uso del “manipolo elettrificato”64. La procedura consisteva nel far passare una corrente di 4-10 µA attraverso la fresa per ridurre il dolore nella preparazione delle cavità. La metodica presentava due limiti: la fresa doveva rimanere costantemente in contatto con il dente e, quando si era finito di preparare la cavità, l’effetto anestetico svaniva e non era disponibile per le procedure di ricostruzione. Negli anni successivi vennero messe a punto differenti declinazioni del “manipolo elettrificato” che però presentavano efficacia variabile.
Per ovviare a questi problemi nel 1978 Horiuchi e collaboratori65 proposero di applicare sulla dentina un elettrodo indipendente dal manipolo. Un secondo elettrodo veniva applicato sulle labbra. La corrente impiegata era di 0,1-1,5 mA e lo studio si limitava a carie cervicali. Negli anni ‘80 quindi l’attenzione di alcuni odontoiatri si sposta sull’impiego di elettrodi separati dal manipolo e sull’uso della TENS in senso stretto. In tempi più recenti, Dhindsa e collaboratori66 e Varadharaja e collaboratori67 hanno paragonato, su bambini, l’uso dell’anestetico tradizionale, somministrato tramite iniezione, all’uso della TENS per indurre anestesia per effettuare procedure odontoiatriche. Nel secondo studio ci si è limitati ad effettuare procedure conservative, mentre nel primo sono state eseguite anche pulpotomie ed estrazioni, ma solo su elementi decidui. Un’altra differenza tra le due ricerche riguarda il fatto che Dhindsa ha diviso il campione esaminato (180 soggetti) in due gruppi. A un gruppo è stata somministrata lidocaina al 2%, per l’altro gruppo si è impiegata la TENS. Nella ricerca di Varadharaja si è al contrario preferito un approccio “split mouth”: a ciascun bambino è stata eseguita sia la TENS, sul lato destro della bocca, che l’anestesia tradizionale, sul lato sinistro del cavo orale. Al di là delle differenze metodologiche, secondo entrambi questi lavori il potere anestetico della TENS sarebbe paragonabile a quello della lidocaina, almeno limitatamente alle procedure eseguite. Questo risultato sarebbe confermato anche da altri studi meno recenti68,69, 70,71, tutti eseguiti in età pediatrica testando la TENS per otturazioni, pulpotomie ed estrazioni di decidui.
Esistono meno ricerche effettuate su pazienti adulti e i risultati sono meno positivi. Kasat72 nel suo articolo “compilativo” del 2014 indica la possibilità di eseguire con successo estrazioni in pazienti adulti, ma non indica nessun riferimento bibliografico a supporto di questa sua affermazione. Malamed73 nel 1989 osservava una percentuale di successo fino a circa l’86% in pazienti adulti sottoposto a procedure conservative, ma se la cavità era più profonda di 2 mm questa frequenza scendeva a quasi il 60%. Nel 2010 Simon74 ha eseguito il blocco dell’alveolare inferiore con TENS e l’ha comparato con quello ottenuto tramite lidocaina 2% + epinefrina 1:100.000. Il confronto è stato eseguito impiegando un pulp tester e non si sarebbero trovate differenze significative.
Principi di funzionamento della TENS
Il corpo umano sottoposto a una microcorrente funziona come un complesso sistema di resistenze. Alcuni tessuti, come i muscoli, il sangue e i nervi, hanno una bassa resistenza; al contrario le ossa e le fasce connettivali sono cattivi conduttori. In qualche modo quindi la compagine della mandibola dovrebbe schermare il nervo alveolare inferiore. Dato che l’elettroanalgesia risulta possibile anche nell’arcata inferiore si è ipotizzato una sorta di effetto retrogrado attraverso il forame mandibolare. Alcuni Autori68 ipotizzano un effetto migliore nei bambini con denti in eruzione per la presenza di diversi difetti nella struttura ossea.
Gli apparecchi TENS possono erogare la corrente con forme d’onda differenti, le più comuni sono l’onda H e l’onda quadra. Esistono diversi studi che hanno valutato quale sia la forma d’onda più efficace75, ma l’argomento è ancora dibattuto.
I dispositivi TENS emettono la sequenza di onde con frequenze tra 1 e 100 Hz, quindi la “larghezza di impulso” (Pulse Width) è inferiore al millisecondo. La larghezza di impulso indica la durata di ciascun impulso, mentre la frequenza dice il numero degli impulsi erogati in un secondo. Per rispettare la teoria del Gate Control, la larghezza di impulso di solito non supera di molto i 200 µS, in modo da non eccitare le fibre C. Si ritiene che una frequenza di 2 Hz sia ideale per risolvere problemi muscolari, per ottenere elettroanalgesia sarebbero più appropriate frequenze tra i 55 e i 150 Hz76. Ad esempio deDuits69 nel suo lavoro ha impegato una frequenza di 110 Hz e una larghezza d’onda di 225 µS.
- Controindicazioni all’uso della TENS
Anche se l’uso di questa metodica, fatti salvi una corretta gestione e un appropriato posizionamento degli elettrodi, si è dimostrato sicuro, ci sono delle situazioni che ne controindicano l’uso. - Pazienti ansiosi o non collaboranti. Per poter essere efficace la TENS richiede un certo lasso di tempo durante il quale il paziente deve rimanere con gli elettrodi posizionati e “subire” le micro-scosse. Ciò richiede chiaramente un minimo grado di cooperazione. Pazienti con disabilità mentali, deficit comunicatori o semplicemente insofferenti, non si presentano come i candidati ideali per questa procedura. Anche bambini troppo piccoli, di età inferiore a tre anni68, non sono in genere adatti. Non sembra comunque una buona idea impiegare la TENS in soggetti che abbiano subito importanti traumi da scossa elettrica.
- Pazienti portatori di pacemaker cardiaci77. La possibilità di avere problemi dovrebbe essere alta se gli elettrodi sono posizionati sul torace, quindi in aree normalmente non utilizzate per gli usi odontoiatrici. I pacemaker “a richiesta” potrebbero essere più soggetti a essere “ingannati” dagli impulsi della TENS, mentre per quelli a “frequenza fissa” il problema dovrebbe essere più contenuto. Si raccomanda comunque una estrema prudenza nell’impiego della TENS in pazienti portatori di pacemaker, dato che secondo alcuni autori questa condizione configura una controindicazione assoluta.
- Pazienti con problemi vascolari cerebrali, con aneurismi, infarti e TIA non dovrebbero essere sottoposti a TENS, dato che questa procedura stimola il flusso sanguigno periferico e potrebbe portare all’insorgenza di problematiche serie68.
- Impianti cocleari78.
- Pazienti epilettici. Alcuni Autori ritengono che la TENS potrebbe avere il potenziale per evocare l’insorgenza di una una crisi79, altre fonti ne ritengono sicura l’applicazione, ma in distretti lontani dalla testa80. In mancanza di ulteriori studi la prudenza suggerirebbe di evitare l’impiego di questa metodica nel distretto cefalico nei pazienti che presentano questa patologia.
- Gravidanza. Anche in questo caso le informazioni reperibili appaiono controverse68, 80.
- Tumori di testa e collo78.
- Dolori acuti o di origine incerta. L’uso della TENS è decisamente non indicato perché si potrebbe rischiare di ostacolare la diagnosi68.
Indicazioni pratiche per eseguire una elettroanalgesia
Per effeturare elettroanalgesia a un paziente sono necessari l’apparecchiatura per generare l’impulso elettrico, i cavi e gli elettrodi da applicare al paziente (Figura 8). Esiste una grande varietà di macchine, sia da collegare alla rete elettrica sia alimentate a batteria. Fino a qualche anno fa esistevano delle macchine dedicate a uso odontoiatrico, ma oggi sono di non facile reperibilità; tra queste si può ricordare il Dental Electronic Anesthesia Delivery System 8670 (3M), che è stata anche oggetto di alcune pubblicazioni scientifiche76,81.
Gli elettrodi sono disponibili in varie fogge (circolari, quadrati, rettangolari) e dimensioni. A uso odontoiatrico sono utili elettrodi circolari o quadrati di dimensioni contenute. Gli elettrodi meno recenti hanno bisogno di un apposito gel conduttore (Figura 9) e di un apposito “cerotto” per essere fissati alla cute. Gli elettrodi più recenti sono autoadesivi (Figura 10). Sono disponibili vari tipi di elettrodi intraorali, come: elettrodi adesivi, spugne o manipoli su cui posizionare del cotone (Figura 11), eventualmente in rulli. Le spugne o il cotone rappresentano probabilmente la soluzione più economica e più pratica se si vuole avere un elettrodo endorale. Si noti che per poter condurre le microcorrenti, spugne e cotone devono essere bagnati con una soluzione di acido fluoridrico o con semplice acqua68. Gli elettrodi adesivi intraorali oggi sono praticamente abbandonati perché, a fronte di un costo maggiore, presentavano problemi di adesione alle mucose per l’umidità presente. In passato sono anche stati usati elettrodi foggiati come ganci di vario tipo; simili a quelli dei localizzatori apicali da applicare alle labbra, oppure ai ganci della diga da mettere sui denti, ma non sono più impiegati data la loro potenziale lesività. Infatti il rischio di avere scottature elettriche per un’eccessiva stimolazione sarebbe minimizzato dall’impiego di elettrodi con superficie di almeno 4 cm2 82. A oggi sono invece ancora in commercio gli elettrodi endodontici (Figura 12).
Applicati gli elettrodi e scelte le opportune lunghezza d’onda e frequenza si può erogare la corrente. L’intensità (stimata in Ampere) viene iniziamene erogata con un valore minimo e, lentamente ma progressivamente, aumentata fino a quando la muscolatura facciale adiacente agli elettrodi inizia ad evidenziare delle piccole contrazioni68. Se il paziente sente un grado eccessivo di discomfort, deve comunicarlo all’operatore che, tempestivamente, ridurrà il livello di Ampere. Il tempo medio per poter ottenere anestesia è di circa 25-30 minuti.
Posizionamento degli elettrodi
Gli elettrodi non devono assolutamente essere posizionati in modo che la corrente attraversi l’encefalo, ad esempio non devono mai essere messi contemporaneamente sui due muscoli temporali a destra e sinistra68,83. Vanno assolutamente evitati posizionamenti diretti sui bulbi oculari68.
Per ottenere anestesia nell’arcata inferiore gli elettrodi vanno posti bilateralmente al di sopra dei forami mentonieri, mantenendone il bordo qualche millimetro al di sotto delle labbra (Figura 13).
Una tecnica alternativa per i settori posteriori inferiori prevede che il primo elettrodo vada posto al di sopra del forame mentoniero e il secondo in corrispondenza degli apici delle radici del secondo molare (Figura 14). Per l’arcata superiore gli elettrodi vanno posizionati proprio sotto lo zigomo, bilateralmente in corrispondenza degli apici dei premolari (Figura 15). Una tecnica alternativa per i settori posteriori superiori prevede che il primo elettrodo vada posto in corrispondenza degli apici dei premolari ed il secondo a livello degli apici del secondo molare (Figura 16).
Indicazioni all’uso della TENS
Quamstrom68 e Lodaya78 sconsigliano l’uso della TENS per eseguire estrazioni su denti che che non siano decidui con radici parzialmente riassorbite. Per le procedure endodontiche e parodontali non chirurgiche si è più ottimisti. In particolare Quamstrom riporta di essere riuscito a ottenere un buon grado di controllo del dolore anche in alcuni casi di pulpiti acute, dove gli anestetici locali avevano fallito.
Per le procedure conservative si ritiene possibile avere una maggior possibilità di successo negli elementi dentali anteriori ai molari ed in generale quanto più gli elementi sono mesiali, tanto maggiore è il grado di analgesia che si riesce a ottenere68.
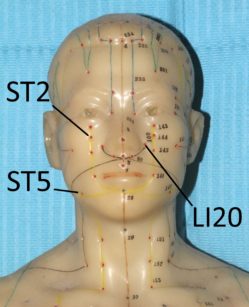
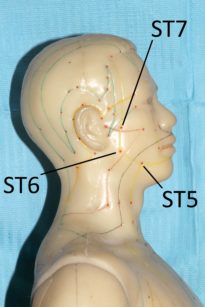
Fig. 17a, b. Punti ST2 ST5 ST6 ST7 LI20
Agopuntura
L’agopuntura è stata impiegata da almeno 2500-3000 anni con svariati scopi e trova le sue origini nell’antica Cina. Tra le “medicine alternative”, a cui la FNOMCEO ha “aperto” nel 2000, è sicuramente la più conosciuta e la più indagata dal punto di vista scientifico. Nella “medicina tradizionale cinese” l’agopuntura è definita come: “la stimolazione di determinati punti sulla superficie del corpo umano tramite diverse tecniche con o senza l’inserzione di aghi. Tra le tecniche di stimolazione si annoverano l’uso di energie elettriche (elettro-TENS, elettro-agopuntura), magnetiche, luminose (laser) e sonore, o la coppetazione (stimolazione tramite suzione) e la moxibustione (stimolazione tramite la combustione di erbe particolari). La stimolazione ha lo scopo di normalizzare le funzioni fisiologiche o curare varie condizioni del corpo umano84.
Sembra che il meccanismo d’azione dell’agopuntura consista nello stimolare il sistema nervoso variandone il modo con cui processa i segnali dolorosi. Probabilmente nel meccanismo sono coinvolti alcuni mediatori antidolorifici come la serotonina e alcune endorfine85. Esistono diverse ricerche che evidenziano come l’agopuntura sia in grado di alleviare diversi dolori cranio-facciali, tra cui il dolore dentale acuto86,87. Secondo la medicina tradizionale cinese la stimolazione dei punti facciali ST6 ed ST7 e di alcuni punti “distanti” come LI4 sarebbe adeguata per l’analgesia dentale88. La spiegazione scientifica del perché punti “lontani” dal cranio possano indurre riduzione del dolore dentale risiederebbe nella capacità dell’agopuntura di variare, a livello del sistema nervoso centrale, la percezione del dolore88. Ci sono lavori che evidenziano come questa metodica possa diminuire il dolore post operatorio dopo l’estrazione dei terzi molari89.
Alcuni studi sono stati effettuati per verificare se l’agopuntura può essere impiegata come una sorta di anestesia alternativa per eseguire procedure dentali. Rosted e Bundegard hanno evidenziato come, nei pazienti precedentemente sottoposti a una seduta di agopuntura con la stimolazione dei punti ST5, ST6 e SI19, il tempo di induzione per ottenere anestesia tronculare fosse decisamente minore90. Simmons e Oleson91 hanno invece dimostrato un elevamento della soglia del dolore pulpare dopo stimolazione con elettro-agopuntura a livello auricolare. Jalali e collaboratori92, stimolando il punto LI4, hanno evidenziato come l’agopuntura migliori la percentuale di successo di blocco alveolare inferiore (eseguito con anestetici locali) in presenza di pulpiti acute irreversibili.
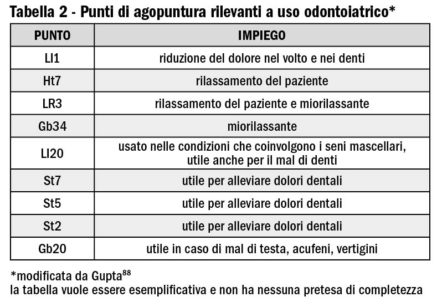
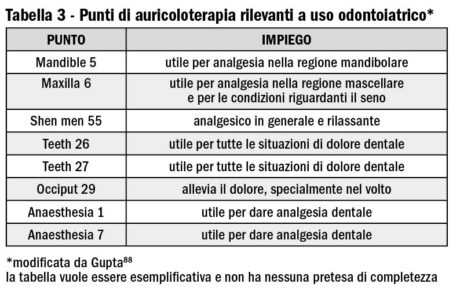
Altri punti rilevanti per operare nel distretto facciale sono riportati nella Tabella 2 per l’agopuntura e nella Tabella 3 per l’auricoloterapia (agopuntura limitata alla regione auricolare). In effetti la tendenza generale è quella di impiegare questa tecnica per aumentare gli effetti dell’anestesia locale tradizionale. È possibile però trovare alcune pubblicazioni scritte in cinese93,94 che riportano di estrazioni dentali effettuate con la sola anestesia tramite agopuntura. La raccomandazione di entrambe è di eseguire queste procedura al massimo in 15 minuti. Hu95 ha riportato in un lavoro redatto in lingua inglese di un estrazione complessa eseguita in una paziente allergica agli anestetici locali.
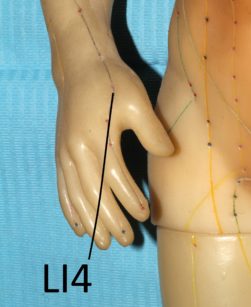
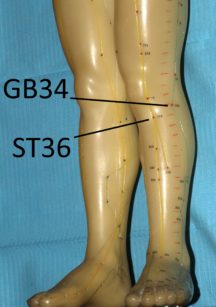
L’intervento è durato oltre un’ora e l’anestesia è stata effettuata solamente con elettro-agopuntura. Gli Autori riportano di aver stimolato bilateralmente LI4, ST36 e ST44 per 15 minuti con un’onda quadra ad 1,2 Hz. Stante la possibilità di “migliorare” le potenzialità degli anestetici locali il ruolo dell’agopuntura come anestetico alternativo rimane comunque abbastanza controverso e andrebbe ulteriormente accertato data una decisa variabilità di risultato anche a seconda dei pazienti96 e probabilmente degli operatori.
Considerazioni finali
Quando si deve intervenire su un paziente potenzialmente allergico, il primo passo da compiere è capire se è veramente allergico e, se si, a quale farmaco. Può essere opportuno valutare tramite test allergologici se si può impiegare con un ragionevole margine di sicurezza un anestetico locale differente. Eventualmente ci si può cautelare ulteriormente con una pre-medicazione a base di corticosteroidi e antistaminici. Come sempre, se un paziente è considerato particolarmente “a rischio”, la soluzione migliore è trattarlo in un “ambiente protetto”, ovvero in un centro ove sia presente un’equipe allenata a trattare casi di allergia grave. Nei casi più ostici, alcuni autori consigliano di eseguire le cure in anestesia generale97. Questo tipo di approccio è sicuramente consigliabile se sono necessari trattamenti odontoiatrici estesi. Chiaramente non risulta pratico quando il paziente si deve sottoporre a trattamenti più semplici, come una singola devitalizzazione o estrazione.
Per eseguire piccoli interventi in studio, una possibilità potrebbe essere rappresentata dall’impiego di tecniche di anestesia alternativa. La procedura “più efficace” è rappresentata dall’impiego di antistaminici iniettati per produrre anestesia. Purtroppo, come evidenziato nel paragrafo dedicato, in Italia a oggi, questo tipo di approccio pone difficoltà sia tecniche (mancanza di disponibilità della molecola di prima scelta nella forma farmaceutica adeguata) che medico-legali (uso off-label). La crioanestesia, la TENS e l’agopuntura possono essere sufficienti per interventi “minori”, ma non sempre per ottenere una completa assenza di dolore per procedure più invasive, per lo meno nella maggior parte dei pazienti. Se questi sistemi avessero la stessa efficacia degli anestetici locali la loro diffusione sarebbe ormai ampia e avrebbero da tempo soppiantato l’uso dei farmaci tradizionali. L’agopuntura poi in particolare richiede un certo grado di perizia da parte degli operatori, con manovre un po’ più complesse rispetto alla semplice iniezione del farmaco. È comunque doveroso ricordare che, anche impiegando gli anestetici locali tradizionali, non sempre si riesce a ottenere un completo grado di anestesia98; di conseguenza in un paziente allergico che deve sottoporsi a una procedura non eccessivamente invasiva una “riduzione del dolore”, anche solo parziale, potrebbe comunque essere un compromesso accettabile rispetto al rischio di essere esposto a una grave reazione allergica95.
Corrispondenza
acbutti@gmail.com
Allergy to local anesthetic in dentistry:
alternative procedures and techniques to give analgesia
Summary
Local anesthetic are really safe and seldom cause allergic reactions. However some patients report having allergic reactions to these drugs. The main differential diagnosis is with toxic reactions, which are more frequent. Specific tests allow to diagnose a real allergy and eventually to find different local anesthetics that should not give cross reactions.If it doesn’t seem safe to employ a local anesthetic, it is possible to operate under total anesthesia. Clearly this approach is reasonable for relevant dental works. For minor procedures we could give analgesia with some alternative techniques, such as: antihistamines injected as local anesthetics, crioanesthesia, TENS and acupuncture.
- Gaffen AS, Haas DA. Survey of local anesthetic use by Ontario dentists, J Can Dent Assoc 2009 Nov;75(9):649.
- Nazir MS, Holdcroft A. Local anaesthetic drugs: adverse effects as reported through the ADROIT system in the UK. Pharmacoepidemiol Drug Saf 2009 Nov;18(11):1000-6. doi: 10.1002/pds.1813.
- Baluga JC. Allergy to local anesthetics in dentistry. Myth or reality? Rev Alerg Mex 2003 Sep-Oct;50(5):176-81.
- Association of Anaesthetists of Great Britain and Ireland. Suspected anaphylactic reactions associated with anaesthesia. Anaesthesia 2009;64:199-211.
- Tomoyasu Y, Mukae K, Suda M, et al. Allergic reactions to local anesthetics in dental patients: analysis of intracutaneous and challenge tests. The Open Dentistry Journal 2011;5:146-149.
- Liu W, Yang X, Li C, Mo A. Adverse drug reactions to local anesthetics: a systematic review. Oral Surg Oral Med Oral Pathol Oral Radiol 2013 Mar;115(3):319-27.
- Meechan JG, Rood JP. Aspiration in dental local anaesthesia. Br Dent J 1992 Jan 25;172(2):40.
- Becker DE, Reed KL. Local anesthetics: review of pharmacological considerations. Anesth Prog. 2012 Summer;59(2):90-102.
- Pavlidakey PG, Brodell EE, Helms SE. Diphenhydramine as an alternative local anesthetic agent. J Clin Aesthet Dermatol 2009;2(10):37-40.
- Nettis E, Colanardi MC, Ferrannini A, Tursi A. Reported latex allergy in dental patients. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2002 Feb;93(2):144-8.
- Parkes AW, Harper N, Herwadkar A, Pumphrey R: Anaphylaxis to the chlorhexidine component of Instillagel(R): a case series. Br J Anaesth 2009; 102: 65-68.
- Brockow K, Przybilla B, Aberer W, et al. Guideline for the diagnosis of drug hypersensitivity reactions. Allergo J Int 2015; 24: 94-105.
- Chiriac AM, Demoly P. Drug provocation tests: up-date and novel approaches. Allergy Asthma Clin Immunol 2013;9:12. doi:10.1186/1710-1492-9-12.
- Grzanka A, Wasilewska I, cliwczyaska M, Misiołek H. Hypersensitivity to local anaesthetics. Anaesthesiology Intensive Therapy 2016;48 (2):128-134.
- Soyer O, Sahiner UM, Sekerel BE. Pro and contra: provocation tests in drug hypersensitivity. Int J Mol Sci 2017;18:1437.
- Dreborg S, Backman A, Basomba A, et al. Skin tests used in type I allergy testing. Position paper of the European Academy of Allergy and Clinical Immunology. Allergy 1989;44:1-69.
- Michalska-Krzanowska. Skin prick test in the diagnosis of allergy in the perioperative period -8 year experience. J Allergy Ther 2014;5:5.
- Bernstein IL, Storms WW. Practice parameters for allergy diagnostic testing. Joint Task Force on Practice Parameters for the Diagnosis and Treatment of Asthma. The American Academy of Allergy, Asthma and Immunology and the American College of Allergy, Asthma and Immunology. Ann Allergy Asthma Immunol 1995;75:543-625.
- Brockow K, Garvey LH, Aberer W, , et al. Skin test concentrations for systemically administered drugs – an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy 2013; 68: 702-712.
- Aas K, Aberg N, Bachert C. European White Paper Aviso sprl, Van Moerbeke D. Bruxelles 1997; 8-13.
- Klein CE, Gall H. Type IV allergy to amide-type local anesthetics. Contact Dermatitis 1991;25:45-48.
- Brown SG, Blackman KE, Heddle RJ. Can serum mast cell tryptase help diagnose anaphylaxis? Emerg Med Australas 2004;16:120-124.
- Aberer W, Bircher A, Romano A, European Network for Drug Allergy (ENDA), et al. Drug provocation testing in the diagnosis of drug hypersensitivity reactions. General considerations. Allergy 2003;58:854-863.
- Joint Task Force on Practice Parameters; American Academy of Allergy, Asthma and Immunology; American College of Allergy, Asthma and Immunology; Joint Council of Allergy, Asthma and Immunology. Drug allergy: an updated practice parameter. Ann. Allergy Asthma Immunol 2010;105:259-273.
- Ring J, Franz K, Brockow K. Anaphylactic reactions to local anesthetics. Chem Immunol Allergy 2010;95:190−200.
- Berkun Y, Ben-Zvi A, Levy Y, Galili D, Shalit M. Evaluation of adverse reactions to local anesthetics: experience with 236 patients. Ann Allergy Asthma Immunol 2003;91:342-5.
- Ministero del Lavoro, della Salute e delle Politiche Sociali. Dipartimento della Qualità. Direzione Generale della Programmazione sanitaria, dei Livelli di assistenza e dei principi etici Di sistema, Ufficio III. Manuale per la Sicurezza in sala operatoria: Raccomandazioni e Checklist, 2009
- Lobefalo G, Di Minno R, Chiacchio D, et al. Prevenzione delle reazioni di ipersensibilità a mezzo di contrasto o ad anestetici. Quaderni ACP 2006;13(5):227.
- Mirakian R, Ewan PW, Durhamw SR, et al. BSACI guidelines for the management of drug allergy. Clinical and Experimental Allergy 2009;39:43-61.
- Manfredi G, Pezzuto F, Balestrini A,et al. Perioperative anaphylactic risk score for risk-oriented premedication. Transl Med UniSa 2013 Sep-Dec;7:12-17.
- Regione Veneto Azienda ULSS 8 Asolo. Ospedale di Castelfranco Veneto e Montebelluna. Protocollo di premedicazione per i pazienti con reazioni avverse ad anestetici e mezzi di contrasto proposto dal Servizio di Allergologia e Immunologia Clinica (direttore prof. G.W.Canonica), Dipartimento Medicina interna, Università di Genova, 2008..
- Green SM, Rothrock SG, Gorchynski J. Validation of diphenhydramine as a dermal local anesthetic. Ann Emerg Med 1994;23(6):1284-1289.
- Bartfield JM, Jandreau SW, Raccio-Robak N. Randomized trial of diphenhydramine versus benzyl alcohol with epinephrine as an alternative to lidocaine local anesthesia. Ann Emerg Med 1998;32(6):650-654.
- Ernst AA, Anand P, Nick T, Wassmuth S. Lidocaine versus diphenhydramine for anesthesia in the repair of minor lacerations. J Trauma 1993;34(3):354-357.
- Ernst AA, Marvez-Valls E, Mall G, et al. 1% lidocaine versus 0.5% diphenhydramine for local anesthesia in minor laceration repair. Ann Emerg Med 1994;23(6):1328-1332.
- Gallo WJ, Ellis E. Efficacy of diphenhydramine hydrochloride for local anesthesia before oral surgery. J Am Dent Assoc 1987;115(2):263-266.
- Uckan S, Guler N, Sumer M, Ungor M. Local anesthetic efficacy for oral surgery: comparison of diphenhydramine and prilocaine. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998 Jul;86(1):26-30.
- Willett J, Reader A, Drum M, Nusstein J, Beck M. The anesthetic efficacy of diphenhydramine and the combination diphenhydramine/lidocaine for the inferior alveolar nerve block. J Endod 2008 Dec;34(12):1446-50.
- Halpern BN, Perrin G, Dews P. Compt Rend So. Bio. 1947;141:1125.
- Kumar S, Gupta RL, Chawla R. Efficacy and safety of promethazine hydrochloride as a local anaesthetic agent for inguinal hernia repair: a pilot study. Br J Clin Pract 1997 Jan-Feb;51(1):33-5.
- Kalz F, Fekete Z. The use of promethazine as a local anaesthetic. Can Med Assoc J 1960 Apr 16;82:833-4
- Orhan ME, Yüksel U, Bilgin F, Dorul A. Comparison of the local anesthetic effects of chlorpheniramine, midazolam, lidocaine, and normal saline after intradermal injection. Med Sci Monit 2007 Apr;13(4):PI7-11.
- D.Lgs. 17 febbraio 1998, n. 23, Art. 3 (convertito, con modificazioni, nella Legge 8 aprile 1998, n. 94.1).
- Aifa Bollettino di informazione sui farmaci 2006;13(3):140-141.
- Halar EM, DeLisa JA, Brozovich FV. Nerve conduction velocity: relationship of skin, subcutaneous and intramuscular temperatures. Arch Phys Med Rehabil 1980; 61:199-203.
- Leff DR, Nortley M, Dang V, Bhutiani RP. The effect of local cooling on pain perception during infiltration of local anaesthetic agents: a prospective randomised controlled trial. Anaesthesia 2007 Jul;62(7):677-82.
- Chan HH, Lam LK, Wong DS, Wei WI. Role of skin cooling in improving patient tolerability of Q-switched Alexandrite (QS Alex) laser in nevus of Ota treatment. Lasers Surg Med 2003;32(2):148-51.
- Oudrán L, Vasulín M. Local anesthesia by cold in dentistry. Cesk Stomatol 1971 May;71(3):170-4.
- Harbert H. Topical ice: a precursor to palatal injections. J Endod 1989 Jan;15(1):27-8.
- Aminabadi NA, Farahani RM. The effect of pre-cooling the injection site on pediatric pain perception during the administration of local anesthesia. J Contemp Dent Pract 2009 May 1;10(3):43-50.
- Ghaderi F, Banakar S, Rostami S. Effect of pre-cooling injection site on pain perception in pediatric dentistry: a randomized clinical trial. Dent Res J (Isfahan) 2013 Nov;10(6):790-4.
- Lathwal G, Pandit IK, Gugnani N, Gupta M. Efficacy of different precooling agents and topical anesthetics on the pain perception during intraoral injection: a comparative clinical study. Int J Clin Pediatr Dent 2015;8(2):119-22.
- Davoudi A, Rismanchian M, Akhavan A, et al. A brief review on the efficacy of different possible and nonpharmacological techniques in eliminating discomfort of local anesthesia injection during dental procedures. Anesth Essays Res 2016 Jan-Apr;10(1):13-6. doi: 10.4103/0259-1162.167846.
- Jayasuriya NSS, Weerapperuma ID, Amarasinghe MGCK. The use of an iced cotton bud as an effective pre-cooling method for palatal anaesthesia: a technical note. Singapore Dent J 2017 Dec;38:17-19. doi: 10.1016/j.sdj.2017.07.001.
- Wiswall AT, Bowles WR, Lunos S, et al. Palatal anesthesia: comparison of four techniques for decreasing injection discomfort. Northwest Dent 2014 Jul-Aug;93(4):25-9.
- Kane K, Taub A. A history of local electrical analgesia. Pain 1975;1:125-138
- Burton, C., Maurer, DD. Pain suppression by transcutaneous electrical nerve stimulation. IEEE Transactions on Biomedical Engineering 1974;21,81-88.
- Fiorelli A, Morgillo F, Milione R, et al. Control of post-thoracotomy pain by transcutaneous electrical nerve stimulation: effect on serum cytokine levels, visual analogue scale, pulmonary function and medication. European Journal of Cardio-Thoracic Surgery 2012;41(4):861–868. doi: 10.1093/ejcts/ezr108.
- Johnson MI, Paley CA, Howe TE, Sluka KA. Transcutaneous electrical nerve stimulation for acute pain. Cochrane Database of Systematic Reviews 2015. doi: 10.1002/14651858.CD006142.pub3.
- Sharma N, Rekha K, Srinivasan JK. Efficacy of transcutaneous electrical nerve stimulation in the treatment of chronic pelvic pain. Journal of Mid-life Health 2017;8(1):36-39. doi: 10.4103/jmh.JMH_60_16.
- Cramp AF, Gilsenan C, Lowe AS, Walsh DM. The effect of high- and low-frequency transcutaneous electrical nerve stimulation upon cutaneous blood flow and skin temperature in healthy subjects. Clinical Physiology 2000;20(2):150–157. doi: 10.1046/j.1365-2281.2000.00240.x.
- Sluka KA, Walsh D. Transcutaneous electrical nerve stimulation: basic science mechanisms and clinical effectiveness. The Journal of Pain 2003;4(3):109-121. doi: 10.1054/jpai.2003.434.
- do Carmo Almeida TC, Dos Santos Figueiredo FW, Barbosa Filho VC, et al. Effects of transcutaneous electrical nerve stimulation on proinflammatory cytokines: systematic review and meta-analysis. Mediators Inflamm 2018 Apr 2;2018:1094352. doi: 10.1155/2018/1094352. eCollection 2018.
- Suzuki K. New dentin-desensitizing technic by means of electro anesthesia. J Jpl Stomato Soc 1952;19:56-69.
- Horiuchi H, Suda H, Hanada T, Suzuki K. Anodal elecrtrotonus using a separate electrode to suppress pain during cavity preparation in labiocervical cavities. Bull Tokio Med Dent Univ 1978; 25: 101-10.
- Dhindsa A, Pandit IK, Srivastava N, Gugnani N. Comparative evaluation of the effectiveness of electronic dental anesthesia with 2% lignocaine in various minor pediatric dental procedures: A clinical study. Contemp Clin Dent 2011 Jan;2(1):27-30. doi: 10.4103/0976-237X.79305.
- Varadharaja M, Udhya J, Srinivasan I, et al. Comparative clinical evaluation of transcutaneous electrical nerve stimulator over conventional local anesthesia in children seeking dental procedures: A clinical study. J Pharm Bioallied Sci. 2014 Jul;6(Suppl 1):S113-7. Doi: 10.4103/0975-7406.137407.
- Quamstrom F. Electronic dental anesthesia. Anesth Prog 1992; 39: 162-77.
- teDuits E, Goepferd S, Donly K, et al. The effectiveness of electronic dental anesthesia in children. Pediatr Dent 1993 May-Jun;15(3):191-6.
- Croll TP, Simonsen RJ. Dental electronic anesthesia for children: technique and report of 45 cases. ASDC J Dent Child. 1994 Mar-Apr;61(2):97-104.
- Munshi AK, Hegde AM, Girdhar D. Clinical evaluation of electronic dental anesthesia for various procedures in pediatric dentistry. J Clin Pediatr Dent 2000 Spring;24(3):199-204.
- Kasat V, Gupta A, Ladda R, et al. Transcutaneous electric nerve stimulation (TENS) in dentistry. A review. J Clin Exp Dent 2014 Dec; 6(5): e562–e568. doi: 0.4317/jced.51586.
- Malamed SF, Quinn CL, Torgersen RT, Thompson W. Electronic dental anesthesia for restorative dentistry. Anesth Prog 1989;36:195-8.
- Simon F, Reader A, Drum M, et al. A prospective, randomized single-blind study of the anesthetic efficacy of the inferior alveolar nerve block administered with a peripheral nerve stimulator. J Endod 2010 Mar;36(3):429-33. doi: 10.1016/j.joen.2009.11.023.
- Jenkner FL, Schuhfried F. Transdermal transcutaneous electric nerve stimulation for pain: the search for an optimal waveform. Appl Neurophysiol 1981;44(5-6):330-7.
- Baghdadi ZD Evaluation of electronic dental anesthesia in children. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999 Oct;88(4):418-23.
- Eriksson M, Schüller H, Sjölund B. Hazard from transcutaneous nerve stimulation in patients with pacemakers. Lancet 1978 Jun 17;1(8077):1319.
- Lodaya R, Bhat C, Gugwad SC, et al. Clinical evaluation of transcutaneous electrical nerve stimulation (TENS) for variouse treatment procedures in pediatric dentistry. Int J of Clin Dent Sci 2010; 1: 20-25.
- Scherder E, Van Someren E, Swaab DJ. Epilepsy: a possible contraindication for transcutaneous electrical nerve stimulation. Pain Symptom Manage 1999 Mar;17(3):152-3.
- http://www.epilepsyandpregnancy.co.uk/pages/faq.htm (ultimo accesso agosto 2018)
- Bruzek DB, Geistfeld NS. Clinical study to evaluate the use of electronic anesthesia during dental hygiene procedures. Northwest Dent 1996 May-Jun;75(3):21-6.
- Katch EM. Application of transcutaneous electrical nerve stimulation in dentistry. Anesth Prog 1986 May-Jun;33(3):156-60.
- Goddard GV, McIntyre DC, Leech CK. A permanent change in brain function resulting from daily electrical stimulation. Exp Neurol 1969 Nov;25(3):295-330.
- Stux G, Pomeranz G. Scientific basis of acupuncture. Acupuncture textbook and atlas. Heidelberg, Springer Verlag, 1987.
- Fang J, Jin Z, Wang Y, et al. The salient characteristics of the central effects of acupuncture needling: Limbic–paralimbic–neocortical network modulation. Hum Brain Mapp 2009;30(4):1196-1206.
- National Institutes of Health (NIH). NIH Consensus Conference: Acupuncture. JAMA. 1998;280(17):1518-1524.
- Ernst E, Pittler MH. The effectiveness of acupuncture in treating acute dental pain: A systematic review. Br Dent J 1998;184(9):443-447.
- Gupta S, Somasundaram, Kumaran N, et al. Acupuncture and Dentistry. OHDM 2014; 13(4): 902-910.
- Tavares MG, Machado AP, Motta BG, et al. Electro-acupuncture efficacy on pain control after mandibular third molar surgery. Braz Dent J 2007;18(2):158-62.
- Rosted P, Bundgaard M. Can acupuncture reduce the induction time of a local anaesthetic? A pilot study. Acupunct Med 2003;21(3):92-99.
- Simmons MS, Oleson TD. Auricular electrical stimulation and dental pain threshold. Anesth Prog 1993;40(1):14-19.
- Jalali S, Moradi Majd N, Torabi S, et al. The effect of acupuncture on the success of inferior alveolar nerve block for teeth with symptomatic irreversible pulpitis: a triple-blind randomized clinical trial. J Endod 2015 Sep;41(9):1397-402. doi: 10.1016/j.joen.2015.04.026. Epub 2015 Jun 16.
- Liu WT, Zhang ZY. Clinical observation of 37 extrac-tions under acupuncture anesthesia. J Clin Acupunct Moxibustion 2004;20:24.
- Tang YF. Clinical observation on 28 cases of dental extrac-tion based on acupuncture anaesthesia. Guiding J TCM 2006;12:72-73.
- Hu WL, Hung YC. Acupunture anesthesia for complicated dental exctractionin patients with lidocaine allergy. J Alternat Complement Med 2009; 15(11): 1149-1152.
- Gupta D, Dalai DR, Swapnadeep, Mehta P, et al. Acupuncture. An emerging adjunct in routine oral care. Tradit Complement Med 2014 Oct-Dec; 4(4): 218–223. doi: 10.4103/2225-4110.139113.
- Davies C, Harrison M, Roberts G. Guideline for the use of general anaesthesia (GA) in paediatric dentistry. UK National Clinical Guidelines in Paediatric Dentistry, 2008.
- Weinstein P, Milgrom P, Kaufman E, et al. Patient perceptions of failure to achieve optimal local anesthesia. Gen Dent 1985 May-Jun;33(3):218-20.