La valutazione delle mucose orali è un atto imprescindibile nella routinaria visita odontoiatrica. Il riconoscimento di lesioni di varia natura eziopatogenetica è fondamentale per avviare un corretto processo diagnostico e approntare una mirata e precoce terapia (farmacologia e/o chirurgica). Il ritardo diagnostico comporta delle implicazioni medico-legali per l’odontoiatra e cliniche per il paziente che il più delle volte sarebbe oggetto dell’ulteriore conseguenza di vedere inficiata la qualità della vita. Il presente articolo si prefigge di trattare sotto l’aspetto squisitamente clinico quelle che sono le principali affezioni riscontrabili a carico delle mucose orali, correlarle con quadri sistemici e gestirle secondo le regole della evidence based dentistry. Un ricco corredo iconografico è fornito come supporto alla trattazione.
Oral mucosal diseases in the clinical practice
Oral mucosal evaluation is crucial in the routine dental visits. The identification of lesions (of different etiopathogenetic origin) is fundamental to initiate a proper diagnostic pathway and to perform a correct and early treatment (pharmacological and/or surgical). The diagnostic delay has medico-legal implications for the dentist and influences the clinical outcomes for the patient, including his quality of life. This article aims to discuss the main clinical aspects of oral mucosal diseases and their correlations with systemic health. Moreover, treatment strategies are provided according to the evidence based dentistry. Numerous clinical picture are provided as support to the text.
La semeiotica odontostomatologica non può prescindere da un accurato esame delle mucose del cavo orale. Queste ultime possono essere sede dell’estrinsecazione oltre che di patologie intrinseche anche di numerosi quadri patologici di natura infettiva, reattiva, autoimmune (proprie delle mucose o espressione di patologie sistemiche), preneoplastica e neoplastica. Il pronto riconoscimento è la premessa per una corretta diagnosi che a sua volta diviene imprescindibile per un trattamento adeguato, precoce ed efficace nel migliorare le condizioni cliniche del paziente e, non ultima, la sua qualità della vita. Anche il “semplice” indirizzare il soggetto verso i centri di riferimento ospedaliero-universitari1 permette di arginare il fenomeno del ritardo diagnostico che molto spesso affligge coloro che sono affetti da patologie delle mucose orali, pazienti sempre più peregrinanti da uno specialista all’altro in attesa di una risposta ai loro problemi stomatologici. Verranno di seguito trattati i principali quadri clinici inerenti le patologie delle mucose orali, corredando a supporto una ricca iconografia esemplificativa dei casi trattati.
Pseudolesioni della mucosa orale
Vi sono molte strutture anatomiche della cavità orale che possono essere facilmente scambiate per alterazioni patologiche. È importante distinguere le variazioni anatomiche delle parti orali normali dalle vere e proprie alterazioni patologiche, in modo da evitare confusioni grossolane ed errori diagnostici.
Lo sviluppo embriogenetico dei tessuti oro-facciali è alquanto complesso, quindi si può facilmente comprendere come i disturbi della crescita e dei processi di fusione possano dare delle alterazioni cosiddette disembriogenetiche che comunque, nella maggioranza dei casi, rappresentano delle semplici variazioni dell’anatomia normale.
Da marzo 2006 Professore Ordinario di Malattie Odontostomatologiche presso il Dipartimento di Discipline Odontostomatologiche, Ortodontiche e Chirurgiche la Seconda Università degli Studi di Napoli è titolare della cattedra di Patologia Speciale Odontostomatologica e di Clinica Odontostomatologica presso il Corso di Laurea in Odontoiatria e Protesi Dentaria della S.U.N. e docente presso le Scuole di Specializzazione in Chirurgia Odontostomatologica, Ortognatodonzia, Gastroenterologia. Attualmente è Direttore del Programma di Patologia delle Mucose Orali nonché Primario della U.O.C. di Patologia Speciale Odontostomatologica del Dipartimento Assistenziale Integrato di Odontoiatria della Seconda Università degli Studi di Napoli, per la prevenzione, diagnosi e cura delle patologie della mucosa orale, quali: aftosi orale, candidosi orale, eritema multiforme, lupus, pemfigo, pemfigoide, sclerosi sistemica, sindrome di Sjögren, BMS, stomatite erpetica, stomatopatie allergiche, precancerosi orali (leucoplachia, eritroplachia), neoplasie benigne e maligne del cavo orale (carcinoma squamoso orale), manifestazioni orali di patologie sistemiche. Centro di Riferimento per la Diagnosi e la Terapia del Carcinoma del Cavo Orale AMDI. Centro di Riferimento per la Diagnosi Clinica del Cancro Orale. Progetto FNOMCeO-CAO.
 Laurea in Medicina e Chirurgia nel 1981, specializzazione in Odontostomatologia nel 1984, ricercatore dal 1992 al 1997 presso l’Università degli Studi di Napoli, dal 1997 a febbraio 2006 è Professore Ordinario presso l’Università degli Studi di Bari e titolare della cattedra di Clinica Odontostomatologica presso il Corso di Laurea Specialistica in Odontoiatria e Protesi Dentaria, il Corso di Laurea Specialistica in Medicina e Chirurgia e il Corso di Laurea in Igiene Dentale dell’Università degli Studi di Bari, ricoprendo i seguenti incarichi: Presidente del Corso di Laurea Specialistica in Odontoiatria e Protesi Dentaria presso l’Università degli Studi di Bari; Direttore del Corso di Perfezionamento in Medicina Orale I e II livello presso l’Università degli Studi di Bari; Decano del Dipartimento di Odontostomatologia e Chirurgia dell’Università degli Studi di Bari; Primario dell’Unità Operativa Complessa di Odontoiatria presso l’azienda ospedaliera “Ospedale Policlinico Consorziale” di Bari.
Laurea in Medicina e Chirurgia nel 1981, specializzazione in Odontostomatologia nel 1984, ricercatore dal 1992 al 1997 presso l’Università degli Studi di Napoli, dal 1997 a febbraio 2006 è Professore Ordinario presso l’Università degli Studi di Bari e titolare della cattedra di Clinica Odontostomatologica presso il Corso di Laurea Specialistica in Odontoiatria e Protesi Dentaria, il Corso di Laurea Specialistica in Medicina e Chirurgia e il Corso di Laurea in Igiene Dentale dell’Università degli Studi di Bari, ricoprendo i seguenti incarichi: Presidente del Corso di Laurea Specialistica in Odontoiatria e Protesi Dentaria presso l’Università degli Studi di Bari; Direttore del Corso di Perfezionamento in Medicina Orale I e II livello presso l’Università degli Studi di Bari; Decano del Dipartimento di Odontostomatologia e Chirurgia dell’Università degli Studi di Bari; Primario dell’Unità Operativa Complessa di Odontoiatria presso l’azienda ospedaliera “Ospedale Policlinico Consorziale” di Bari.
Sin dall’inizio della sua carriera si è sempre dedicato alla Patologia e alla Medicina Orale. Tra il 1992 e il 1997 ha svolto attività clinica in qualità di Ricercatore Universitario presso l’Università degli Studi di Napoli Federico II e poi presso la Seconda Università degli Studi di Napoli.
Ha attivato a Bari, nel 1997, il Modulo di “Diagnosi Cura e Prevenzione delle Patologie delle mucose orali”, dirigendo l’attività clinica fino al febbraio 2006, ricoprendo le funzioni primariali presso la Clinica Odontoiatrica dell’Ospedale Policlinico di Bari.
Autore di oltre 200 pubblicazioni scientifiche su riviste nazionali e internazionali con Impact Factor e di quattro libri di testo. Gli ambiti di ricerca predominanti riguardano la diagnosi e la terapia delle patologie della mucose orale e la ricerca di biomarker tissutali e sierici del carcinoma del cavo orale. Responsabile scientifico di diversi progetti di ateneo (“ex 60%”) e componente di progetti PRIN sovvenzionati dal Ministero dell’Università e Ricerca.
Relatore su invito a numerosi congressi nazionali e internazionali. Membro del consiglio direttivo della Società Italiana di Patologia e Medicina Orale. Socio Onorario della Accademia di Studi e Ricerche di Odontostomatologia e Prevenzione Odontostomatologica.
Granuli di Fordyce
In circa l’80% degli individui si osservano sulla mucosa orale dei piccoli granuli giallastri. Sono ghiandole sebacee che non hanno alcun significato patologico2. Il bordo vermiglio delle labbra, la mucosa vestibolare e più raramente la zona retromolare sono le sedi più frequenti (Figura 1).
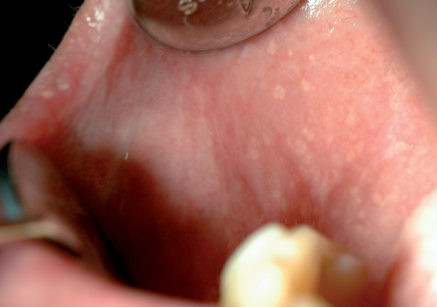
Non danno alcun sintomo con l’eccezione di una sensazione di mucosa ruvida. Spesso vengono confuse con un’infezione fungina. Non è indicato alcun trattamento; in casi particolari di granuli di Fordyce particolarmente evidenti sul bordo vermiglio labiale può essere indicato un trattamento di fotoablazione laser o un prelievo bioptico nel caso in cui il paziente sia cancerofobico. Interessante è l’associazione tra sindrome di Lynch (sindrome carcinomatosa non poliposica colon-rettale) e i granuli di Fordyce che evidenzierebbe l’attivazione di un pathway responsabile tanto dello sviluppo della neoplasia quanto dell’attivazione del sistema della ghiandole sebacee3.
Leucoedema
Il leucoedema è caratterizzato da un aspetto bianco opalescente della mucosa vestibolare (Figura 2). Le cause sono sconosciute. È molto comune nelle popolazioni di colore (90% degli individui) e di più raro riscontro nella popolazione bianca. Non è considerato una vera e propria lesione, bensì una variante dell’anatomia normale della mucosa orale. Il leucoedema è sempre bilaterale e conferisce alla mucosa vestibolare un caratteristico aspetto grinzoso4.
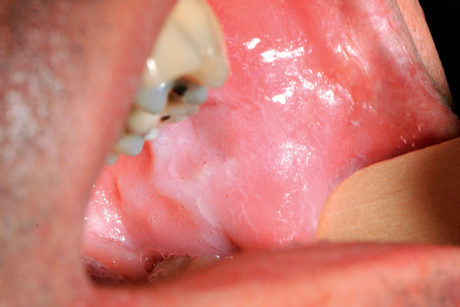
Una peculiarità del leucoedema, che ne permette la diagnosi differenziale, è che scompare quando la guancia viene stirata verso l’esterno per poi ricomparire dopo il rilascio (fenomeno diascopico). Il leucoedema non necessita di alcun trattamento5.
 (DDS,PhD), Ricercatore Universitario presso l’Università degli Studi di Bari “Aldo Moro”. Docente di Malattie Odontostomatologiche presso i corsi di Laurea Magistrale in Odontoiatria, Specializzazione in Chirurgia Maxillo-Facciale, Master Universitari e corsi di Perfezionamento. Conseguito il Ph.D nel 2004, si è successivamente specializzato in Chirurgia odontostomatologica e Perfezionato in Patologia e Medicina Orale. Socio attivo della Società Italiana di Patologia e Medicina Orale (SIPMO), ha al suo attivo numerose pubblicazioni internazionali e progetti di ricerca con importanti istituzioni italiane ed estere. L’attività clinico-assistenziale è svolta presso la clinica odontoiatrica del Policlinico di Bari presso l’ambulatorio di Patologia e Medicina Orale.
(DDS,PhD), Ricercatore Universitario presso l’Università degli Studi di Bari “Aldo Moro”. Docente di Malattie Odontostomatologiche presso i corsi di Laurea Magistrale in Odontoiatria, Specializzazione in Chirurgia Maxillo-Facciale, Master Universitari e corsi di Perfezionamento. Conseguito il Ph.D nel 2004, si è successivamente specializzato in Chirurgia odontostomatologica e Perfezionato in Patologia e Medicina Orale. Socio attivo della Società Italiana di Patologia e Medicina Orale (SIPMO), ha al suo attivo numerose pubblicazioni internazionali e progetti di ricerca con importanti istituzioni italiane ed estere. L’attività clinico-assistenziale è svolta presso la clinica odontoiatrica del Policlinico di Bari presso l’ambulatorio di Patologia e Medicina Orale.
Nevo bianco spugnoso
È una rara genodermatosi che viene trasmessa per via autosomica dominante con alta penetranza. In genere compare fin dalla nascita. Si presenta come una placca bianca di aspetto vellutato o villoso sulla mucosa vestibolare di entrambi i lati (Figura 3). La lesione si estende spesso alla lingua, al pavimento e alla mucosa oro-faringea. Potrebbe necessitare di rimozione chirurgica in caso di discomfort orale6.
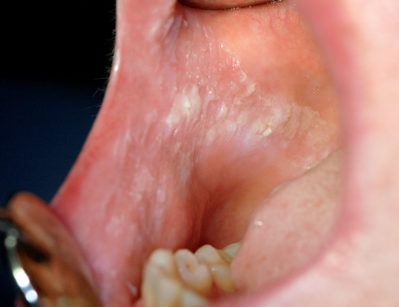
Lingua fissurata (lingua scrotale)
La lingua fissurata è molto comune e verosimilmente ha un’origine ereditaria. Circa il 2-5% della popolazione ne è affetta e si osserva più frequentemente negli individui adulti. Il dorso e i margini linguali presentano delle fissurazioni di profondità e dimensioni variabili7. Alcuni pazienti presentano una sola profonda fissurazione centrale (Figura 4), altri mostrano numerose fissurazioni disposte a raggiera configurando quadri cerebriformi o di tipo scrotale o a gheriglio di noce (Figura 5). Spesso la lingua scrotale è associata con la lingua a carta geografica; in questi casi le fissurazioni si accompagnano ad aree superficiali di eritema circondate da un cercine biancastro.
La lingua fissurata è in genere asintomatica, sebbene in alcuni pazienti possa causare bruciore o dolore specie durante l’assunzione di alimenti piccanti in quanto favorisce il ristagno di cibo e la proliferazione di flora batterica. È importante ricordare che la lingua scrotale rientra nella determinazione della sindrome di Melkerson-Rosenthal (granulomatosi oro-facciale) e può sovente riscontrarsi nei pazienti affetti da sindrome di Down8.
Lingua a carta geografica (glossite migrante, eritema migrante)
È un’affezione benigna che in genere si osserva sulla lingua e raramente sulla mucosa vestibolare. Si rileva nell’1-3% della popolazione sana senza una netta preferenza di sesso.
L’eziopatogenesi rimane del tutto sconosciuta9. Risulta comunque inficiato il meccanismo che regola la sincronizzazione della fisiologica desquamazione cellulare con persistenza di aree ipermature (bianche) associate ad aree ipomature (rosse). In alcuni individui è possibile che vi sia una ipersensibilità verso cibi o altre sostanze ambientali.
Da alcuni autori la lingua a carta geografica è stata messa in relazione con il diabete giovanile, la psoriasi o, nella donna, con le alterazioni ormonali del ciclo mestruale, ma queste associazioni non sono state mai definitivamente confermate.
Può comparire a tutte le età, anche nei bambini (Figura 6) e negli individui anziani. Le lesioni hanno l’aspetto di aree eritematose circondate da un caratteristico cercine biancastro sui due terzi anteriori della lingua (Figura 7). Caratteristicamente le lesioni tendono a regredire spontaneamente per poi ricomparire nel giro di giorni o settimane. Nella maggior parte dei pazienti le lesioni sono asintomatiche; in altri casi vi può essere bruciore e/o irritazione causati specialmente dai cibi piccanti o caldi a contatto con le aree disepitelizzate. In alcuni soggetti la lingua a carta geografica può essere causa di imbarazzo o non accettazione, talvolta esitante in vera e propria fobia sociale. Importante è rassicurare il paziente circa l’assoluta benignità della lesione10.
Lingua bianca villosa e lingua nigra villosa
La lingua bianca villosa (Figura 8) è caratterizzata da una marcata ipertrofia delle papille filiformi. La patogenesi è verosimilmente legata a un’eccessiva produzione di cheratina. Altri possibili cofattori sono il fumo eccessivo, la scarsa igiene orale, lo squilibrio della flora batterica11. Non di rado tale condizione si osserva dopo una antibiotico-terapia più o meno prolungata.
L’aspetto della lesione è di una patina villosa che ricopre il dorso linguale nella sua porzione media e anteriore alle papille circumvallate. Il colore delle papille è in genere bianco, ma spesso presenta una colorazione giallo-nerastra più o meno intensa. Il colore nerastro è dovuto alla produzione di pigmenti batterici o, nei fumatori, al deposito di derivati nicotinici (Figura 9): in questo caso è stata denominata lingua nera villosa. In alcuni pazienti le papille filiformi sono talmente lunghe da dare una fastidiosa sensazione di solletico al palato molle (lingua capelluta). La lingua villosa può determinare una certa apprensione nel paziente a causa del suo aspetto sgradevole. Può associarsi a un’infezione micotica. È utile consigliare la sospensione del fumo, un’accurata igiene orale e lo spazzolamento del dorso linguale per facilitare l’eliminazione dei detriti e l’eccesso di materiale corneificato12.
Iperplasia delle fimbrie linguali
Le fimbrie linguali sono delle strutture anatomiche normali che appaiono come delle piccole estroflessioni filiformi sul ventre linguale ai lati del frenulo (Figura 10). Nel caso di una loro iperplasia si può essere facilmente indotti in errori diagnostici. Comune è la confusione con papillomi squamosi o condilomi13.
Ghirlande di McCall
Inspessimenti fibrosi della gengiva marginale vestibolare. Le possibili cause sono da ricercare in una tecnica di spazzolamento scorretta o nel sovraccarico occlusale (Figura 11).
Fessure di Stillman
Sono delle minute fessurazioni a forme di “V” che si estendono dal margine della gengiva fino alla corona del dente interessato. Le cause di tali fessurazioni sono: trauma dentale, apparecchi ortodontici mal posizionati, uso improprio dello spazzolino, anomalie anatomiche del dente.
Il ripristino di una corretta tecnica di spazzolamento, la correzione del difetto ortodontico o il molaggio dell’anomalia anatomica garantisce la restitutio ad integrum14.
Perle di Epstein o cisti gengivali del neonato
Sono dei noduli di colorito variante dal bianco al giallastro comuni in circa l’80% dei neonati.
Appaiono sulle gengive o sul pavimento orale, e possono essere confuse con un dente in eruzione. Scompaiono spontaneamente dopo 1 o 2 settimane dalla nascita. Una classificazione topografica prevede che vengano definiti come noduli di Bohn se presenti sulla gengiva, mentre il termine di perle di Epstein sarebbe da riservare solo se presenti lungo la linea mediana palatina.
Sono comunque vestigia della lamina dentaria embrionale15.
Iperplasia mammellonata del dotto dello Stenone
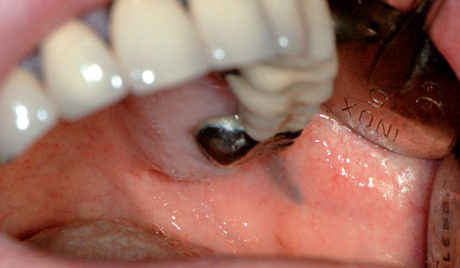
Lo sbocco del dotto di Stenone nel cavo orale è allocato sulla mucosa geniena, prospiciente la superficie vestibolare del primo o secondo molare superiore. Un’iperplasia dell’ultima porzione del dotto dello Stenone, per cause traumatiche o per una scialodochite, può causare un aumento di volume del dotto stesso.
Esso diviene visibile e apprezzabile assumendo le sembianze di un minuto fibroma. Il mancato riconoscimento della struttura anatomica ghiandolare potrebbe causare un’inutile biopsia con danni alle strutture ghiandolari.
Tiroide linguale
La persistenza di tessuto tiroideo a livello del terzo posteriore del dorso linguale si manifesta clinicamente con l’aspetto di una tumefazione denominata tiroide linguale16. Tale anomalia embriogenetica è dovuta a un difetto che si verifica durante la migrazione della ghiandola dalla cavità faringea primitiva fino alla sua normale posizione anatomica al davanti della laringe. Se asintomatica, la tiroide linguale non necessita di alcun trattamento; quando necessaria, la terapia si basa sulla somministrazione di ormoni tiroidei a scopo soppressivo. L’ablazione chirurgica o con iodio radioattivo è riservata ai casi non responsivi alla terapia medica17.
Lesioni pigmentate della mucosa orale
Nella cavità orale si osserva un’ampia varietà di lesioni pigmentate, che possono essere causate da aumento della produzione di melanina o del numero dei melanociti. Il deposito localizzato di melanina dà origine alla cosiddetta macula, mentre la proliferazione benigna o maligna dei melanociti dà origine, rispettivamente, ai nevi o al melanoma18. Le lesioni pigmentate della mucosa orale possono derivare anche dal deposito di sostanze esogene introdotte accidentalmente come avviene, per esempio, nel caso del tatuaggio da amalgama (Figura 12) o da grafite. Alcune condizioni fisiologiche come la gravidanza (melasma gravidico) possono dare iperpigmentazione sia della cute sia della mucosa orale19. Iperpigmentazione melaninica si può osservare in condizioni fisiologiche in individui di colore o dalla carnagione scura specie nei settori anteriori dell’arcata gengivale inferiore. Quadri patologici sistemici come il morbo di Addison o la sindrome di Peutz-Jeghers (Figura 13) possono manifestarsi con pigmentazioni orali20.
Macula melanotica
Consiste in un’area pigmentata della mucosa orale causata da un deposito localizzato di melanina senza aumento del numero dei melanociti.
Le macule melaniniche, sebbene si possano osservare a tutte le età, mostrano una preferenza per la fascia tra i 40 e i 50 anni e per il sesso femminile.
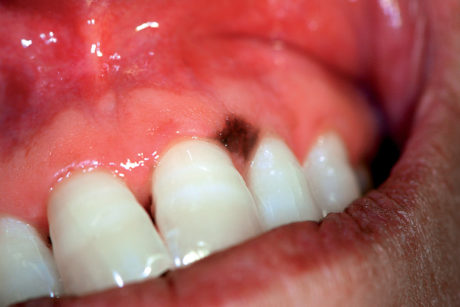
Il colore della macula può variare dal marrone al nero e il suo diametro, in genere, non supera i 7-8 mm (Figura 14).
Le lesioni sono solitarie o multiple con margini ben demarcati. La biopsia della macula melaninica è in genere necessaria per confermare la diagnosi clinica21.
La macula melanotica deve essere distinta dal melanoacantoma (molto raro), in cui i melanociti presentano un cospicuo sviluppo dei loro dendriti che si insinuano tra le cellule epiteliali, dai nevi e dal melanoma22.
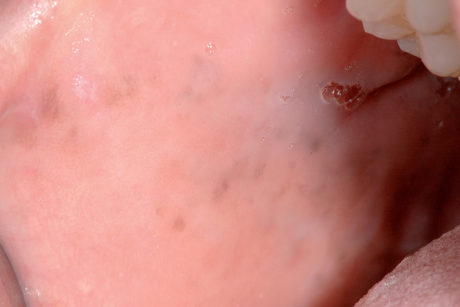
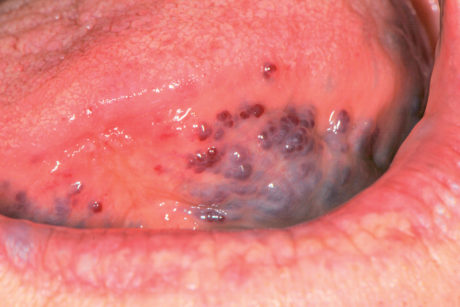
Melanosi associata al trauma o all’irritazione cronica
La melanosi della mucosa orale, in taluni soggetti predisposti, si può osservare come conseguenza di un traumatismo cronico (morsicatio) della mucosa orale (Figura 15).
Nei soggetti forti fumatori di sigarette o pipa si può sviluppare un’iperpigmentazione diffusa della mucosa orale causata dall’irritazione cronica dovuta ai componenti del fumo e al calore. Le zone di mucosa più colpite sono la gengiva, la mucosa vestibolare e il palato (Figura 16). L’aspetto microscopico delle lesioni è sovrapponibile a quello della macula23. Nel lichen planus erosivo si possono osservare melanosi come esito del processo autoimmune-infiammatorio (Figura 17)24.
Nevo
I nevi sono proliferazioni benigne di cellule neviche situate nell’epitelio e nello stroma della mucosa orale (Figura 18). Possono essere considerati come amartomi piuttosto che vere e proprie neoplasie. Gli adulti bianchi hanno 10-40 nevi cutanei in media, ma le lesioni intraorali sono piuttosto rare.
La classificazione istologica dei nevi prevede 3 categorie: il nevo giunzionale è caratterizzato da cellule neviche limitate allo strato cellulare basale dell’epitelio; nel nevo composto, le cellule sono localizzate nell’epitelio e nel chorion; nel caso del nevo intradermico (o meglio intramucoso), i nidi di cellule neviche sono immerse nella sottomucosa. I nevi possono essere anche classificati come congeniti o acquisiti18,19.
Melanoma orale
La prima descrizione di un melanoma della mucosa orale risale a Weber nel 1859. L’età di maggior incidenza è tra i 40 e i 60 anni (45%). Il 75% dei casi colpisce il palato duro, seguono la gengiva mascellare, la lingua e il pavimento orale.
Una pigmentazione preesistente, asintomatica, si osserva in circa un terzo dei casi, potendo precedere la neoplasia franca nodulare da 4 a 20 anni25. Certamente l’esame bioptico va praticato sulle lesioni di recente insorgenza o che mostrino delle modificazioni morfologiche. Il melanoma è in genere asintomatico e piccoli episodi emorragici rappresentano la sintomatologia premonitrice.
La lesione maculare, lentigginosa, singola o multipla è molto simile alla melanosi orale (Figura 19). Segue per molti anni una crescita orizzontale, con lieve e progressivo ispessimento (fase di placca) che può indurre una perdita degli elementi dentari o una loro dislocazione. La fase di placca e quella di nodulo sono ritenute espressione di crescita verticale. In alcuni casi la trasformazione a placca e a nodulo è repentina. Il melanoma si presenta come una rilevatezza nera o blu, spesso con lesioni satellitari26. La diagnosi è talvolta difficile, perché in una percentuale dal 5 al 15% il nodulo è acromico o rosa. Nelle fasi avanzate il nodulo può ulcerarsi, sanguinare e diventare doloroso. Una caratteristica clinica del melanoma mucosale è l’elevata incidenza delle recidive dopo l’asportazione. Le metastasi sono anch’esse frequenti ai linfonodi sottomascellari e giugulari, al polmone e al fegato27.
Malattie reattivo-traumatiche
I tessuti orali, per evidenti ragioni anatomiche, sono esposti a continui insulti traumatici e flogistici. Le zone più soggette a trauma sono la lingua, il palato, la mucosa vestibolare e i tessuti parodontali. Le lesioni reattive a carico del parodonto originano dalle varie componenti che contribuiscono a formare l’apparato di sostegno del dente. Altre lesioni di tipo reattivo e iperplastico vengono causate dalla somministrazione di farmaci come gli antiepilettici, la ciclosporina e i calcio-inibitori.
Fibroma (fibroma traumatico o irritativo)
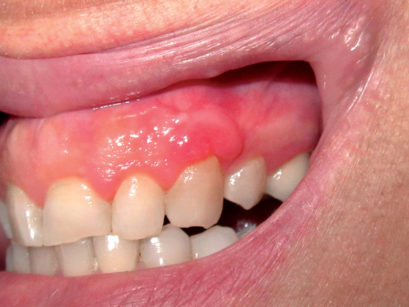
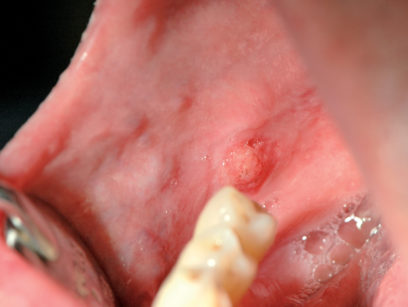
È una delle lesioni più comuni della mucosa orale e consiste in un’iperplasia reattiva del tessuto connettivo causata da un’irritazione traumatica cronica. Clinicamente si presenta come una neoformazione rilevata di dimensioni variabili, di superficie liscia e colorito roseo o bianco (Figura 20). La superficie biancastra è il risultato di un’ipercheratosi dovuta al traumatismo. Le lesioni possono essere sessili o peduncolate. La sede più comune è la mucosa vestibolare (lungo la linea occlusale) seguita da lingua, gengiva e palato. Nella maggioranza dei casi la lesione è asintomatica. Le dimensioni delle lesioni possono variare da pochi millimetri fino a diversi centimetri di diametro. La terapia consiste nell’escissione chirurgica. Se persiste l’irritazione cronica si osserva una recidiva28.
Iperplasia papillare del palato
Questa lesione si sviluppa a livello della volta del palato in pazienti portatori di protesi totale eccessivamente mobile (Figura 21). Il traumatismo causa una reazione iperplastica dell’epitelio con formazione di piccole escrescenze epiteliali29. Fattori predisponenti aggiuntivi sono la scarsa igiene e il fatto che il paziente porti la protesi anche di notte. Circa il 20% dei pazienti portatori di protesi sviluppa questa particolare condizione, che comunque si osserva talvolta anche in soggetti non portatori di protesi, soprattutto in quelli con volta palatina molto alta.
La Candida albicans è stata chiamata in causa come un possibile fattore eziologico, ma il suo ruolo rimane incerto (promotore o saprofita)30.
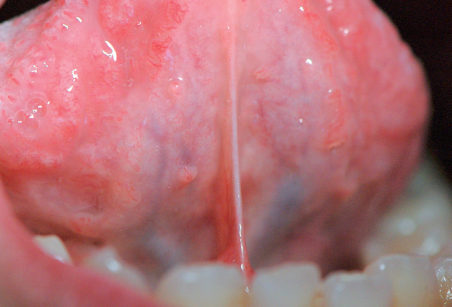
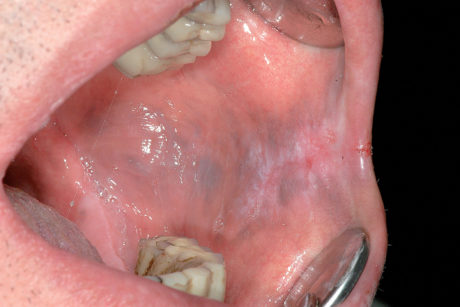
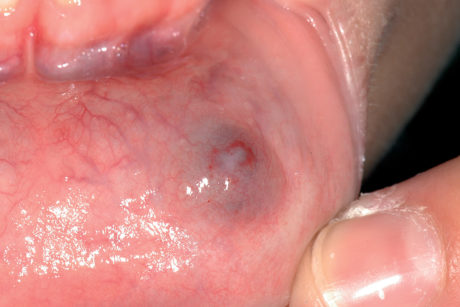
Cisti da stravaso mucoso (mucocele)
Questa lesione è molto comune nei bambini e nei giovani adulti dai 10 ai 30 anni, ma si può comunque osservare in tutte le età. L’eziopatogenesi è relativa a una rottura traumatica del dotto escretore di una ghiandola salivare accessoria con conseguente stravaso del muco nella sottomucosa. La presenza del muco nel tessuto connettivo induce una reazione da corpo estraneo con il richiamo di neutrofili e macrofagi31. La sede più frequente è il labbro inferiore (60-70% di casi), ma le lesioni si possono osservare anche sulla mucosa vestibolare, sul ventre linguale, sul pavimento e sul trigono retromolare. La lesione consiste in una tumefazione a forma di cupola di consistenza teso-elastica che appare improvvisamente e tende a crescere rapidamente (Figura 22a).
Il colore è roseo o bluastro. Frequentemente le cisti da stravaso mucoso per via del colore vengono confuse con gli emangiomi32. Se non escissa, la cisti da stravaso può durare diverse settimane o mesi con un comportamento caratterizzato da periodica regressione seguita da recidiva o da rottura spontanea con emissione di un fluido mucoso filante (Figura 22b).
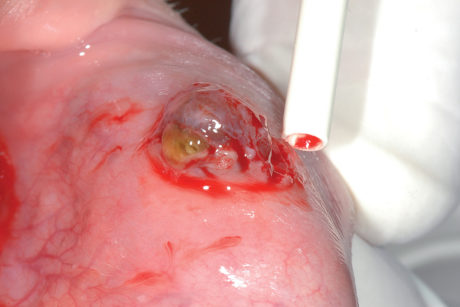
Esiste una variante chiamata mucocele superficiale che si sviluppa con maggiore frequenza nel palato molle e nella zona retromolare. Il mucocele superficiale, che assume l’aspetto di una piccola bolla di 1-4 mm di diametro, può essere confuso con facilità per una malattia vescico-bollosa come il pemfigoide delle membrane mucose.
La patogenesi del mucocele superficiale è legata a uno stravaso di muco nella parte alta della lamina propria che crea un sollevamento e un distacco della lamina epiteliale. Alcune cisti da stravaso vanno incontro a un processo spontaneo di regressione. Nella maggioranza dei casi si rende comunque necessaria l’escissione chirurgica in toto della lesione che deve includere anche le ghiandole salivari adiacenti per evitare la recidiva33.
Linea alba e cheratosi da morsicatio buccarum
Il traumatismo cronico determina una varietà di lesioni mucose che talvolta possono dare problemi di diagnosi differenziale. La linea alba è un’alterazione della mucosa vestibolare che si osserva, quasi sempre bilateralmente, all’altezza della linea occlusale (Figura 23). È in genere relativa a una cattiva occlusione che determina lo sfregamento e la pinzatura della mucosa tra le superfici masticatorie dei denti. Clinicamente la linea alba si presenta come un tratto lineare orizzontale continuo, talvolta con festonature, che si estende in senso antero-posteriore lungo la linea occlusale della mucosa vestibolare e il labbro inferiore.
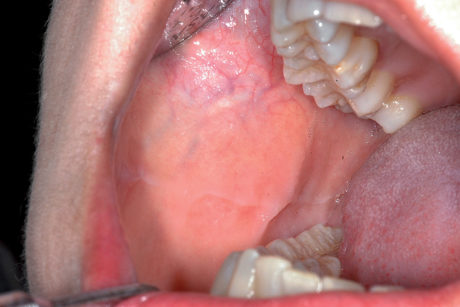
Spesso si osserva l’impronta della corona dei denti specie nei settori posteriori. In genere non è necessario eseguire una biopsia, se non in caso di dubbio diagnostico. Nella morsicatio buccarum le lesioni sono più estese e coinvolgono ampie zone della mucosa vestibolare lungo la linea occlusale, le labbra e la lingua (Figura 24). La morsicatio è legata, oltre che al trauma occlusale, anche a una suzione della guancia che i pazienti, spesso sotto stress, attuano involontariamente.
L’aspetto clinico è di placche bianche multiple, di aspetto squamoso e spugnoso, che si alternano ad aree rosse ulcerate.
La mucosa interessata presenta fenomeni di desquamazione con distacco di ampi lembi. Al microscopio si osservano una spiccata iperparacheratosi con propaggini di cheratina e colonie batteriche sulla superficie34.
Ulcere traumatiche
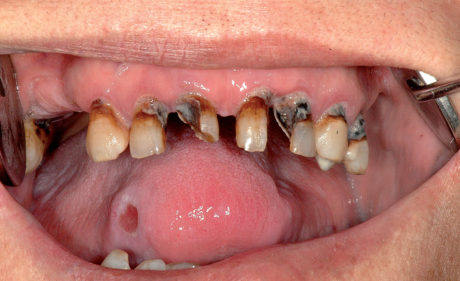
Le ulcere traumatiche della mucosa orale sono molto frequenti e possono essere causate da particelle di cibo taglienti, dal trauma della masticazione e dallo spazzolamento dei denti. Di comune osservazione sono le ulcere orali (specie sulla lingua) dovute a denti con corone danneggiate o fratturate (Figura 25). Le sedi più frequenti sono la lingua, le labbra e la mucosa vestibolare35. L’aspetto clinico è di ulcere con bordi piani o rilevati con una superficie granulare giallastra ricoperta da pseudomembrane. Tutte le ulcere traumatiche, quando vengono identificate ed eliminate le cause, guariscono rapidamente nel giro di 7-10 giorni. Le ulcere che persistono al di là di questo periodo devono essere guardate con sospetto e, obbligatoriamente, devono essere sottoposte a biopsia36.
Malformazioni e neoplasie benigne delle parti molli
Emangiomi e malformazioni vascolari
Gli emangiomi sono proliferazioni benigne di vasi che si osservano nei neonati e in giovani adulti. La maggioranza degli emangiomi è considerata di origine malformativa.
Molti emangiomi non sono presenti al momento della nascita, ma appaiono durante le prime 7-8 settimane di vita. Sono caratterizzati da una fase di rapida crescita, dovuta alla proliferazione delle cellule endoteliali, che viene seguita in taluni casi da una fase di regressione spontanea.
Le malformazioni vascolari sono un gruppo molto eterogeneo di patologie potendo interessare tanto i vasi linfatici, i capillari, le vene e le arterie. Le malformazioni vascolari vengono classificate in base al vaso aberrante che le compone e si distinguono, pertanto, malformazioni linfatiche, capillari, venose e arteriose. Esempi sono la sindrome di Sturge Weber, le wine stains e i linfangiomi (Figura 26).
La presentazione clinica è estremamente variabile e diversa per ogni tipo di malformazione37. Le alterazioni vascolari vengono suddivise, in base al tipo di vaso sanguigno coinvolto, in malformazioni capillari, arteriose e venose.
Gli emangiomi sono tra le neoplasie benigne più frequenti nei bambini; si osservano, soprattutto sulla cute, nel 5-10% dei bambini entro il primo anno di età con una preferenza per il sesso femminile (rapporto M:F=1:3).
Nel 60% dei casi si sviluppano a livello dell’area testa-collo. Nella cavità orale gli emangiomi non sono rari e le sedi preferenziali sono la mucosa vestibolare, la lingua e il labbro inferiore (Figura 27). Clinicamente hanno l’aspetto di lesioni rilevate di colore rosso porpora o vinoso, che con la compressione tendono parzialmente a scomparire.
Nel trattamento è utile l’impiego del laser (Figure 28a-28b)38. Nelle forme intraossee, dove il rischio emorragico è molto alto, viene impiegata l’embolizzazione mediante sonde vascolari cui segue la resezione chirurgica.
Varici orali
Le varici sono delle dilatazioni localizzate di vasi venosi che si sviluppano nella cavità orale dei pazienti anziani.
Si osservano soprattutto sopra i 60 anni, specie sul ventre linguale, le labbra e la mucosa vestibolare (Figura 29).
Hanno l’aspetto di noduli di colore blu scuro, di consistenza molle o, se trombizzati, dura.
Le varici orali non richiedono in genere alcun trattamento39.
Candidosi orale
La Candida è un organismo dimorfico che esiste sia in forma blastosporica che in forma pseudoifale o miceliale.
Sebbene colonizzi la sola superficie mucocutanea, le forme ifali e miceliali possono portarsi nei tessuti profondi, quando le difese dell’ospite sono compromesse.
Sette sono le specie di Candida più frequentemente isolate (più dell’80% dei casi) che rivestono importanza clinica: albicans, tropicalis e glabrata, parapsilosis, stellatoidea, guilliermondii, krusei, pseutropicalis40.
La Candida dubliniensis ha invece la caratteristica di essere fenotipicamente indistinguibile dalla albicans, ma di possedere caratteristiche genotipiche proprie.
La dubliniensis fu isolata per la prima volta nel cavo orale di un paziente HIV positivo irlandese, ma in seguito anche in soggetti immunodepressi farmacologicamente o a causa della radioterapia.
L’identificazione della dubliniensis ha giustificato, in senso retrospettivo, l’antimicotico-resistenza dei pazienti HIV positivi che venivano trattati con farmaci antimicotici convenzionalmente utilizzati per le infezioni sostenute da Candida albicans41.
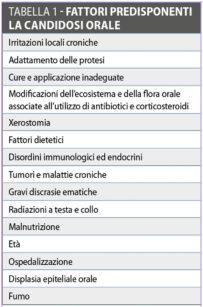
I maggiori fattori sistemici e locali che predispongono alla Candida sono riportati nella Tabella 142.
La quantità di lieviti presente nella saliva dei portatori di protesi totale è maggiore di quella che si rinviene nei soggetti non edentuli. I lieviti si osservano nel 78-100% dei pazienti con stomatite protesica43.
Tutte le forme di candidosi orale sono considerate opportunistiche, tanto che la patologia viene definita la “malattia del malato”.
È difficile trovare il preciso fattore che predispone alla malattia, nonostante si conducano indagini accurate.
La classificazione più frequentemente adottata suddivide le candidosi in44:
- acute (manifestazioni orali di candidosi muco cutanee, pseudomembranosa, eritematosa);
- croniche (eritematose, iperplastiche, a placche, nodulare; pseudomembranosa, raramente);
- lesioni associate alla Candida (stomatite protesica, cheilite angolare, glossite romboide mediana).
La candidosi orale pseudomembranosa45 è un’infezione acuta ma può durare anche alcuni mesi o addirittura anni in pazienti che usano corticosteroidi topici o in forma di aerosol, negli individui infetti da HIV e in altri pazienti immunocompromessi. È caratterizzata da chiazze bianche sulla mucosa orale e sulla lingua.
Le lesioni si sviluppano e formano placche simili a latte cagliato (Figura 30).
In seguito a loro spazzolatura si rileva una base grezza, eritematosa e talvolta emorragica.
La candidosi atrofica (eritematosa)46 è una condizione poco comune e poco conosciuta, associata all’uso di corticosteroidi e antibiotici topici e sistemici ad ampio spettro.
È comune nei pazienti affetti da HIV. Si presenta, clinicamente, con aree eritematose sul dorso di lingua, palato, mucosa orale (Figura 31).
Le lesioni sul dorso della lingua sono aree depapillate.
Sono state anche osservate aree rosse sul palato dei pazienti con AIDS. Può associarsi a essa una cheilite angolare.
La candidosi iperplastica (Candida leuocoplachia)47 è rappresentata da lesioni croniche, discrete e in rilievo che vanno da piccole, palpabili, traslucenti e biancastre a larghe, dense, opache, dure e ruvide al tatto (lesioni tipo placche).
Possono anche presentarsi, clinicamente, sotto forma di aree omogenee o maculate oppure non spatolabili. La Candida leucoplachica ha usualmente sede nella superficie interna di una o di entrambe le guance, del palato (Figura 32) e, meno frequentemente, sulla lingua.
La biopsia è importante perché la condizione è pre-tumorale e potrebbe mostrare gradi variabili di displasia. Numerosi autori convergono nell’affermare che l’iperplasia epiteliale è una reazione con finalità protettiva nei confronti dell’invasione della Candida. La displasia epiteliale è secondaria all’aumentata attività mitotica a seguito dell’infezione della Candida e all’azione locale della nitrosaminazione dei lieviti che dà luogo alla comparsa di cellule neoplastiche.
La stomatite protesica43 è caratterizzata da eritema cronico ed edema della mucosa a contatto con la protesi mobile (Figura 33). I pazienti possono provare un lieve dolore, ma usualmente è asintomatica. Può essere associata a cheilite angolare. La stomatite protesica, tuttavia, non è solo causata dalla Candida, ma anche da fattori batterici, irritazione meccanica, allergia al materiale di base della protesi.
La cheilite angolare interessa le commessure labiali ed è caratterizzata da assenza di dolore, eritema e fessurazione (Figura 34). È comunemente associata a stomatite protesica e sono coinvolti sia miceti che batteri (specialmente lo Stafilococcus aureus). Essa, occasionalmente, può costituire un sintomo iniziale di anemia o deficit di vitamina B12 e si risolve quando la malattia di base viene curata. L’anemia sideropenica e altri deficit vitaminici costituiscono, comunque, dei fattori predisponenti.
In condizioni non comuni come la granulomatosi oro-facciale, il 20% dei pazienti è affetto da stomatite angolare, sebbene le specie di Candida non siano sempre isolate. Le stomatiti angolari si possono osservare spesso nei soggetti HIV positivi48,49.
Le glossiti romboidi mediane o atrofie papillari centrali sono caratterizzate da un’area di atrofia papillare ellittica o romboidale, posta in modo simmetrico al centro della lingua, anteriormente alle papille circumvallate (Figura 35). Occasionalmente la glossite romboide mediana si presenta con aspetto iperplastico esofitico o lobulato.
La correlazione tra questa lesione e la Candida è controversa. Molti autori, però, sono convinti che sia la Candida a determinare l’atrofia papillare. È stato inoltre dimostrato che la condizione frequentemente mostra un mix di flora batterica e fungina50.
Infezioni da Herpes Simplex Virus (HSV)
Si manifestano frequentemente, con eruzioni vescicolari a carico di cute e mucose, secondo due modalità: la malattia sistemica o primaria e la forma localizzata o secondaria. Entrambe sono autolimitantesi, ma le forme secondarie vanno frequentemente incontro a recidive a causa del neurotropismo del virus. Il contagio si ha tramite contatto fisico con soggetti affetti ma anche con la saliva e il contatto indiretto. Al termine di un periodo di incubazione di massimo 2 settimane o si ha un decorso subclinico (nella maggior parte dei casi) o compare un rash vescicolo-bolloso su tessuti orali e periorali (gengivostomatite erpetica primaria)51. In seguito alla risoluzione di questa fase (2-3 settimane), il virus migra in senso centrifugo lungo le guaine nervose del trigemino, fino al ganglio di Gasser, dove rimane quiescente. La riattivazione, ove si verifichi, può conseguire stati debilitanti come trapianti, esposizione a radiazioni, traumi, stress, immunodepressione in generale. Quando viene riattivato, il virus scende lungo il nervo trigemino, fino alla superficie epiteliale originariamente infettata, causando manifestazioni più localizzate, probabilmente grazie al sistema immunitario umorale e cellulo-mediato, precedentemente sensibilizzati dall’antigene HSV. Nel periodo di latenza l’HSV I rimane nel ganglio di Gasser e l’HSV II, invece, in quelli lombosacrali2. All’HSV I si deve la maggior parte delle lesioni oro-facciali (e in minima parte quelle genitali) mentre all’HSV II si devono per lo più le lesioni genitali. Comunque è stato dimostrato che una pregressa infezione da HSV I fornisce una certa protezione dal contagio con HSV II, per un meccanismo di reattività incrociata degli anticorpi52.
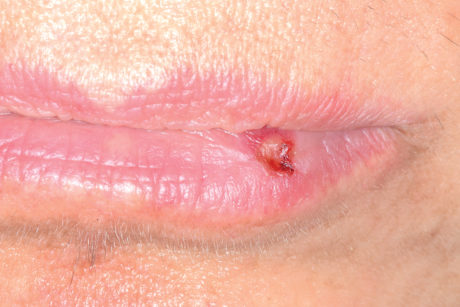
La gengivostomatite erpetica è sintomatica solo nel 10% dei soggetti infettati (prevalentemente bambini). In tal caso si ha dapprima la comparsa di sintomatologia aspecifica (febbre, astenia, cefalee, artralgie, linfoadenopatia regionale, malessere generale) e poi di lesioni mucose multiple di tipo vescicolare, sparse o raccolte in grappoli, che interessano qualsiasi area del cavo orale (in particolare le gengive) e che si accompagnano a dolore, fetor ex ore e scialorrea riflessa.
Conseguenze: disfagia, disidratazione ed eventuale autoinoculo del virus a livello oculare, determinando congiuntiviti e cheratiti.
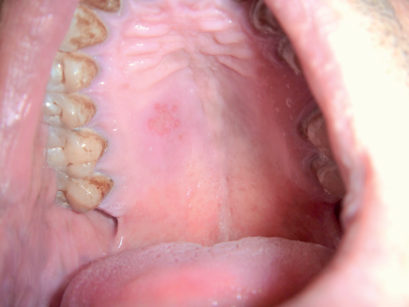
Le stomatiti erpetiche secondarie, invece, si manifestano con prodromi quali calore o bruciore, dolore puntorio o prurito e successivamente, se a essere interessato è il ganglio genicolato, con una paralisi facciale di Bell. Tra le sedi orali prevalentemente coinvolte troviamo le labbra e, in particolare, il sito di inoculo del virus (Figure 36, 37). La lesione è sempre di tipo vescicolare (eventualmente confluente), con evoluzione pustolosa in erosioni o ulcere a contorni irregolari, siero-gementi e, successivamente, in croste. Queste cadono senza lasciare cicatrici53.
Malattie autoimmuni
Aftosi orale
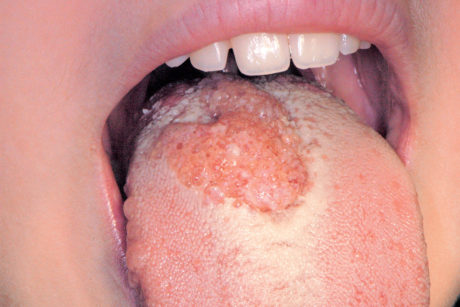
Le afte54 sono lesioni ulcerative orali non sanguinanti piuttosto comuni che colpiscono circa il 10% della popolazione. L’eziologia della stomatite aftosa è sconosciuta, ma secondo una crescente evidenza il suo sviluppo è supportato da un processo con coinvolgimento immunitario che causa l’ulcerazione della mucosa orale coinvolta. Le ulcere aftose sono di solito classificate clinicamente in tre diverse tipologie: major, minor ed erpetiformi. Le afte minor (Figura 38) sono generalmente situate sulla mucosa labiale o buccale, sul palato molle, sul pavimento della bocca, sulla superficie ventrale e sul bordo della lingua. Possono essere uniche o multiple, superficiali con un diametro inferiore a 1 cm. Le afte erpetiformi sono rare e il loro aspetto clinico è simile a quello delle vescicole erpetiche (Figura 39).
Le afte major sono simili alle afte minor ma di maggiori dimensioni (possono raggiungere diametri superiori a 1 cm) e causano ulcerazioni più profonde (Figura 40); questo sottotipo rappresenta circa il 10% di tutti i casi di stomatite aftosa. Le afte colpiscono superfici mucose non cheratinizzate. Le afte major possono persistere per diversi giorni o settimane e spesso guarire con cicatrici. Il dolore associato alle lesioni aftose può influenzare il mangiare, il parlare e le pratiche di igiene orale. Una terapia definitiva della stomatite aftosa non è a tutt’oggi disponibile, anche perché la sua eziologia rimane sconosciuta55. Il trattamento consiste nel governare i sintomi e nel diminuire le fasi di riaccensione della malattia. La scelta terapeutica dipende dalla gravità delle afte che viene valutata in base alla frequenza delle ulcere, al numero, alla loro ubicazione, alla durata e al livello di dolore oro-facciale associato. Vi sono casi caratterizzati da dolore, febbre, disfagia che richiedono una terapia sistemica mentre altri possono essere gestiti con minimi accorgimenti e terapie locali. Dalla letteratura scientifica si evince che diversi farmaci sistemici sono stati utilizzati per trattare le afte, compresi i corticosteroidi sistemici, dapsone, colchicina, talidomide, pentossifillina, basse dosi di interferone-α e levamisolo. Iniezioni di steroidi intralesionali, contenenti betametasone dipropionato e betametasone sodio fosfato, in combinazione con il levamisolo, sono state proposte in caso di aftosi major56. Una recente revisione Cochrane sul trattamento sistemico per la stomatite aftosa ricorrente conclude che “nessun singolo trattamento è risultato efficace e quindi i risultati rimangono inconcludenti in riguardo al miglior intervento sistemico per le stomatiti aftose ricorrenti”57.
Eritema multiforme e sindrome di Stevens-Johnson
L’eritema multiforme è una patologia infiammatoria acuta a patogenesi immunitaria, che può interessare cute e/o mucose. La definizione multiforme è nata proprio per sottolineare la molteplicità di manifestazioni cliniche che la patologia può avere. L’eritema multiforme interessa di solito soggetti tra i 20 e i 40 anni ma anche i bambini, con una leggera prevalenza nel sesso maschile. Tra i fattori eziologici da prendere in esame ci sono gli agenti microbiologici (90%) (HSV I, VZV, CMV, EBV, Adenovirus, Coxsackie B5, Echovirus, HAV, HBV, HCV, Mycoplasma pneumoniae), additivi alimentari e agenti chimici (benzoati, nitrobenzeni, profumi e terpeni), farmaci (primi tra tutti i FANS, poi sulfonamidi, penicilline, barbiturici, fenitoina, carbamazepina, allopurinolo)58.
L’eritema multiforme può manifestarsi con una lesione cutanea classica, con o senza interessamento sistemico.
Nella sindrome di Stevens-Johnson, il coinvolgimento sistemico è severo e le lesioni sono estese anche alle mucose. La necrolisi epidermica tossica (NET o la sindrome di Lyell) si manifesta con grandi aggregati vescicolari confluenti a interessamento cutaneo e mucoso pressoché totale. Le lesioni multiple cutanee sono di solito simmetriche e pruriginose con esordio improvviso e decorso a gettate, e consistono in noduli, papule o macule, “lesioni a coccarda”, vescicole e bolle. Queste possono comparire su gambe (Figura 41), braccia, superfici palmari e plantari, volto e labbra (Figura 42) ed essere accompagnate da sintomi quali febbre, astenia e artralgia ma anche disturbi visivi, xeroftalmia, rossore, bruciore e dolore oculare. Il tronco di solito non è interessato59.
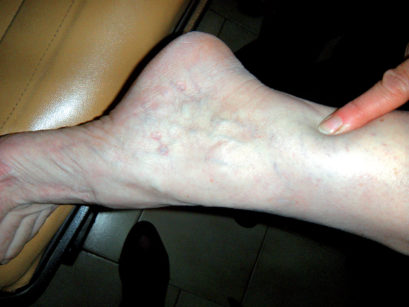
Forme miti di eritema multiforme si risolvono senza difficoltà in 2-6 settimane, ma si possono avere recidive (37%). Forme più severe possono essere difficili da trattare. La sindrome di Stevens-Johnson e la necrolisi epidermica tossica sono associate a un alto indice di mortalità. Sono inoltre possibili: lesioni cutanee permanenti, raramente polmoniti, miocarditi, nefriti, epatiti, celluliti, setticemia e shock ipovolemico60.
Pemfigo
Il pemfigo (dal greco πεμφιξ, pustola) è in realtà un gruppo di patologie a impronta autoimmune che coinvolge cute e/o mucose. I pazienti affetti sono adulti/anziani, sebbene siano state descritte forme neonatali causate dal passaggio transplacentare di IgG pemfigose materne. La malattia è causata da cloni autoanticorpali (per lo più IgG) che individuano come target la desmogleina 1 e/o la desmogleina 3, normali costituenti della placca desmosomiale61.
In base alla maggior percentuale di autoanticorpi anti desmogleina 1 o 3 si avrà la prevalenza di lesioni mucose e/o cutanee, come riportato in Tabella 2.
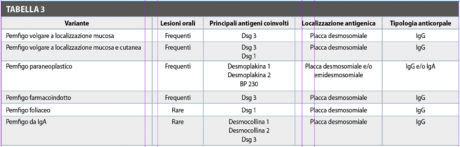
La perdita della connessione cellula-cellula dà luogo alla formazione di una vescicola intraepiteliale, molto fragile e ripiena di siero. In relazione alla presenza della vescicola negli strati epiteliali più superficiali o più profondi, è possibile distinguere forme di pemfigo ad acantolisi alta (pemfigo foliaceo e seborroico) e ad acantolisi bassa (volgare e vegetante).
Nell’acantolisi alta, il distacco epiteliale avviene tra gli strati più superficiali dello strato spinoso mentre nell’acantolisi bassa, il distacco avviene negli strati più profondi, quasi a ridosso di quello basale (Tabella 3).

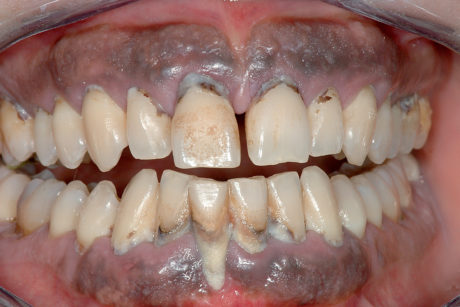
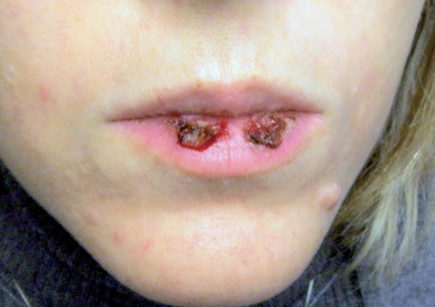
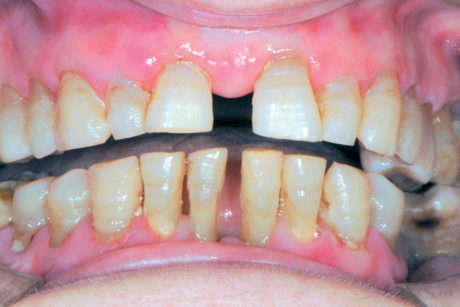
Il pemfigo volgare è la forma più comune di pemfigo ed è quella che più frequentemente (86,6% dei casi) provoca lesioni a livello orale (solo nel 40% dei casi precedute da quelle cutanee). Oltre alle mucose orali possono essere coinvolte quelle faringee, laringee, esofagee, congiuntivali, uretrali, vulvari, della cervice uterina, rettali. Le lesioni orali possono precedere anche di 4-8 mesi la comparsa di lesioni cutanee o rimanere le uniche manifestazioni62. La lesione orale differisce da quella cutanea per la sua pressoché immediata rottura, infatti il reperto clinico sarà un’erosione (molto dolorosa) con ai margini il tetto raggrinzito della ex-bolla (Figura 43). Possono associarsi scialorrea, con eventuali gemizi ematici e disprotidemia sia per le difficoltà nell’alimentazione che per la continua perdita di fluidi attraverso le vescicole. La diagnosi prevede una valutazione clinica delle lesioni e l’esecuzione del segno di Nikolsky ovvero con una punta smussa strisciata su mucosa perilesionale, si ricrea la formazione di una vesciola pemfigosa63. L’esame citologico del contenuto della vescicola potrà mettere in evidenza la presenza di cellule di Tzank (non patognomoniche però del pemfigo), mentre l’esame istologico evidenzierà la presenza di una vescicola intraepiteliale. Di fondamentale importanza sono gli esami in immunofluorescenza diretta e indiretta. Nell’immunofluorescenza diretta vengono evidenziati sul prelievo di mucosa del paziente il deposito di autoanticorpi, conferendo al preparato il cosiddetto aspetto a “rete di pescatore” (o “a manto di giraffa”). L’immunofluorescenza indiretta viene invece eseguita attraverso il prelievo di siero dal paziente cimentandolo con un substrato. Con l’immunofluorescenza indiretta è quindi possibile effettuare la titolazione autoanticorpale, strettamente correlata alla gravità della malattia. A tutt’oggi, nell’iter diagnostico, si esegue anche un esame Elisa, con la duplice valenza di individuare la presenza di autoanticorpi e di darne la titolazione. Il trattamento classico, nelle forme gravi, è basato principalmente sulla somministrazione di steroidi per via sistemica, con dosaggi iniziali che prevedono 1 mg/kg die fino alla scomparsa dei segni. Successivamente si scala il dosaggio fino a raggiungere una minima dose di mantenimento o a sospendere il trattamento (Figure 44a-44b).
Alternativamente o in sinergia con i corticosteroidi vengono impiegati farmaci immunosoppressori come azatioprina e ciclofosfamide. La plasmaferesi viene riservata nei casi di mancata risposta alla terapia così come è possibile utilizzare IVIg o anticorpi anti-CD20 (rituximab), sebbene tali terapie siano ancora estremamente costose e somministrabili in esclusivo regime ospedaliero.
La prognosi della patologia pemfigosa prevede un 10% di decessi, un 40% di remissioni definitive senza bisogno di ulteriori trattamenti, un 20% di pazienti che necessitano una dose terapeutica minima quad vitam, un 30% di casi con riesacerbazione violenta che necessita di terapia d’urto (pulse therapy)64.
Il pemfigo paraneoplastico si associa a neoplasie, di solito ematiche (84%). In questi casi potrà esserci un linfoma non Hodgkin (38%), una leucemia linfocitica cronica (18%), malattia di Castleman (18%) e in percentuali minori timoma o macroglobulinemia di Waldenstrom o linfoma di Hodgkin65.
Gli autoantigeni target della risposta immunitaria possono essere rivolti verso desmoplakine 1 e 2, desmogleina 1 e 3. Solitamente questa forma di pemfigo è refrattaria ai trattamenti convenzionali (Figura 45).
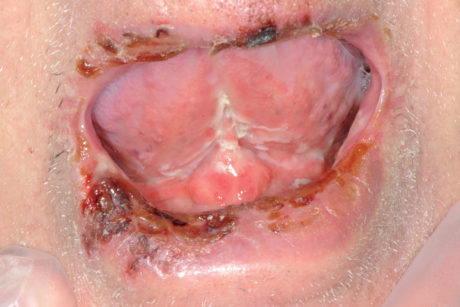
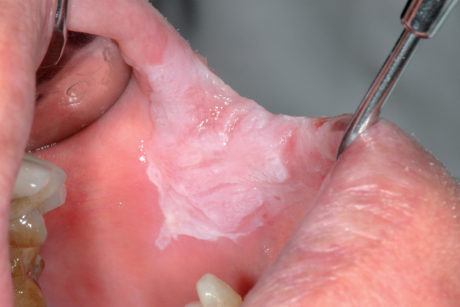
Il pemfigoide muco-membranoso è una patologia autoimmunitaria cronica a interessamento prevalente di mucosa orale, oculare e solo nel 25% dei casi cutaneo. Nel 90% dei casi a livello orale sono coinvolte le gengive, che assumono caratteri desquamativi (Figure 46a-46b), con lesioni resistenti, limitate alle aree di sostegno dei denti e appaiono eritematose e lucide66.
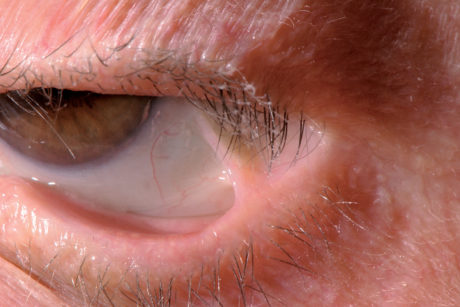
A livello oculare sono possibili congiuntiviti ma anche briglie e sinechie, specialmente alle palpebre inferiori, con formazione di aderenze cicatriziali tra mucose bulbare e palpebrale (simblefaron) o tra le due palpebre (anchiloblefaron); possibile anche danno corneale e cecità (Figura 47).
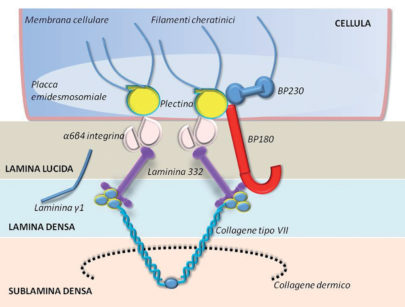
Come nel pemfigo, anche nel pemfigoide il danno tissutale è causato da autoanticorpi circolanti questa volta però diretti nei confronti di alcune componenti della placca emidesmosomiale, che garantisce l’adesione dell’epitelio al sottostante chorion67. La BP180 (o BPAg2) è la proteina target più frequente, ma possono ritrovarsi anche anticorpi rivolti verso la BP230 (o BPAg1), laminina 332, sub unità alfa6 ecc. (Figura 48). La diagnosi si basa sul referto istologico (bolla sub-epiteliale) e soprattutto sull’esame in immunofluorescenza diretta che mette in evidenza depositi lineari di IgG, IgA o frazione del complemento lungo la membrana basale. Attualmente è possibile una siero-diagnosi con metodica Elisa, ma la sensibilità rimane ancora troppo bassa (intorno al 50%). Le lesioni devono essere trattate con corticosteroidi topici e/o sistemici o con farmaci biologici in regime ospedaliero68.
Lichen plan orale
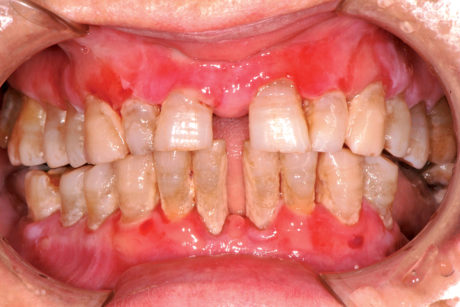
Il lichen planus è una patologia infiammatoria cronica a patogenesi immuno-mediata che interessa cute e mucose e ha come lesione fondamentale la papula. Questa patologia coinvolge prevalentemente la mucosa del cavo orale (LPO), ma può colpire anche altri siti come la cute (Figura 49), le mucose genitali (Figura 50), il cuoio capelluto (risultante in alopecia, Figura 51) e le unghie (Figura 52). Il LPO è una patologia cronica che quindi persiste nei soggetti affetti per un periodo molto lungo anche superiore ai 25 anni, al contrario delle lesioni cutanee che pur essendo molto pruriginose sono autolimitanti. Le lesioni orali possono coesistere con lesioni cutanee e/o a carico delle mucose genitali determinando al malato un disagio, oltre che fisico e funzionale, anche di tipo psicologico. La specifica eziologia del LPO è tuttora sconosciuta, mentre ben chiara è la cascata patogenetica: i cheratinociti dello strato basale, a causa di modificazioni del self, subiscono un’aggressione cellulo-mediata da parte di linfociti citotossici (cloni autoreattivi) che in ultima analisi determinano l’apoptosi delle cellule basali epiteliali69. L’associazione tra HCV e LPO è stata riscontrata con maggior frequenza in Giappone (62%) e nei paesi mediterranei (27%), meno in Francia, Regno Unito e America. L’eterogeneità geografica può essere influenzata dalla prevalenza di HCV e dell’aplotipo HLA DR670.
Il lichen planus orale presenta varie manifestazioni cliniche. In alcuni pazienti la sintomatologia di insorgenza è insidiosa, mentre in altri soggetti asintomatici il riscontro della patologia avviene casualmente a seguito di controlli routinari. A livello della mucosa orale, le lesioni licheniene sono simmetriche e bilaterali e tipicamente coinvolgono più siti contemporaneamente. I siti più comunemente coinvolti da questa patologia sono la mucosa geniena soprattutto in corrispondenza dell’interlinea articolare e del trigono retromolare, la lingua e in particolar modo la superficie dorsale e le gengive. Circa il 10% dei pazienti con LPO presenta lesioni confinate alle gengive dove le tipiche lesioni eritematose definiscono un quadro di gengivite desquamativa che può anche presentare piccole papule o placche biancastre dando così un quadro clinico paragonabile a una cheratosi frizionale o a una leucoplachia. Palato, pavimento orale e labbro superiore non rappresentano sedi preferenziali di insorgenza, ma in casi più rari le lesioni possono anche trovarsi in queste zone71. Andreasen ha classificato le varie forme cliniche di LPO in sei tipologie che, a loro volta, possono essere raggruppate in due gruppi principali72:
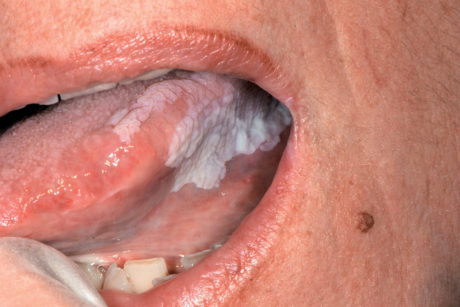
- forme bianche ipercheratosiche che partendo dalle papule possono dar luogo a forme figurate (lineare, striato, reticolare, anulare, a placca) (Figure 53-55);
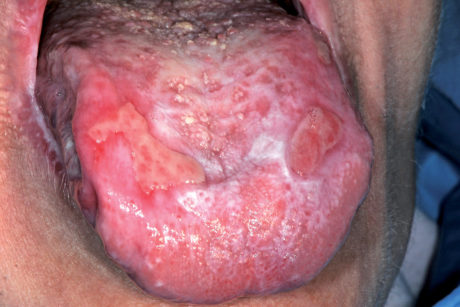
- forme rosse o atrofico-erosive al cui gruppo appartiene il LP atrofico, quello erosivo e il LP bolloso (Figure 56-58).
Le forme ipercheratosiche sono quelle più comuni e anche più facilmente diagnosticabili e trattabili, mentre le forme rosse sono molto dolorose e hanno una prognosi peggiore. La diagnosi di LPO è clinica e istopatologica. Sul piano anatomopatologico, si riscontra una spiccata ipercheratosi (orto o para) con acantosi e ipergranulosi. Lo strato basale appare sofferente con discontinuità della membrana basale mentre nel chorion si ravvisa un infiltrato infiammatorio “a banda” che nei casi più complessi può determinare anche lo scollamento degli strati epiteliali.
I corpi di Civatte sono i residui citoscheletrici dei cheratinociti basali, frammisti a complemento e fibrina, riconoscendo come analoghi dell’immunofluorescenza diretta, i fluorescent bodies2,73.
Bisogna distinguere tuttavia lesioni ascrivibili a LPO dalla displasia lichenoide che riveste un significato prognostico più sfavorevole in senso neoplastico e dalle lesioni lichenoidi, causate da farmaci o materiali restaurativi74. Il trattamento prevede l’impiego di corticosteroidi (locali e/sistemici) e un eventuale antimicotico di copertura. Le lesioni da LPO di solito persistono per alcuni anni con alternanza di periodi di esacerbazione e di remissione. Durante i periodi di esacerbazione, le aree eritematose aumentano con concomitante aumento di dolore e sensibilità. Durante i periodi di quiescenza, invece, si ha una diminuzione delle lesioni e quindi della sintomatologia. In questi periodi, spesso i pazienti sono inconsapevoli della presenza di lesioni ipercheratosiche asintomatiche. L’esacerbazione delle lesioni può essere collegata a periodi di stress psicologico, ansia o a traumi meccanici e anche un’infiammazione cronica di basso grado delle gengive, dovuta a placca e tartaro, può esacerbare le lesioni gengivali75.
Il trattamento del lichen orale prevede l’impiego di corticosteroidi per via topica associati a corticosteroidi per via sistemica nei casi più gravi e complessi. Alternativamente possono essere utilizzati farmaci immunosoppressori come la ciclosporina o il tacrolimus. Nelle forme ipercheratosiche e asintomatiche si potrebbe seguire il cosiddetto watch and wait, o l’impiego di retinodi per via topica76.
L’associazione tra LPO ed epatopatie virus-correlate e non virus-correlate è stata oggetto di numerosi studi eziopatogenetici ed epidemiologici. Nei paesi dell’area mediterranea è stata riscontrata una significativa associazione tra infezione da HCV e LPO così come numerosi sono i report clinici circa la copresenza di infezioni da HBV e LPO. È presupponibile che l’infezione e/o il danno epatico causino un’alterazione dell’omeostasi immunitaria in soggetti con particolare assetto HLA. Tale disregolazione spiegherebbe l’elevata incidenza di patologie di tipo autoimmune nei pazienti HCV positivi. È quindi buona pratica clinica approfondire nel paziente con diagnosi di LPO la copresenza di patologia epatica, valutando marker sierologici ed eventuali esami strumentali di imaging. Benché non ci sia un accordo assoluto circa il potenziale maligno del LPO, sembra che l’incidenza del carcinoma squamocellulare nei pazienti con LPO sia lievemente superiore a quella registrata nella popolazione generale (Figura 59). Attualmente la frequenza di trasformazione maligna sembra essere più comune nelle forme atrofico-erosive. Poiché il lichen è una patologia cronica, i pazienti (soprattutto quelli con forme atrofiche ed erosive di LP) dovrebbero sottoporsi a controlli periodici ed essere informati sulle varie possibilità terapeutiche e sul rischio di trasformazione maligna della malattia77.
Burning Mouth Syndrome
La Burning Mouth Syndrome (BMS), ossia “sindrome della bocca che brucia”, può essere considerata una manifestazione di algia oro-facciale atipica per la sua espressione e presentazione.
La BMS è stata definita dalla IASP (International Association for the Study of Pain) come “una sensazione di tipo urente che interessa la lingua e/o altre mucose del cavo orale in assenza di patologie e lesioni locali”. La BMS è conosciuta in letteratura anche con altre denominazioni, quali “stomatodinia”, “stomatopirosi”, “glossodinia” e “glossopirosi”78. La BMS è una patologia descritta in tutto il mondo che interessa una quota piuttosto significativa della popolazione, con una prevalenza di circa il 3% o anche più, a seconda dei vari studi di cui essa è stata oggetto. La sindrome si riscontra più frequentemente tra il quinto e sesto decennio di vita; in letteratura non esistono segnalazioni di casi in età pediatrica o adolescenziale. Colpisce più frequentemente le donne in età peri- e post-menopausale; il rapporto tra uomini e donne è a favore netto di queste ultime. La BMS spesso coesiste con altri disturbi da dolore cronico. L’eziologia della BMS è fondamentalmente sconosciuta. Sotto il profilo clinico, la BMS è un complesso disturbo cronico caratterizzato da sintomi di bruciore, dolore o prurito alla mucosa orale, senza alterazioni osservabili clinicamente, senza alterazioni degli esami di laboratorio e senza modifiche del flusso salivare. L’insorgenza della sindrome è solitamente spontanea, ma a volte può osservarsi un evento scatenante come un trauma o un life event o da un trattamento odontoiatrico. Sebbene la sintomatologia sia solitamente di intensità moderata, alcuni pazienti avvertono solo modesti fastidi, mentre altri lamentano un dolore insopportabile. Inoltre la sindrome ha un decorso cronico, pertanto la sintomatologia può essere continua o intermittente e permanere per un periodo di tempo molto variabile, che può andare da pochi mesi a molti anni. È stato riportato in letteratura che oltre la metà dei pazienti va incontro a remissione spontanea, completa o parziale, dopo circa 6-7 anni, fino ad arrivare, in alcuni casi, a 10-12 anni79. Lamey e Lewis80 definiscono tre differenti tipi di BMS sulla base delle fluttuazioni dei sintomi nelle diverse fasi della giornata:
- il 35% dei pazienti rientra nel tipo I di BMS; essi sono caratterizzati dall’assenza di sintomatologia al risveglio, ma il bruciore aumenta progressivamente durante la giornata, raggiungendo il picco massimo alla sera;
- nel tipo II, il più frequente (55% dei casi) e il più refrattario alla terapia, i sintomi sono già presenti al risveglio e la sensazione è continua e costante per tutto il giorno;
- il tipo III, più raro (10% dei casi), è caratterizzato da una sintomatologia urente intermittente, con un’alternanza di giorni in cui il bruciore è presente e altri in cui il sintomo è assente.
Da non sottovalutare è il quadro psicologico del paziente: a questo disturbo sono spesso associate depressione, ansia e/o somatizzazione. Infatti, pur non essendo accompagnata da alterazioni organiche evidenti e non comportando rischi per lo stato di salute, questa sindrome può ridurre in modo significativo la qualità di vita dei pazienti81. La BMS si caratterizza per l’assenza di lesioni obiettivabili, pertanto la diagnosi sarà una “diagnosi di esclusione”. Occorre in primo luogo prendere in considerazione ed escludere una serie di condizioni locali e sistemiche. Il primo passo diagnostico è rappresentato da una scrupolosa anamnesi, con particolare attenzione al tipo di alimentazione, al vizio del fumo e all’assunzione di sostanze alcoliche. È anche necessario ricercare patologie carenziali, dismetaboliche, neurologiche e possibili cause di polineuropatia. Occorre conoscere la storia clinica del bruciore come sintomo, indagando su epoca di comparsa, durata, sede, andamento nel corso della giornata, associazione con altri sintomi orali, intensità, fattori esacerbanti e attenuanti la sintomatologia, associazione temporale con possibili fattori causali, quali assunzione di determinati cibi e farmaci capaci di indurre xerostomia e/o bruciore orale, pregresse terapie radianti82. Dopo avere posto la diagnosi di BMS, avendo quindi escluso o eliminato tutti i potenziali fattori irritanti locali e trattato le condizioni sistemiche, occorre rassicurare il paziente che per quanto il suo disturbo sia concreto, esso non è nefasto e non rappresenta un pericolo per la sua salute.
Pur non essendoci un trattamento univoco, sono stati riportati vari livelli di evidenza per quanto riguarda l’efficacia di diversi tipi di intervento terapeutico. Nelle forme di BMS in cui si sospetti una prevalente base psicosomatica, un semplice intervento di tipo psicologico, mirato a informare e a tranquillizzare il paziente sulla natura assolutamente benigna della propria condizione, può contribuire a ridurne sensibilmente l’apprensione e il livello d’ansia. Il trattamento farmacologico è basato sulla somministrazione di antidepressivi triciclici come l’amitriptilina, antiepilettici come la carbamazepina e il clonazepam e antidepressivi serotoninergici, come il trazodone. Studi controllati hanno anche evidenziato gli effetti positivi della capsaicina e dell’acido alfa lipoico83,84.
Lesioni potenzialmente maligne
Leucoplachia
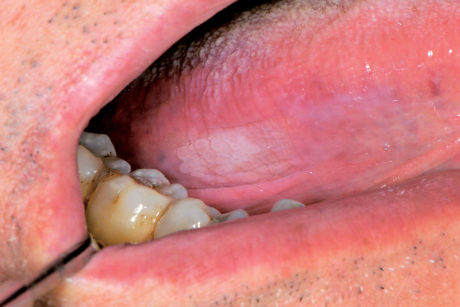
La leucoplachia, secondo la definizione della WHO, è una placca bianca non caratterizzabile in un’altra condizione né da un punto di vista clinico né da un punto di vista istopatologico85. La diagnosi definitiva quindi si basa sull’esclusione di altre lesioni della mucosa orale che hanno un aspetto similare, come ad esempio il lichen planus ipercheratosico, il leucoedema ecc.
È importante sottolineare che il termine leucoplachia ha un solo uso clinico e non riflette le alterazioni istologiche presenti nella lesione. È una delle lesioni bianche più frequenti della mucosa orale e si osserva in circa il 3% degli individui adulti con una netta preferenza per il sesso maschile.
Il fumo, la masticazione del tabacco e l’abuso di sostanze alcoliche sono le cause più frequenti della leucoplachia. Vi è comunque un certo numero di casi di leucoplachia in cui non è possibile identificare alcuna causa86.
Le sedi più comuni sono la mucosa vestibolare, il pavimento orale, la zona retrocommissurale, i margini laterali della lingua e il ventre linguale. Le lesioni presenti sui margini linguali, sul pavimento orale e sul labbro inferiore sono tra quelle a maggior rischio di trasformazione maligna.
La leucoplachia ha un aspetto prevalentemente bianco perché l’incremento dello strato di cheratina maschera il colorito roseo dei vasi presenti nella sottostante lamina propria. Quando la lesione assume un colore misto (bianco e rosso) prende il nome di leucoeritroplachia o eritroleucoplachia. Distinguiamo tre forme cliniche principali di leucoplachia: la forma piana omogena (Figura 60) presenta una superficie piana e regolare, la forma verrucosa (Figura 61) mostra una superficie irregolare con propaggini bianche, la forma fissurata disomogena (Figura 62) è caratterizzata da aree bianche alternate ad aree rosse e in questi casi la biopsia può evidenziare vari gradi di displasia o un carcinoma in situ o invasivo. Infatti l’aspetto verrucoso e la presenza di una componente di colore rosso (speckled leucoplakia) indicano la presenza quasi certa di displasia o carcinoma invasivo87.
Il primo passo nella diagnosi differenziale di una leucoplachia consiste nello:
- stabilire se può essere rimossa con una garza o un abbassalingua (la pseudomembrana candidosica risulta spatolabile meccanicamente);
- individuare le possibili cause (automorsicamento, ipercheratosi frizionale, hairy leukoplakia – Figura 63), lingua a carta geografica).
Se la lesione non è asportabile o non è clinicamente diagnosticabile, è necessario sottoporre la leucoplachia a biopsia. In ogni caso il riscontro clinico di una leucoplachia non deve mai essere sottovalutato poiché anche lesioni di aspetto clinico innocente possono nascondere una displasia grave o un carcinoma. Al microscopio ottico la leucoplachia presenta un ampio spettro morfologico che varia dalla semplice iperortocheratosi o iperparacheratosi e acantosi alla displasia lieve, moderata o severa fino al carcinoma in situ o invasivo. Studi controllati randomizzati hanno dimostrato che non esiste un trattamento efficace per prevenire la trasformazione maligna della leucoplachia88.
Il blu di toluidina o la soluzione di Lugol possono essere utili in caso di lesioni ampie per individuare le aree a maggior rischio evolutivo (Figure 64a-64c)89,90. Il rischio di trasformazione neoplastica della leucoplachia varia dal 4 al 17%. La leucoplachia proliferativa verrucosa (PVL), descritta da Hansen nel 1985, è una forma particolare di leucoplachia che ha la caratteristica di esordire come una placca ipercheratosica di piccole dimensioni che progressivamente si allarga coinvolgendo ampie porzioni della mucosa orale91. Le lesioni assumono l’aspetto di placche multiple verrucose che tendono a espandersi (Figura 65).
Le sedi più comuni sono rappresentate dalla mucosa vestibolare e gengivale, dal dorso linguale e dal palato. Gli aspetti istopatologici variano dalla semplice iper, orto o paracheratosi, al carcinoma verrucoso o a focolai di carcinoma invasivo.
Il rischio di trasformazione neoplastica è intorno al 70%13 e la lesione tende frequentemente a recidivare92.
Eritroplachia
Secondo la definizione della WHO, l’eritroplachia consiste in un’area rossa della mucosa orale che non è inquadrabile in un’altra condizione né da un punto di vista clinico né da un punto di vista istopatologico. Tale terminologia dovrebbe essere usata solo per una descrizione clinica della lesione e non ha nessun significato istopatologico. La lesione non può essere attribuita a cause traumatiche, infiammatorie o vascolari e dunque la diagnosi si effettua per esclusione86,93.
Il termine ricalca quello impiegato per la cosiddetta eritroplasia di Queyrat che descrive una lesione rossa, di aspetto vellutato, che si sviluppa sul pene di soggetti anziani. L’eritroplachia è di raro riscontro clinico e gli studi a riguardo indicano una prevalenza tra lo 0,02% e lo 0,83% anche se percentuali maggiori si riscontrano in India e sud-est asiatico. La maggior parte delle lesioni si osserva in pazienti anziani forti fumatori, masticatori di tabacco e bevitori e si presenta come aree rosse dai contorni indistinti e dalla superficie vellutata. Il colorito rosso si spiega con l’assottigliamento degli strati epiteliali e la scomparsa della cheratina e ciò rende meglio visibili i vasi della sottostante lamina propria94.
Alcuni autori non sono concordi nel definirla eritroplachia in quanto spesso non forma delle placche rilevate ma appare depressa al di sotto della circostante mucosa.
Secondo Shear95 l’eritroplachia può essere classificata in 3 tipi:
- eritroplachia omogena (Figura 66);
- eritroplachia frammista a macchie bianche (Figura 67);
- eritroplachia granulare.
La lesione eritroplasica risulta soffice alla palpazione e diventa di consistenza dura solo se si sviluppa un carcinoma invasivo. Le dimensioni in genere non sono superiori a 1,5 cm e i margini possono essere nettamente distinti dalla circostante mucosa sana o sfumare gradualmente in essa.
Le sedi più frequenti di localizzazione sono il pavimento orale, il palato molle, la zona retromandibolare e i margini laterali della lingua anche se alcuni autori hanno riscontrato delle differenze di localizzazione tra uomini e donne. Poco si conosce riguardo la storia naturale dell’eritroplachia, in particolare se essa insorge de novo o dall’evoluzione di una lesione bianca. Inoltre, il possibile ruolo della Candida albicans e dell’HPV deve ancora essere indagato adeguatamente. Nell’80-90% dei casi si osserva istologicamente un’alterazione displastica o un carcinoma in situ o invasivo96.
Il carcinoma squamoso del cavo orale
Il carcinoma squamoso orale (OSCC “Oral Squamous Cell Carcinoma”) è il tumore maligno più frequente di quest’area anatomica rappresentandone il 90% dei casi; conta circa 275.000 nuovi casi l’anno su tutta la popolazione mondiale rientrando nei primi 10-15 tumori maligni più frequenti nell’uomo97.

Il rischio relativo negli individui forti fumatori e bevitori, rispetto a soggetti che non fumano o che bevono modiche quantità di alcool, varia da 70 a 100 volte. Inoltre, esiste un effetto sinergico tra fumo e consumo di alcolici: quando sono presenti entrambi, non sommano semplicemente i loro effetti dannosi ma li moltiplicano esponenzialmente.
È stato segnalato un ruolo eziologico dell’HPV 16/18 nella genesi dei carcinomi oro-faringei e soprattutto tonsillari.
Lo sviluppo del carcinoma orale è spesso preceduto dall’insorgenza di disordini potenzialmente maligni identificabili come placche bianche o aree rosse conosciute come leucoplachia ed eritroplachia le quali possiedono, rispetto alla mucosa normale, una maggiore potenzialità di trasformazione neoplastica maligna98.
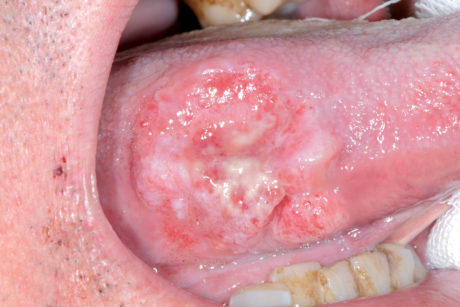
Dal punto di vista clinico il carcinoma squamoso orale può presentarsi come un’area bianca, un’area rossa, un’ulcerazione o una tumefazione (Figure 68a-68d, 69, 70).
Si possono osservare lesioni esofitiche di aspetto papillare o verrucoso o lesioni a crescita endofitica che assumono l’aspetto di ulcere penetranti.
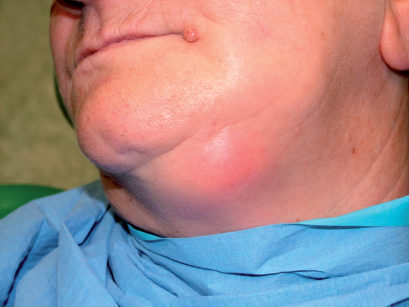
Le sedi più frequenti del carcinoma orale sono: margini laterali della lingua (45%), pavimento orale (30%), palato molle e trigono retromolare (15%), gengiva e cresta alveolare (4%) e mucosa vestibolare (1%). Nella maggioranza dei casi i carcinomi orali sono asintomatici; in quelli più avanzati si possono riscontrare dolore, sanguinamento, fistolizzazioni cutanee, tumefazioni dei mascellari, difficoltà della fonazione e dell’apertura della mandibola. Occasionalmente si osservano pazienti in cui il primo segno clinico è una tumefazione linfonodale a livello latero-cervicale o sotto-mandibolare (Figura 71).
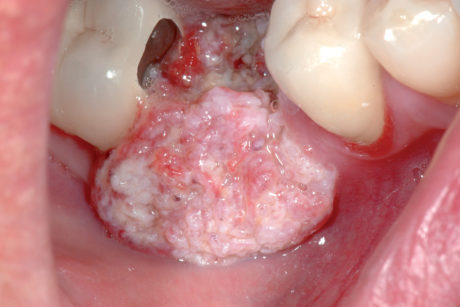
L’esame obiettivo e l’analisi istopatologica dell’area clinicamente più sospetta costituiscono le tappe fondamentali nella diagnosi del carcinoma orale99. Esami strumentali come Rx OPT, TAC e RMN, PET sono utili per valutare l’estensione del tumore primario e il coinvolgimento linfonodale. I carcinomi del pavimento orale e della lingua manifestano una tendenza maggiore alla metastatizzazione regionale100.
Lo staging dell’OSCC è strettamente correlato alla percentuale di sopravvivenza del paziente: una diagnosi allo stadio I prevede una prognosi favorevole a 5 anni nell’85% dei casi, allo stadio II il tasso di sopravvivenza a 5 anni scende al 66% mentre se la diagnosi giunge con un carcinoma già allo stadio III, solo il 41% dei pazienti sopravvive. Purtroppo, molti carcinomi del cavo orale vengono diagnosticati allo stadio IV, con una percentuale del 9% di pazienti che sopravvive ai 5 anni87.
Attualmente, per la stadiazione TNM del carcinoma del cavo orale, si adottano i parametri presentati in Tabella 4. Il trattamento varia a seconda dell’estensione e della sede: lesioni di piccole dimensioni possono essere trattate esclusivamente con radioterapia o escissione chirurgica; lesioni di entità maggiore richiedono un trattamento combinato e un eventuale svuotamento linfonodale della catena linfatica del collo101.
Corrispondenza
rosario.serpico@unina2.it
massimo.petruzzi@uniba.it
1Professore ordinario presso Seconda Università degli Studi di Napoli. Dipartimento multidisciplinare di specialità medico-chirurgiche e odontostomatologiche
2Ricercatore presso Università degli Studi di Bari “Aldo Moro”. Clinica odontoiatrica – Sezione di odontostomatologia
2. Gombos F, Serpico R, Pilato V. Aspects of oral pathology: Fordyce granules. Arch Stomatol 1984 Apr-Jun;25(2):209-14.
3. De Felice C, Parrini S, Chitano G, Gentile M, Dipaola L, Latini G. Fordyce granules and hereditary non-polyposis colorectal cancer syndrome. Gut 2005 Sep;54(9):1279-82.
4. Canaan TJ, Meehan SC. Variations of structure and appearance of the oral mucosa. Dent Clin North Am 2005 Jan;49(1):1-14.
5. Martin JL. Leukoedema: a review of the literature. J Natl Med Assoc 1992 Nov;84(11):938-40.
6. Lucchese A, Favia G. White sponge naevus with minimal clinical and histological changes: report of three cases. J Oral Pathol Med 2006 May;35(5):317-9.
7. Reamy BV, Derby R, Bunt CW. Common tongue conditions in primary care. Am Fam Physician 2010 Mar 1;81(5):627-34.
8. Rees TD. Orofacial granulomatosis and related conditions. Periodontol 2000 1999 Oct;21:145-57.
9. Alikhani M, Khalighinejad N, Ghalaiani P, Khaleghi MA, Askari E, Gorsky M. Immunologic and psychologic parameters associated with geographic tongue. Oral Surg Oral Med Oral Pathol Oral Radiol 2014 Jul;118(1):68-71.
10. Pass B, Brown RS, Childers EL. Geographic tongue: literature review and case reports. Dent Today 2005 Aug;24(8):54,56-7.
11. Gurvits GE, Tan A. Black hairy tongue syndrome. World J Gastroenterol 2014 Aug 21;20(31):10845-50.
12. Sarti GM, Haddy RI, Schaffer D, Kihm J. Black hairy tongue. Am Fam Physician 1990 Jun;41(6):1751-5.
13. Ficarra G. Manuale di patologia e medicina orale. McGraw-Hill, 2006, 3a ed.
14. Klaiber B, Krekeler G, Mitschele K. The Stillman cleft-a consequence of undue stress? Dtsch Zahnarztl Z 1980 Mar;35(3):426-9.
15. Cizmeci MN, Kanburoglu MK, Kara S, Tatli MM. Bohn’s nodules: peculiar neonatal intraoral lesions mistaken for natal teeth. Eur J Pediatr 2014 Mar;173(3):403.
16. Turgut S, Murat Ozcan K, Celikkanat S, Katirci H, Ozdem C. Diagnosis and treatment of lingual thyroid: a review. Rev Laryngol Otol Rhinol (Bord) 1997;118(3):189-92.
17. Kumar SS, Kumar DM, Thirunavukuarasu R. Lingual thyroid-conservative management or surgery? A case report. Indian J Surg 2013 Jun;75(Suppl 1):118-9.
18. Alawi F. Pigmented lesions of the oral cavity: an update. Dent Clin North Am 2013;57(4):699-710.
19. Gondak RO, da Silva-Jorge R, Jorge J, Lopes MA, Vargas PA. Oral pigmented lesions: clinicopathologic features and review of the literature. Med Oral Patol Oral Cir Bucal 2012 Nov 1;17(6):e919-24.
20. Müller S. Melanin-associated pigmented lesions of the oral mucosa: presentation, differential diagnosis, and treatment. Dermatol Ther 2010 May-Jun;23(3):220-9.
21. Meleti M, Vescovi P, Mooi WJ, van der Waal I. Pigmented lesions of the oral mucosa and perioral tissues: a flow-chart for the diagnosis and some recommendations for the management. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008 May;105(5):606-16.
22. Contreras E, Carlos R. Oral melanoacanthosis (melanoachantoma): report of a case and review of the literature. Med Oral Patol Oral Cir Bucal 2005 Jan-Feb;10(1):11-2;9-11.
23. Chandra P, Govindraju P. Prevalence of oral mucosal lesions among tobacco users. Oral Health Prev Dent 2012;10(2):149-53.
24. Mergoni G, Ergun S, Vescovi P, Mete Ö, Tanyeri H, Meleti M. Oral postinflammatory pigmentation: an analysis of 7 cases. Med Oral Patol Oral Cir Bucal 2011 Jan 1;16(1):e11-4.
25. Mohan M, Sukhadia VY, Pai D, Bhat S. Oral malignant melanoma: systematic review of literature and report of two cases. Oral Surg Oral Med Oral Pathol Oral Radiol 2013 Oct;116(4):e247-54.
26. Aguas SC, Quarracino MC, Lence AN, Lanfranchi-Tizeira HE. Primary melanoma of the oral cavity: ten cases and review of 177 cases from literature. Med Oral Patol Oral Cir Bucal 2009 Jun 1;14(6):E265-71.
27. Pai A, Prasad S, Patil BA, Dyasanoor S, Hedge S. Oral pigmentation: case report and review of malignant melanoma with flow charts for diagnosis and treatment. Gen Dent 2012 Sep-Oct;60(5):410-6;quiz 417-8.
28. Esmeili T, Lozada-Nur F, Epstein J. Common benign oral soft tissue masses. Dent Clin North Am 2005 Jan;49(1):223-40.
29. Thwaites MS, Jeter TE, Ajagbe O. Inflammatory papillary hyperplasia: review of literature and case report involving a 10-year-old child. Quintessence Int 1990 Feb;21(2):133-8.
30. az Goulart MC, Lara VS. Inflammatory papillary hyperplasia of the palate: quantitative analysis of Candida albicans and its negative correlation with microscopic and demographic aspects. Int J Prosthodont 2011 May-Jun;24(3):235-7.
31. Han SH, Baek SO, Jung SN. Mucocele in the buccal vestibule. J Craniofac Surg 2012 Nov;23(6):1928.
32. Khandelwal S, Patil S. Oral mucoceles – review of the literature. Minerva Stomatol 2012 Mar;61(3):91-9.
33. Re Cecconi D, Achilli A, Tarozzi M, Lodi G, Demarosi F, Sardella A, Carrassi A. Mucoceles of the oral cavity: a large case series (1994-2008) and a literature review. Med Oral Patol Oral Cir Bucal 2010 Jul 1;15(4):e551-6.
34. Damm DD, Fantasia JE. Bilateral white lesions of buccal mucosa. Morsicatio buccarum. Gen Dent 2006 Nov-Dec;54(6):442,444.
35. Campisi G, Compilato D, Cirillo N, Ciavarella D, Panzarella V, Amato S, Lo Muzio L. Oral ulcers: three questions on their physiopathology. Minerva Stomatol 2007 May;56(5):293-302.
36. Gilvetti C, Porter SR, Fedele S. Traumatic chemical oral ulceration: a case report and review of the literature. Br Dent J 2010 Apr 10;208(7):297-300.
37. Buckmiller LM, Richter GT, Suen JY. Diagnosis and management of hemangiomas and vascular malformations of the head and neck. Oral Dis 2010 Jul;16(5):405-18.
38. Tempesta A, Limongelli L, De Falco V, Petruzzi M, Favia G. Phaces syndrome with intraoral and perioral hemangiomas: a different approach with diode laser. Ann Stomatol 2013 Oct 24;4(Suppl 2):42-3.
39. Canaan TJ, Meehan SC. Variations of structure and appearance of the oral mucosa. Dent Clin North Am 2005 Jan;49(1):1-14.
40. Serpico R, Liguori G. La candidosi orale. Padova: Piccin Editore, 2000.
41. Coleman D, Sullivan D, Harrington B, Haynes K, Henman M, Shanley D, Bennett D, Moran G, McCreary C, O’Neill L. Molecular and phenotypic analysis of Candida dubliniensis: a recently identified species linked with oral candidosis in HIV-infected and AIDS patients. Oral Dis 1997 May;3 Suppl 1:S96-101.
42. Farah CS, Lynch N, McCullough MJ. Oral fungal infections: an update for the general practitioner. Aust Dent J 2010 Jun;55 Suppl 1:48-54.
43. Salerno C, Pascale M, Contaldo M, Esposito V, Busciolano M, Milillo L, Guida A, Petruzzi M, Serpico R. Candida-associated denture stomatitis. Med Oral Patol Oral Cir Bucal 2011 Mar 1;16(2):e139-43.
44. Ellepola AN, Samaranayake LP. Oral candidal infections and antimycotics. Crit Rev Oral Biol Med 2000;11(2):172-98.
45. Reichart PA, Samaranayake LP, Philipsen HP. Pathology and clinical correlates in oral candidiasis and its variants: a review. Oral Dis 2000 Mar;6(2):85-91.
46. Appleton SS. Candidiasis: pathogenesis, clinical characteristics, and treatment. J Calif Dent Assoc 2000 Dec;28(12):942-8.
47. Sitheeque MA, Samaranayake LP. Chronic hyperplastic candidosis/candidiasis (Candida leukoplakia). Crit Rev Oral Biol Med 2003;14(4):253-67.
48. Park KK, Brodell RT, Helms SE. Angular cheilitis, part 1: local etiologies. Cutis 2011 Jun;87(6):289-95.
49. Park KK, Brodell RT, Helms SE. Angular cheilitis, part 2: nutritional, systemic, and drug-related causes and treatment. Cutis 2011 Jul;88(1):27-32.
50. Carter LC. Median rhomboid glossitis: review of a puzzling entity. Compendium 1990 Jul;11(7):446,448-51.
51. Westley S, Seymour R, Staines K. Recurrent intra-oral herpes simplex 1 infection. Dent Update 2011 Jul-Aug;38(6):368-70,372-4.
52. Arduino PG, Porter SR. Herpes simplex virus type 1 infection: overview on relevant clinico-pathological features. J Oral Pathol Med 2008 Feb;37(2):107-21.
53. Woo SB, Challacombe SJ. Management of recurrent oral herpes simplex infections. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007 Mar;103 Suppl:S12.e1-18.
54. Chavan M, Jain H, Diwan N, Khedkar S, Shete A, Durkar S. Recurrent aphthous stomatitis: a review. J Oral Pathol Med 2012 Sep;41(8):577-83.
55. Baccaglini L, Lalla RV, Bruce AJ, Sartori-Valinotti JC, Latortue MC, Carrozzo M, Rogers RS 3rd. Urban legends: recurrent aphthous stomatitis. Oral Dis 2011 Nov;17(8):755-70.
56. Vucicevic Boras V, Savage NW. Recurrent aphthous ulcerative disease: presentation and management. Aust Dent J 2007 Mar;52(1):10-5.
57. Brocklehurst P, Tickle M, Glenny AM, Lewis MA, Pemberton MN, Taylor J, Walsh T, Riley P, Yates JM. Systemic interventions for recurrent aphthous stomatitis (mouth ulcers). Cochrane Database Syst Rev 2012 Sep 12;9:CD005411.
58. Samim F, Auluck A, Zed C, Williams PM. Erythema multiforme: a review of epidemiology, pathogenesis, clinical features, and treatment. Dent Clin North Am 2013 Oct;57(4):583-96.
59. Al-Johani KA, Fedele S, Porter SR. Erythema multiforme and related disorders. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007 May;103(5):642-54.
60. Abdollahi M, Radfar M. A review of drug-induced oral reactions. J Contemp Dent Pract 2003 Feb 15;4(1):10-31.
61. Santoro FA, Stoopler ET, Werth VP. Pemphigus. Dent Clin North Am 2013 Oct;57(4):597-610.
62. Cirillo N, Cozzani E, Carrozzo M, Grando SA. Urban legends: pemphigus vulgaris. Oral Dis 2012 Jul;18(5):442-58. Review erratum in: Oral Dis 2012 Sep;18(6):624.
63. Mignogna MD, Fortuna G, Leuci S, Ruoppo E, Marasca F, Matarasso S. Nikolsky’s sign on the gingival mucosa: a clinical tool for oral health practitioners. J Periodontol 2008 Dec;79(12):2241-6.
64. Scully C, Mignogna M. Oral mucosal disease: pemphigus. Br J Oral Maxillofac Surg 2008 Jun;46(4):272-7.
65. Allen CM, Camisa C. Paraneoplastic pemphigus: a review of the literature. Oral Dis 2000 Jul;6(4):208-14.
66.Xu HH, Werth VP, Parisi E, Sollecito TP. Mucous membrane pemphigoid. Dent Clin North Am 2013 Oct;57(4):611-30.
67.Scully C, Lo Muzio L. Oral mucosal diseases: mucous membrane pemphigoid. Br J Oral Maxillofac Surg 2008 Jul;46(5):358-66.
68.Petruzzi M. Mucous membrane pemphigoid affecting the oral cavity: short review on etiopathogenesis, diagnosis and treatment. Immunopharmacol Immunotoxicol 2012 Jun;34(3):363-7.
69. Di Stasio D, Guida A, Salerno C, Contaldo M, Esposito V, Laino L, Serpico R, Lucchese A. Oral lichen planus: a narrative review. Front Biosci (Elite Ed) 2014 Jun 1;6:370-6.
70. Carrozzo M, Brancatello F, Dametto E, Arduino P, Pentenero M, Rendine S, Porter SR, Lodi G, Scully C, Gandolfo S. Hepatitis C virus-associated oral lichen planus: is the geographical heterogeneity related to HLA-DR6? J Oral Pathol Med 2005 Apr;34(4):204-8.
71. Carrozzo M, Thorpe R. Oral lichen planus: a review. Minerva Stomatol 2009 Oct;58(10):519-37.
72. Andreasen JO. Oral lichen planus. 1. A clinical evaluation of 115 cases. Oral Surg Oral Med Oral Pathol 1968 Jan;25(1):31-42.
73. Pendyala G, Joshi S, Kalburge J, Joshi M, Tejnani A. Oral lichen planus: a report and review of an autoimmune-mediated condition in gingiva. Compend Contin Educ Dent 2012 Sep;33(8):e102-8.
74. Hiremath SK, Kale AD, Charantimath S. Oral lichenoid lesions: clinico-pathological mimicry and its diagnostic implications. Indian J Dent Res 2011 Nov-Dec;22(6):827-34.
75. Thongprasom K, Dhanuthai K. Steriods in the treatment of lichen planus: a review. J Oral Sci 2008 Dec;50(4):377-85.
76. Petruzzi M, Lucchese A, Lajolo C, Campus G, Lauritano D, Serpico R. Topical retinoids in oral lichen planus treatment: an overview. Dermatology 2013;226(1):61-7.
77. Gorsky M, Epstein JB. Oral lichen planus: malignant transformation and human papilloma virus: a review of potential clinical implications. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2011 Apr;111(4):461-4.
78. Sun A, Wu KM, Wang YP, Lin HP, Chen HM, Chiang CP. Burning mouth syndrome: a review and update. J Oral Pathol Med 2013 Oct;42(9):649-55.
79. Spanemberg JC, Cherubini K, de Figueiredo MA, Yurgel LS, Salum FG. Aetiology and therapeutics of burning mouth syndrome: an update. Gerodontology 2012 Jun;29(2):84-9.
80. Lamey PJ, Lewis MA. Oral medicine in practice: burning mouth syndrome. Br Dent J 1989 Sep 23;167(6):197-200.
81. de Souza FT, Teixeira AL, Amaral TM, dos Santos TP, Abreu MH, Silva TA, Kummer A. Psychiatric disorders in burning mouth syndrome. J Psychosom Res 2012 Feb;72(2):142-6.
82. Aravindhan R, Vidyalakshmi S, Kumar MS, Satheesh C, Balasubramanium AM, Prasad VS. Burning mouth syndrome: a review on its diagnostic and therapeutic approach. J Pharm Bioallied Sci 2014 Jul;6(Suppl. 1):S21-5.
83. Mínguez Serra MP, Salort Llorca C, Silvestre Donat FJ. Pharmacological treatment of burning mouth syndrome: A review and update. Med Oral Patol Oral Cir Bucal 2007 Aug 1;12(4):E299-304.
84. Petruzzi M, Lauritano D, De Benedittis M, Baldoni M, Serpico R. Systemic capsaicin for burning mouth syndrome: short-term results of a pilot study. J Oral Pathol Med 2004 Feb;33(2):111-4.
85. Warnakulasuriya S, Johnson NW, van der Waal I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J Oral Pathol Med 2007;36(10):575-80.
86. Boy SC. Leukoplakia and erythroplakia of the oral mucosa-a brief overview. SADJ 2012 Nov;67(10):558-60.
87. W. Neville. Oral and maxillofacial pathology. Saunders ed., 2008, 3a ed.
88. Kumar A, Cascarini L, McCaul JA, Kerawala CJ, Coombes D, Godden D, Brennan PA. How should we manage oral leukoplakia? Br J Oral Maxillofac Surg 2013 Jul;51(5):377-83.
89. Patton LL, Epstein JB, Kerr AR. Adjunctive techniques for oral cancer examination and lesion diagnosis: a systematic review of the literature. J Am Dent Assoc 2008 Jul;139(7):896-905;quiz 993-4.
90. Petruzzi M, Lucchese A, Baldoni E, Grassi FR, Serpico R. Use of Lugol’s iodine in oral cancer diagnosis: an overview. Oral Oncol 2010 Nov;46(11):811-3.
91. Hansen LS, Olson JA, Silverman S Jr. Proliferative verrucous leukoplakia. A long-term study of thirty patients. Oral Surg Oral Med Oral Pathol 1985 Sep;60(3):285-98.
92. Cerero-Lapiedra R, Baladé-Martínez D, Moreno-López LA, Esparza-Gómez G, Bagán JV. Proliferative verrucous leukoplakia: a proposal for diagnostic criteria. Med Oral Patol Oral Cir Bucal 2010 Nov 1;15(6):e839-45.
93. Felix DH, Luker J, Scully C. Oral medicine: 7. Red and pigmented lesions. Dent Update 2013 Apr;40(3):231-4.
94. Villa A, Villa C, Abati S. Oral cancer and oral erythroplakia: an update and implication for clinicians. Aust Dent J 2011 Sep;56(3):253-6.
95. Shear M. Erythroplakia of the mouth. Int Dent J 1972 Dec;22(4):460-73.
96. Scully C. Challenges in predicting which oral mucosal potentially malignant disease will progress to neoplasia. Oral Dis 2014 Jan;20(1):1-5.
97. http://globocan.iarc.fr
98. Lodi G, Porter S. Management of potentially malignant disorders: evidence and critique. J Oral Pathol Med 2008 Feb;37(2):63-9.
99. van Zyl A, Bunn BK. Clinical features of oral cancer. SADJ 2012 Nov;67(10):566-9.
100. Routray S, Shankar AA. PET/CT: emphasis and current utility in oral cancer. Oral Oncol 2012 Nov;48(11):e42.
101. Deng H, Sambrook PJ, Logan RM. The treatment of oral cancer: an overview for dental professionals. Aust Dent J 2011 Sep;56(3):244-52,341.



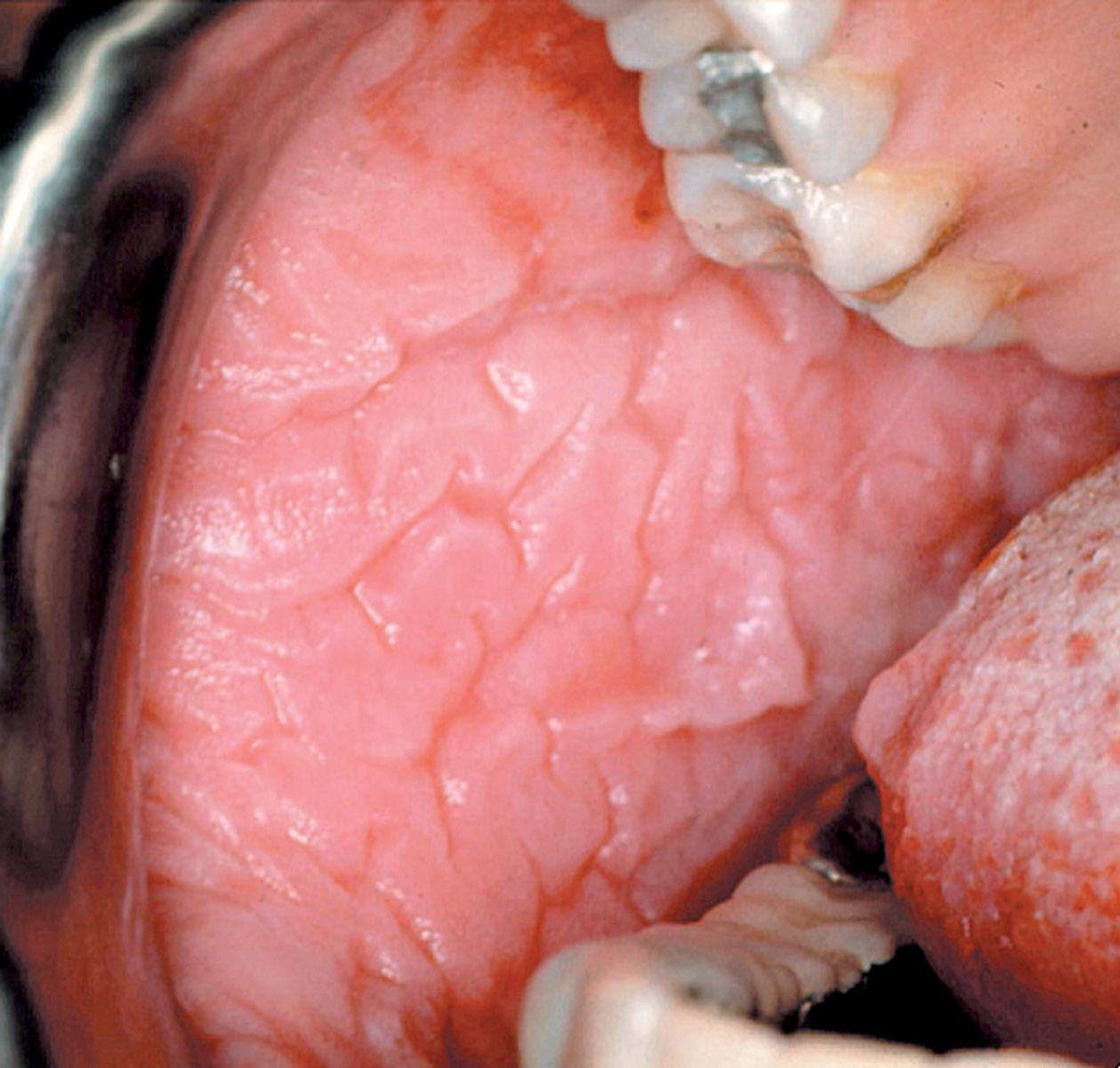
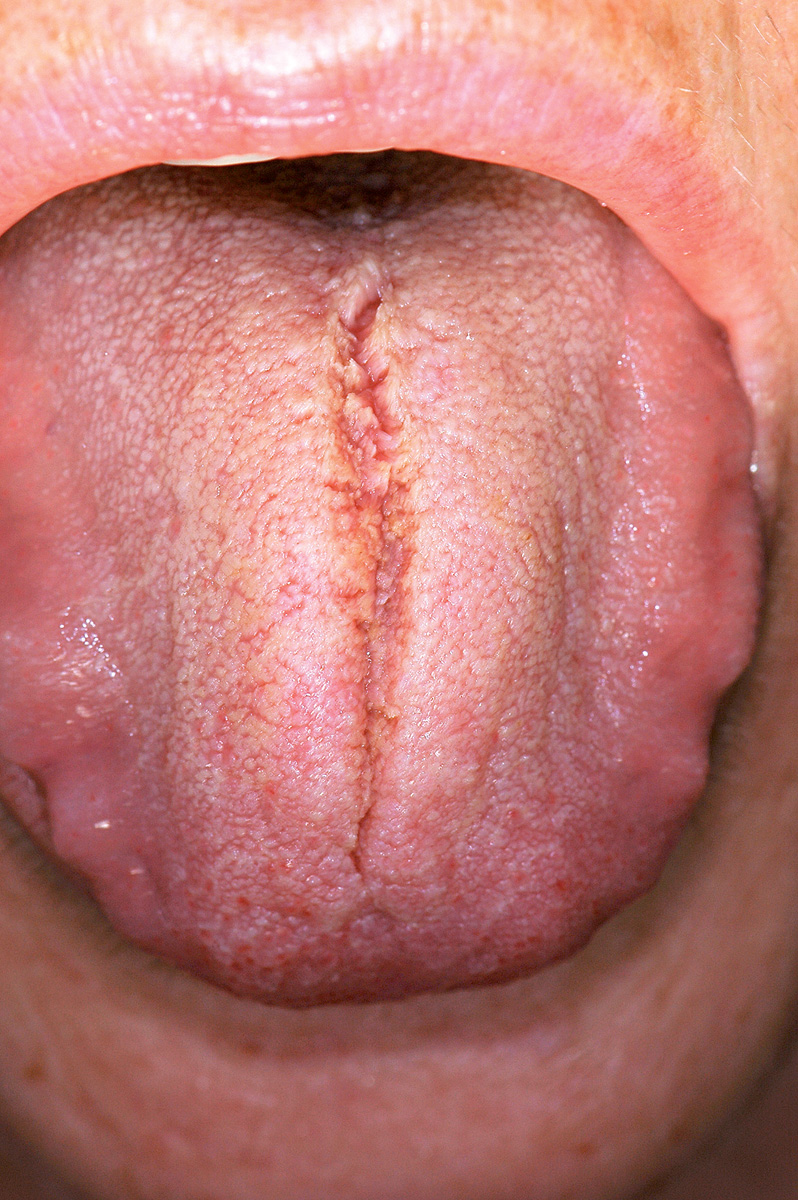
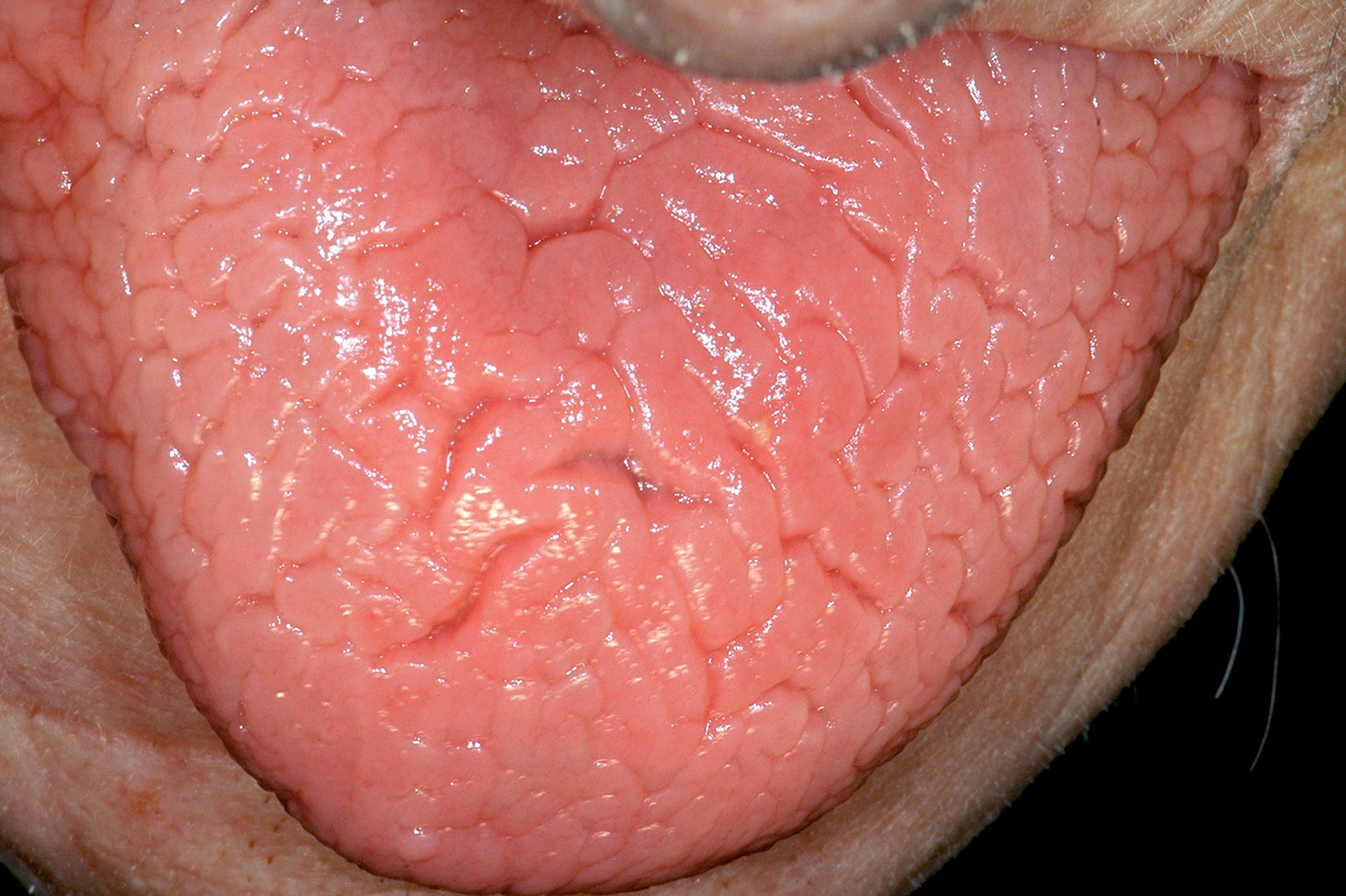
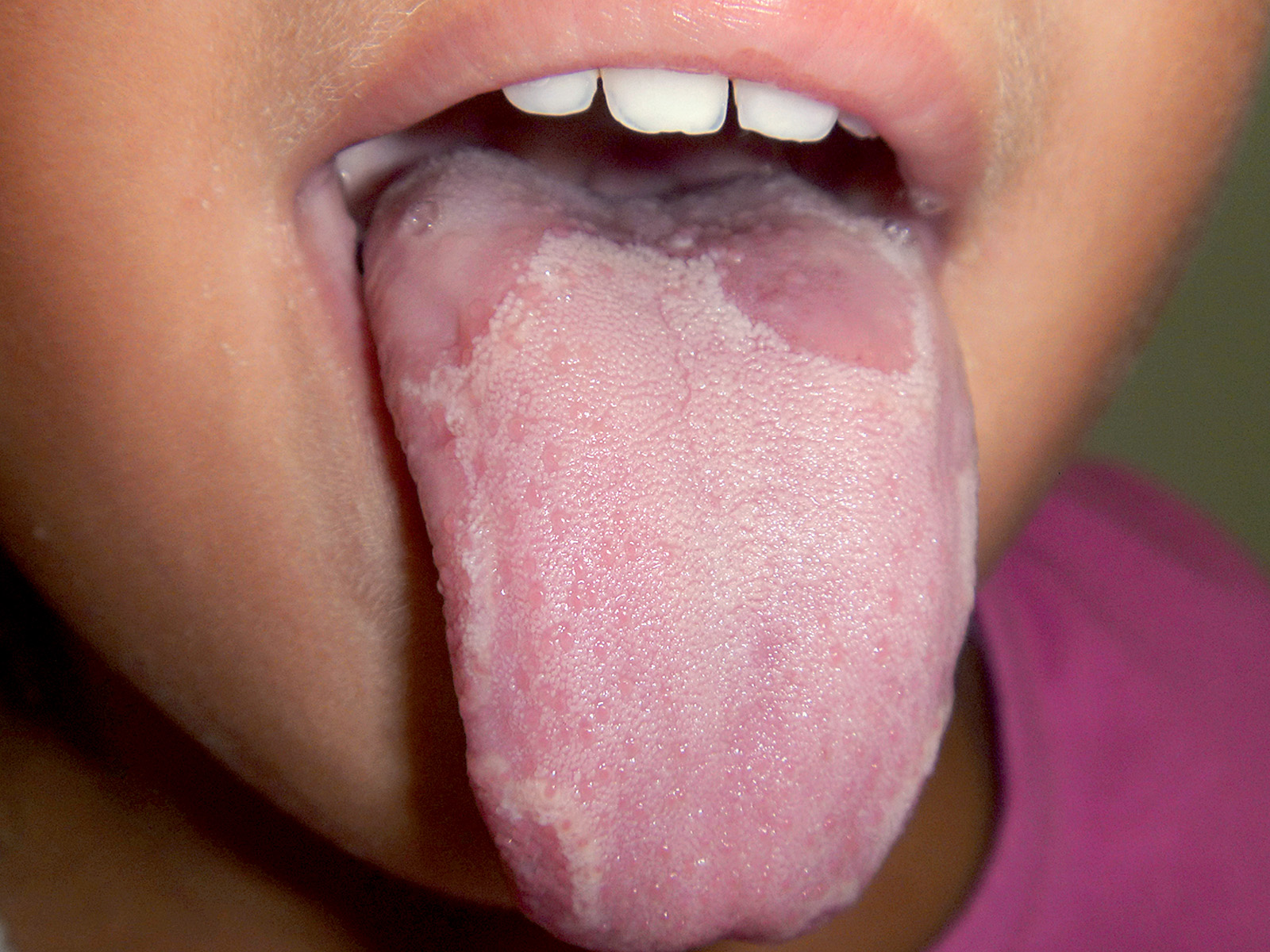
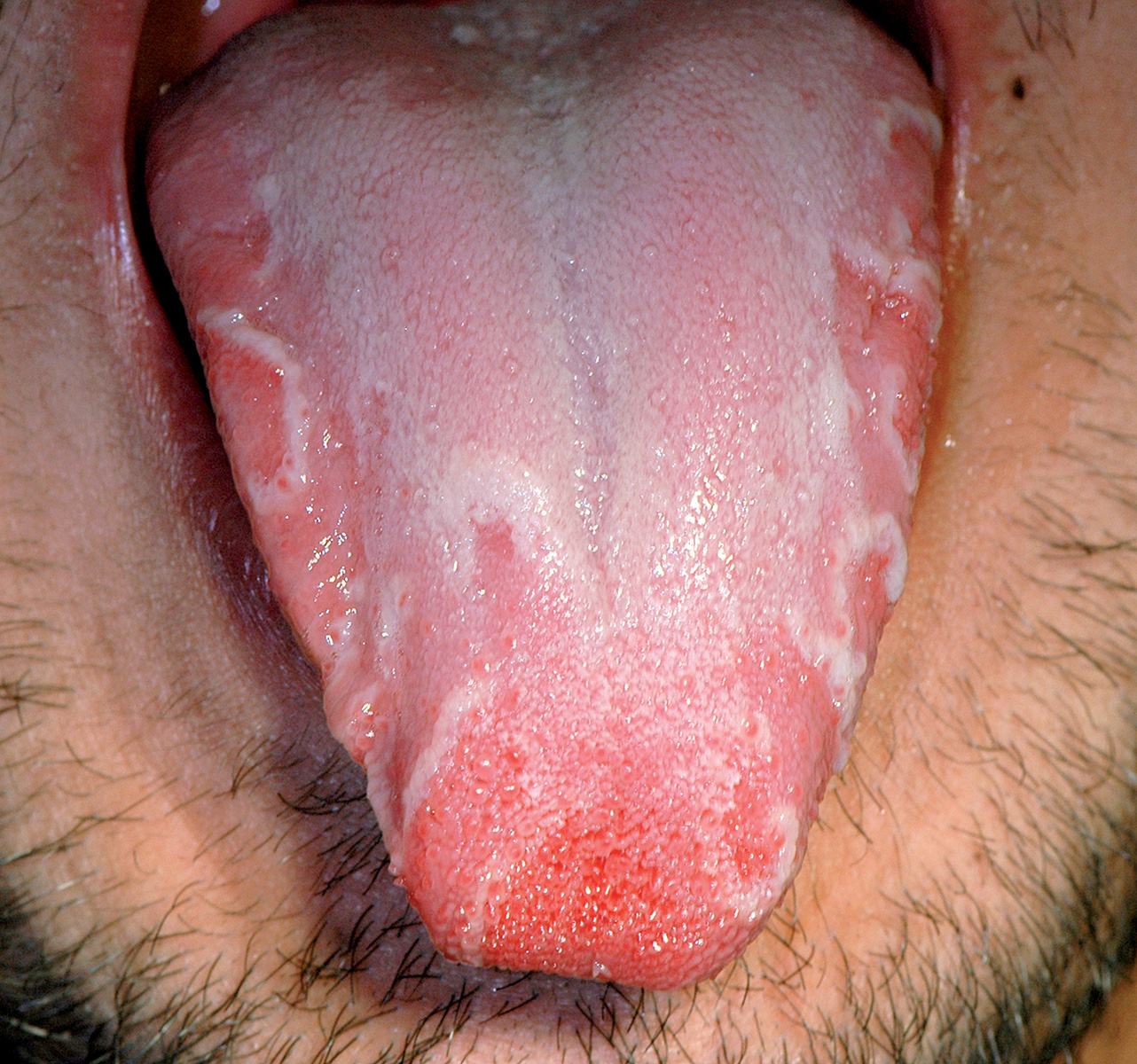
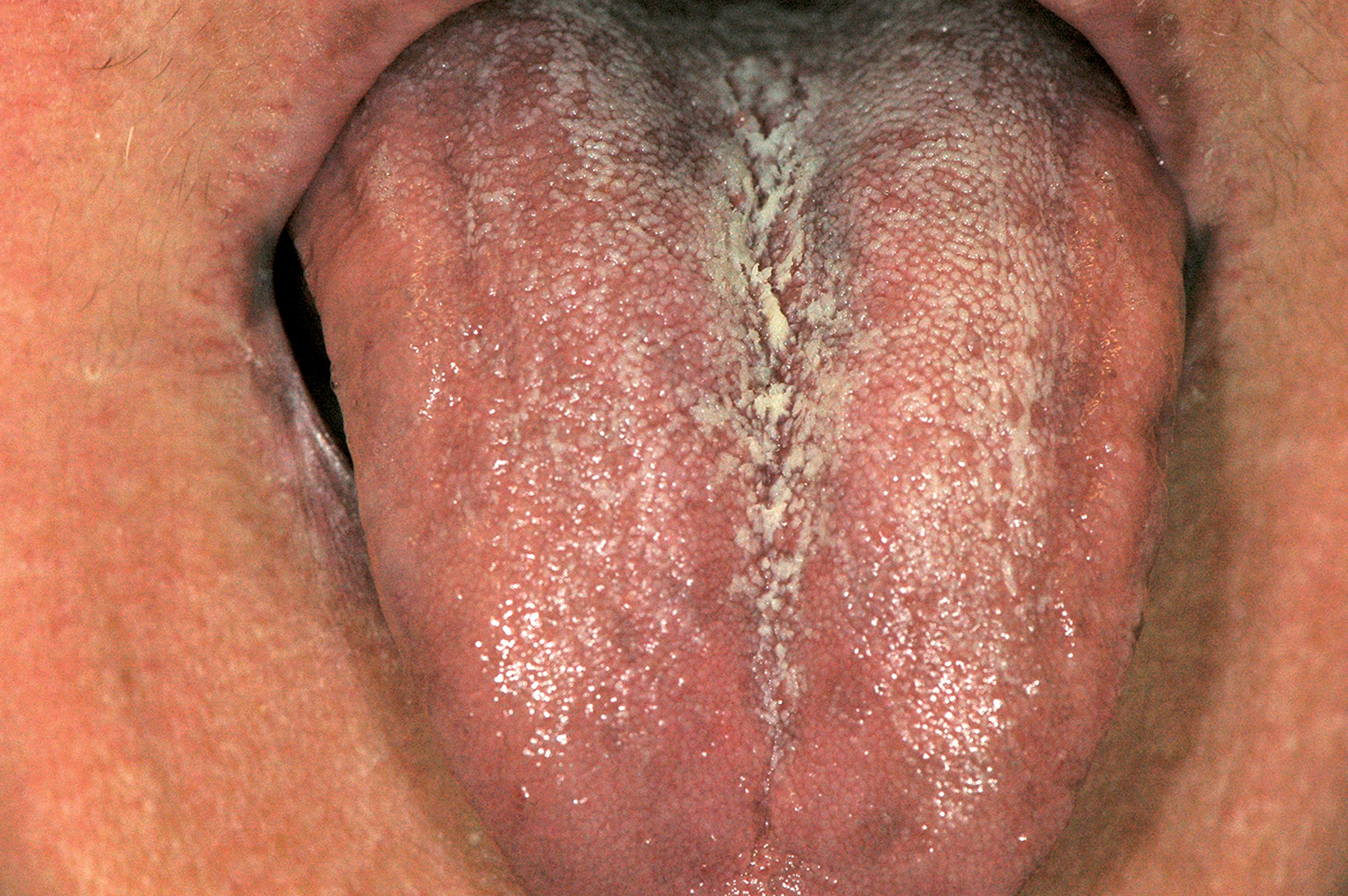
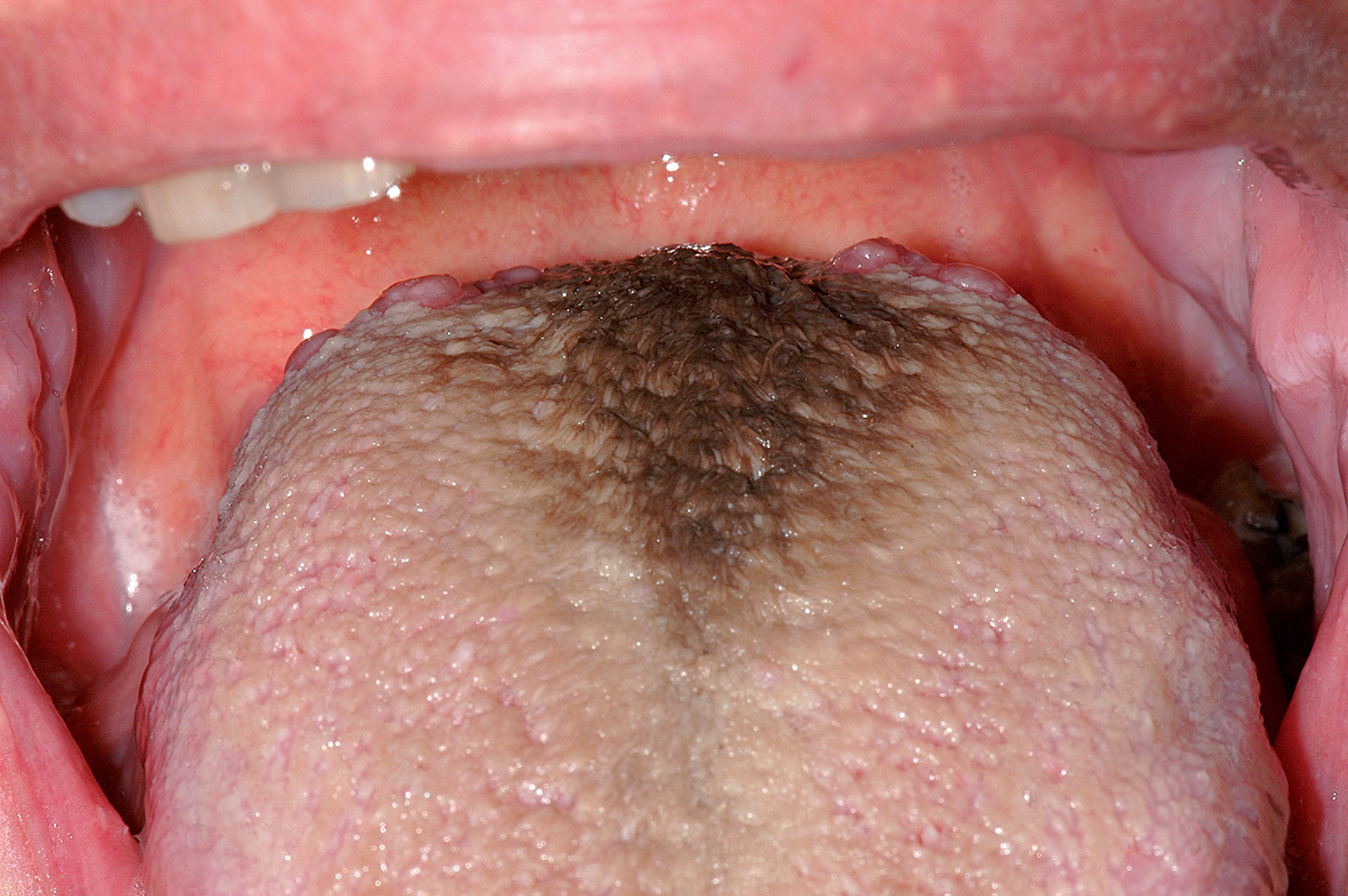
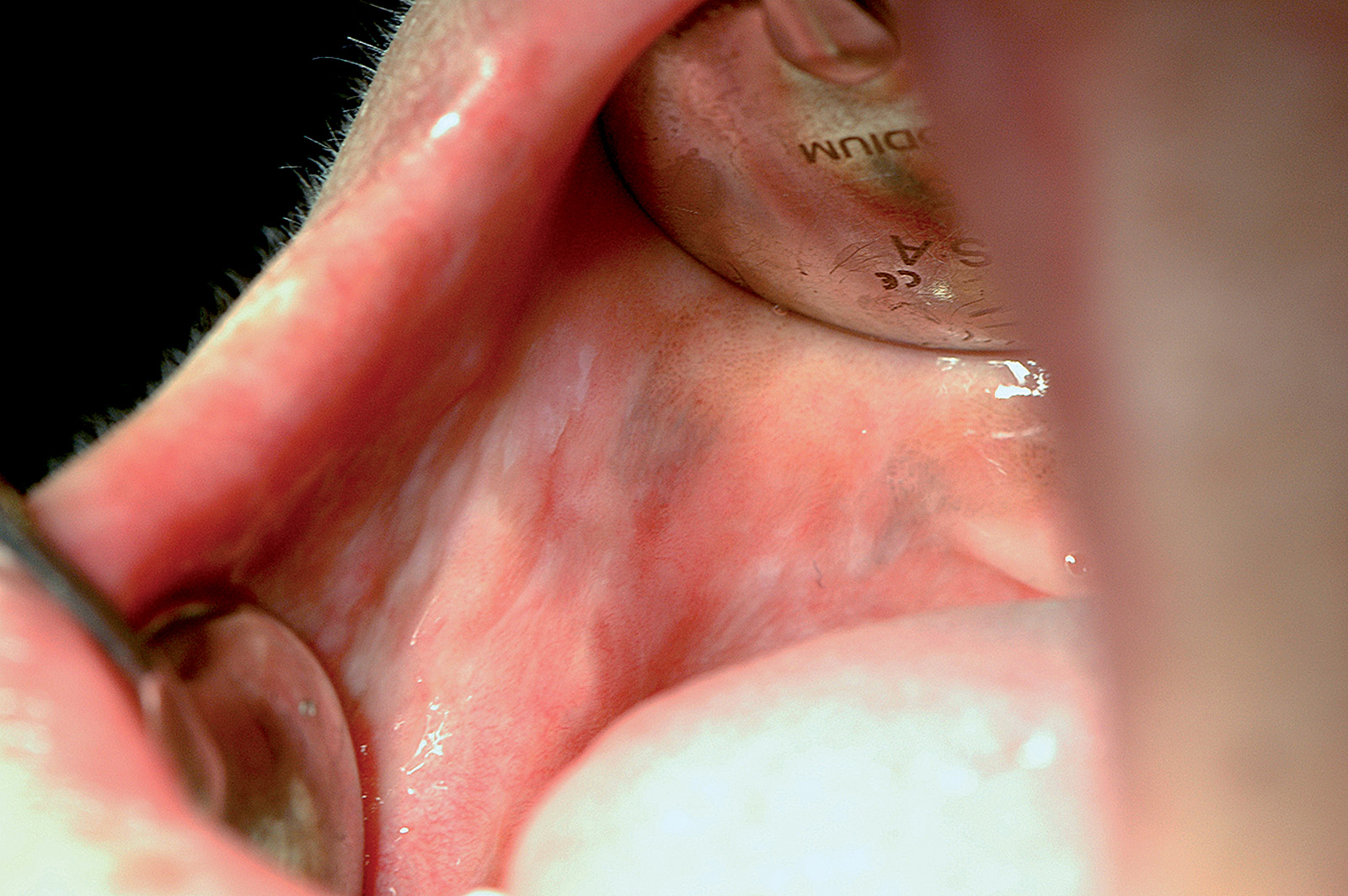
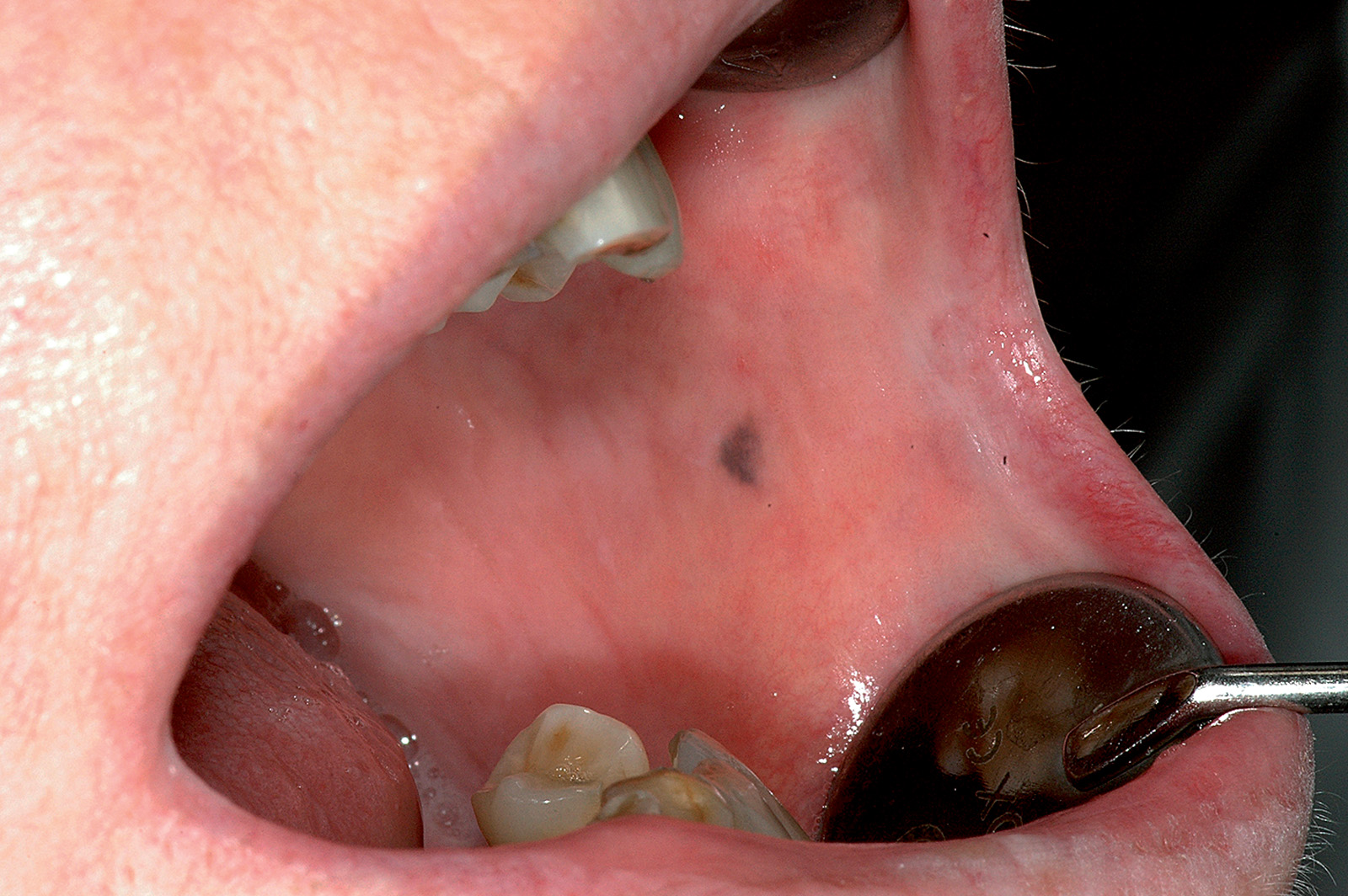
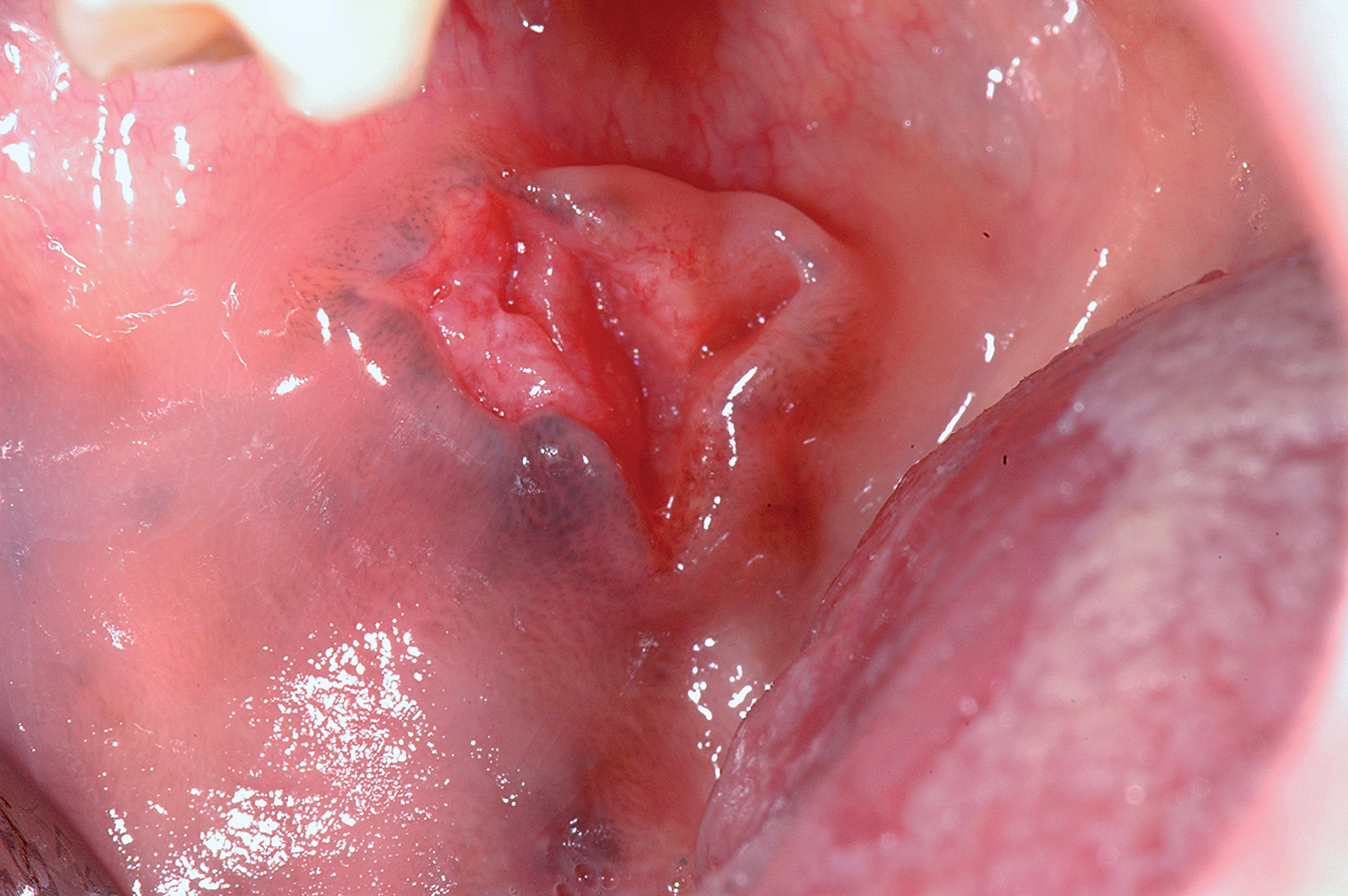
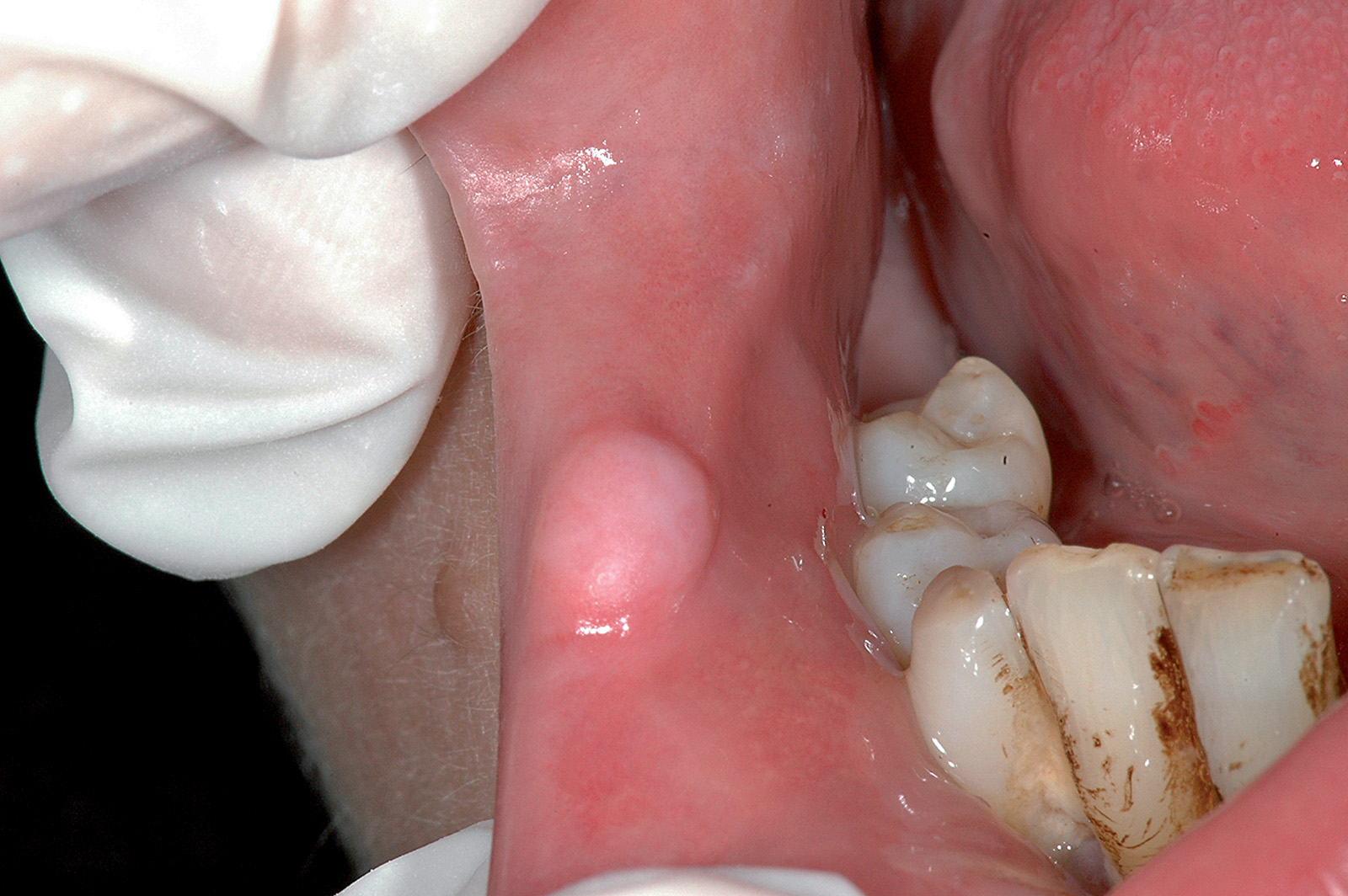
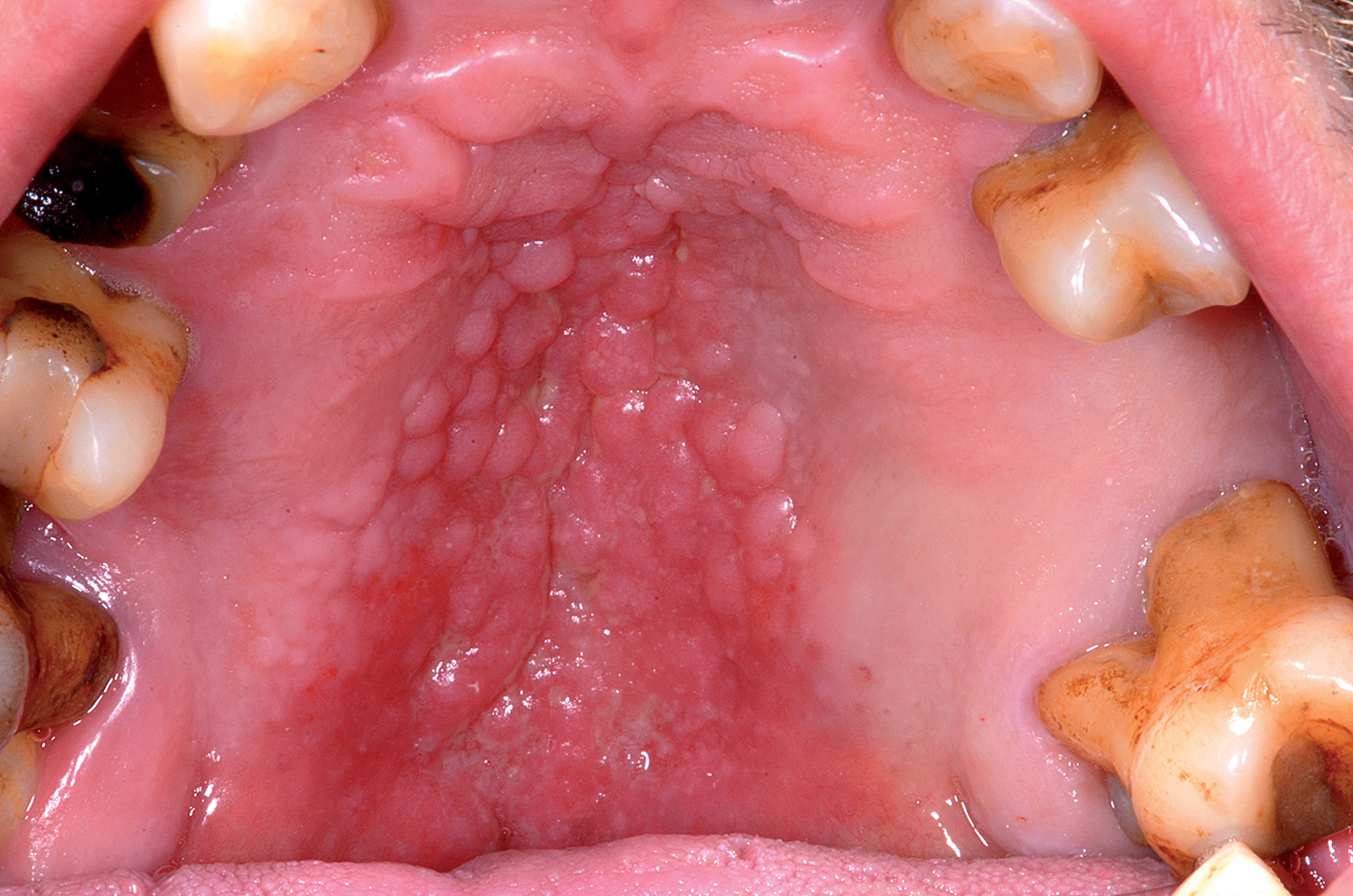
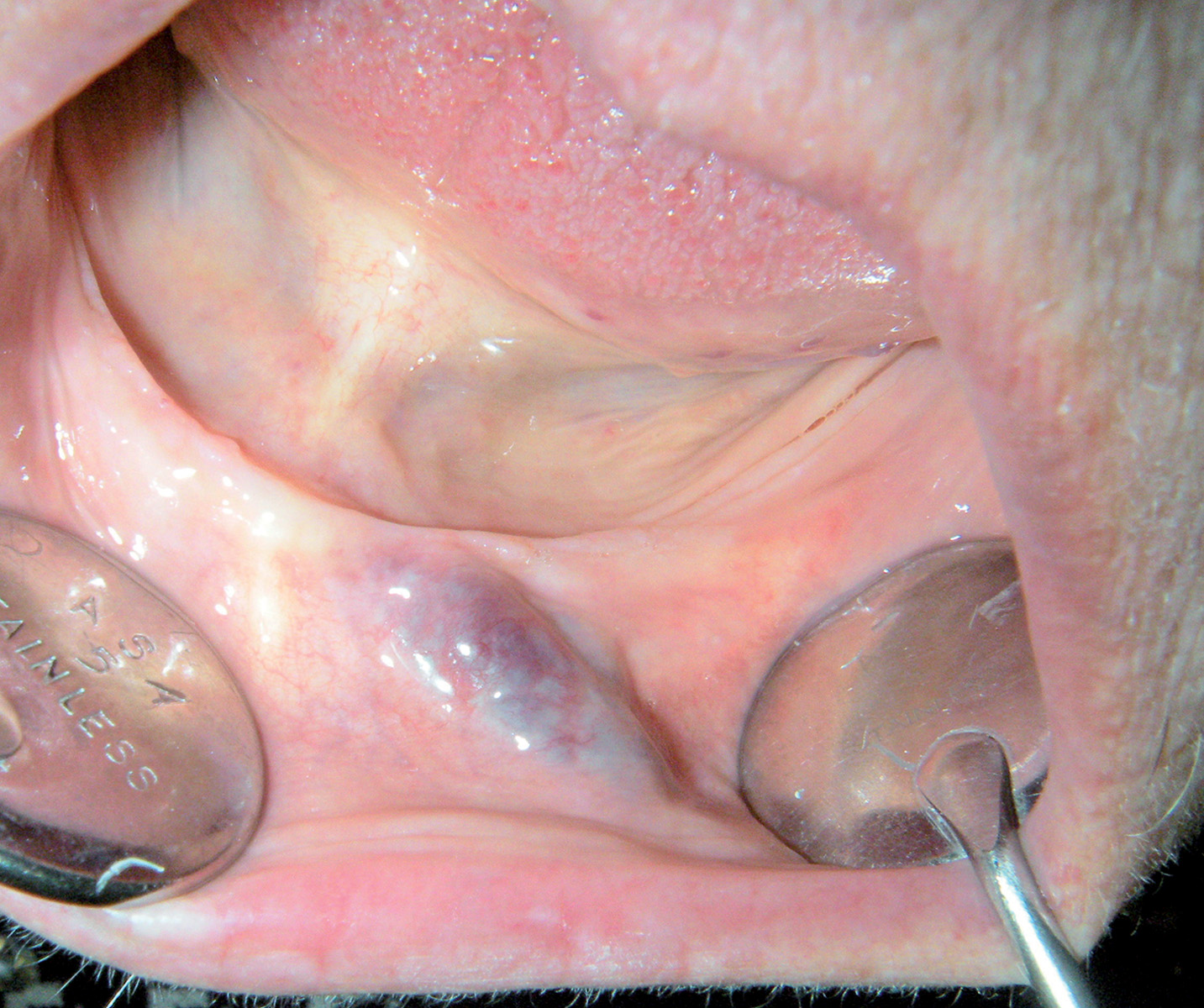
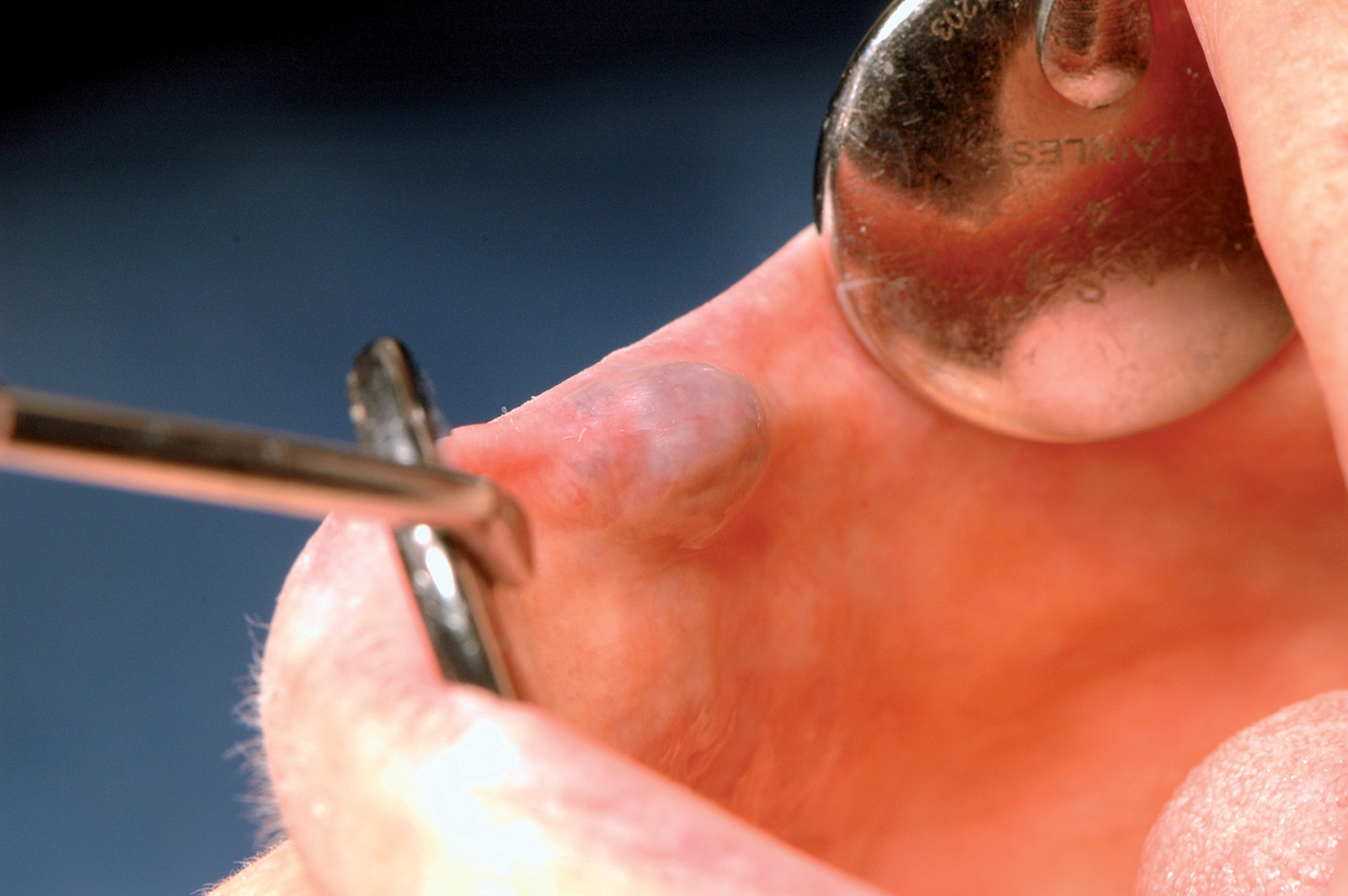
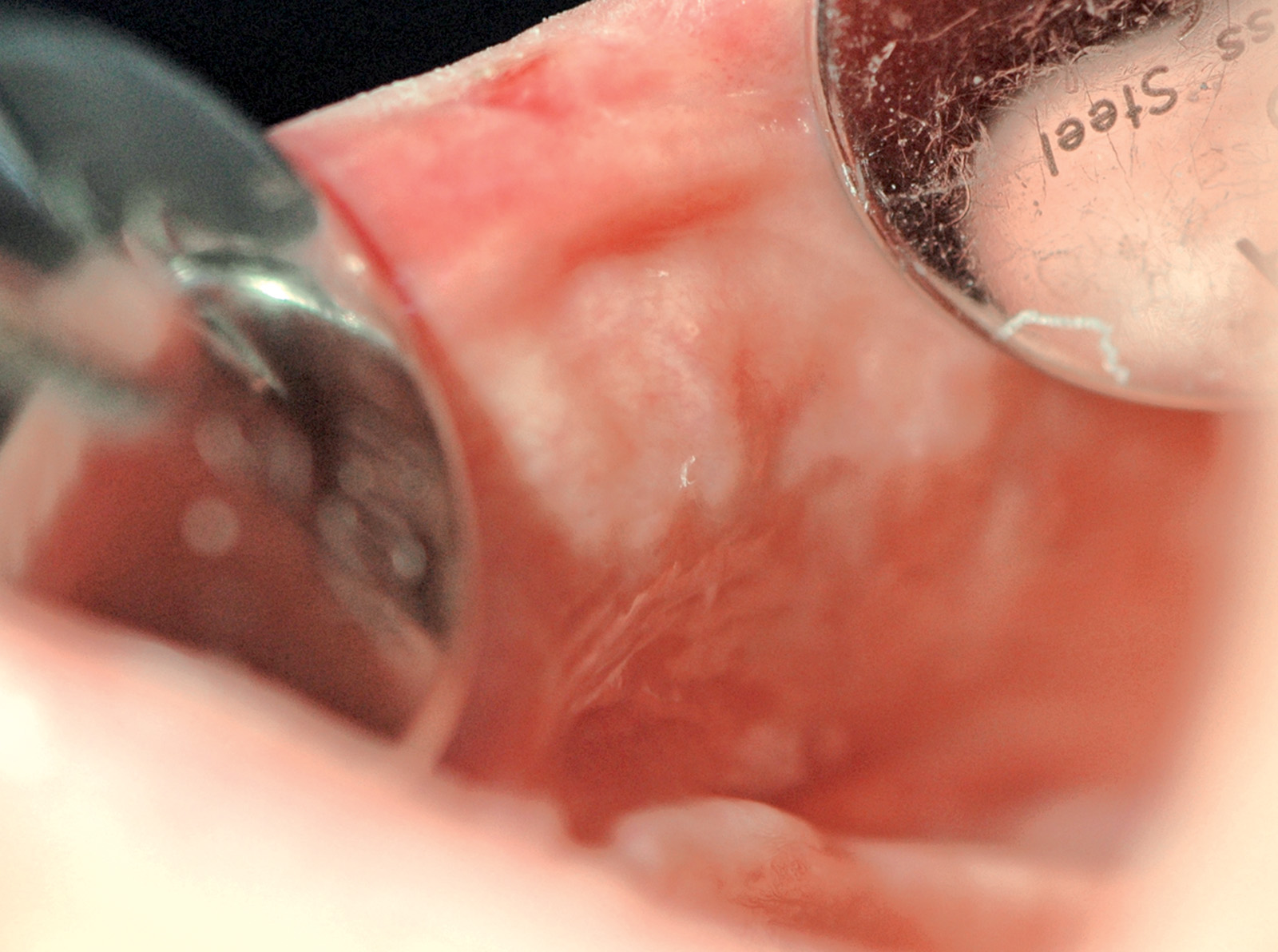
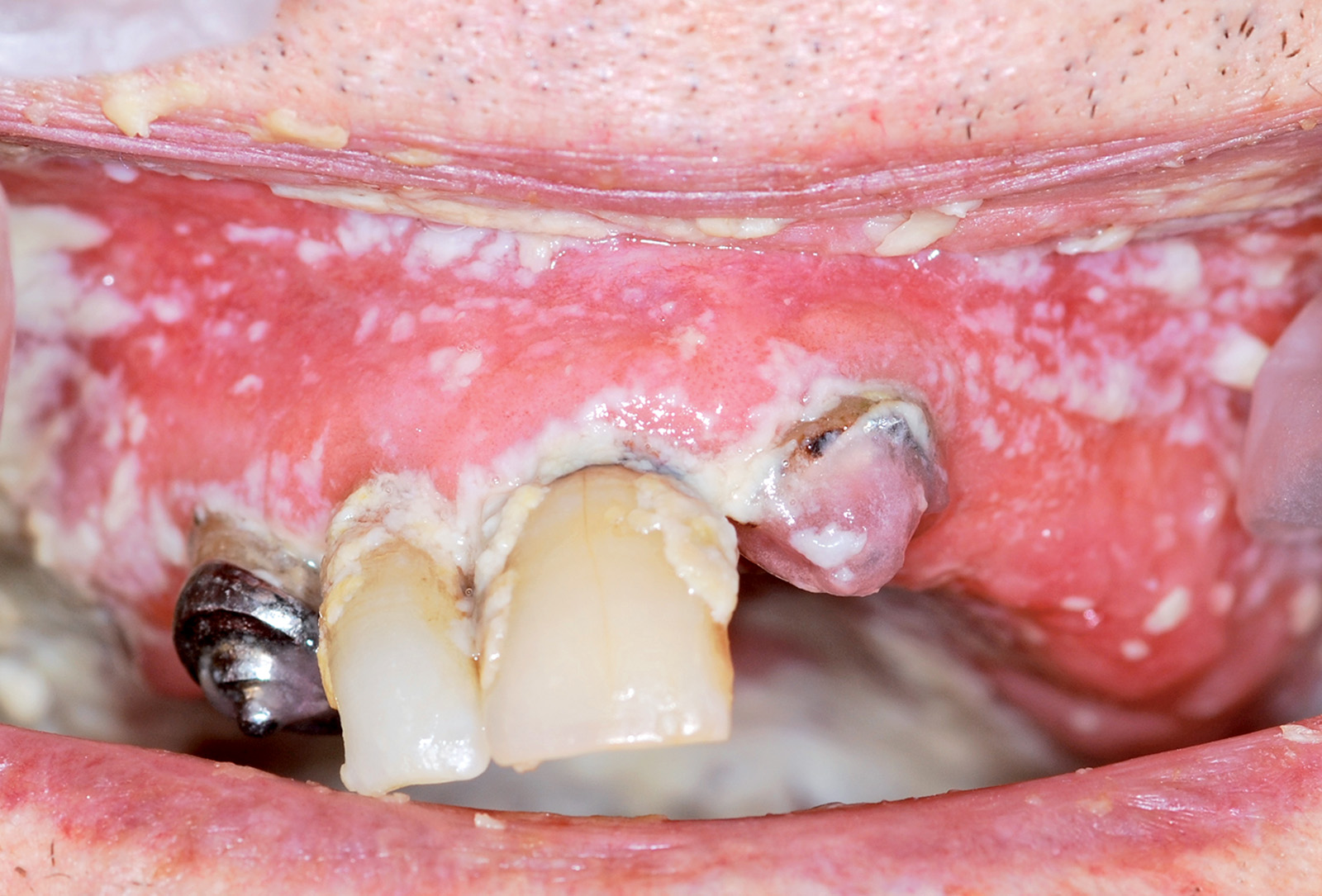
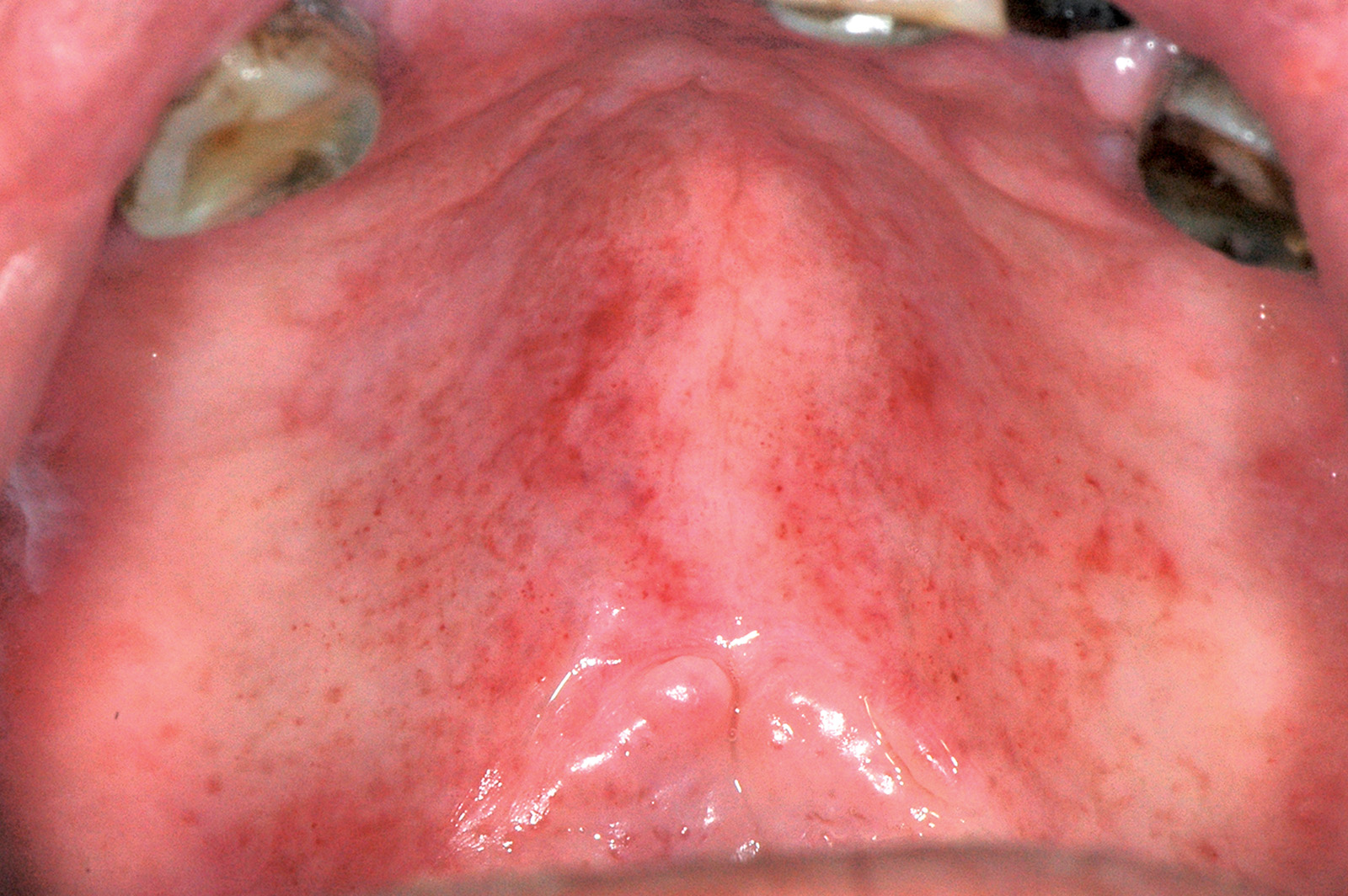
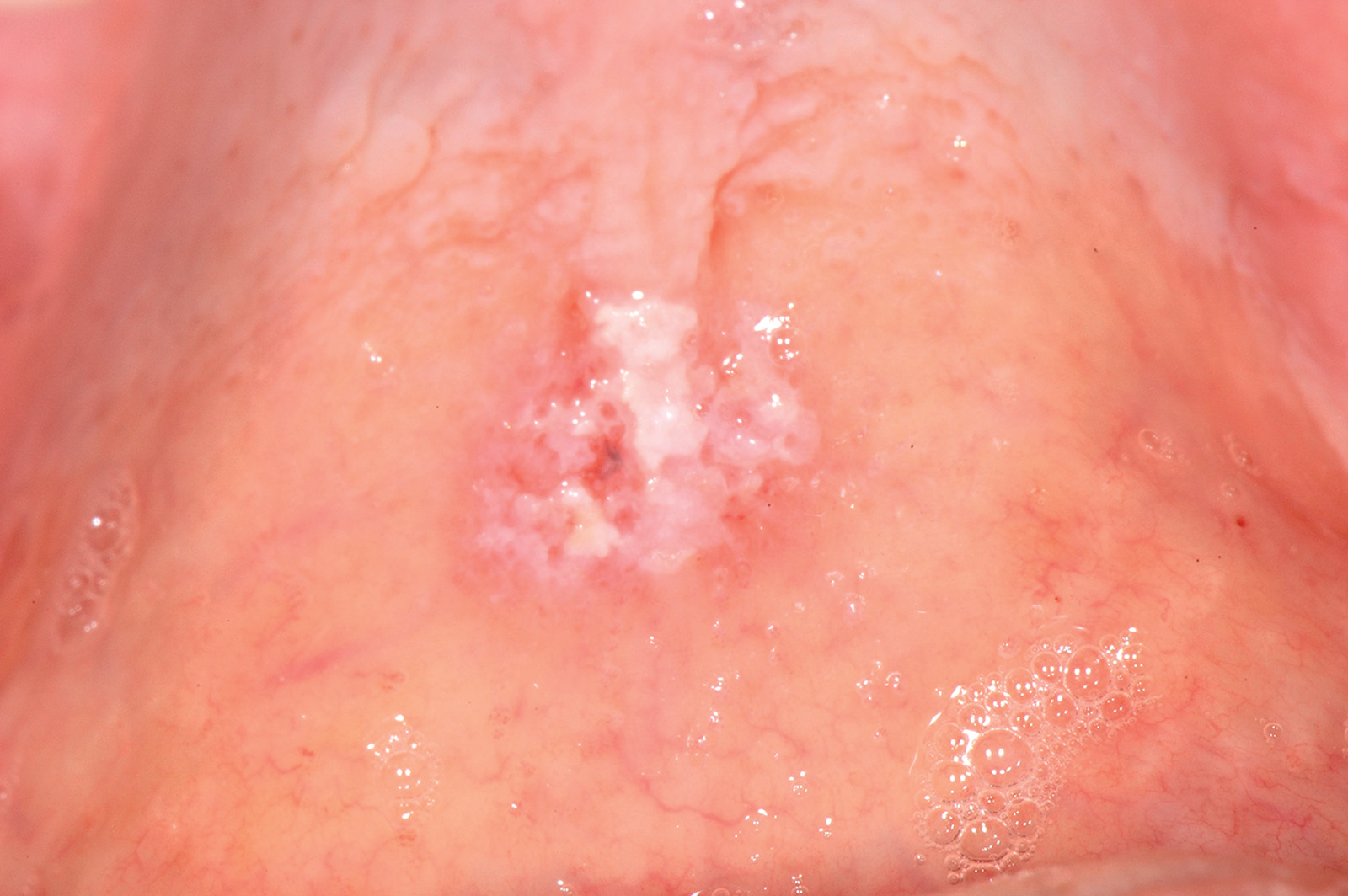
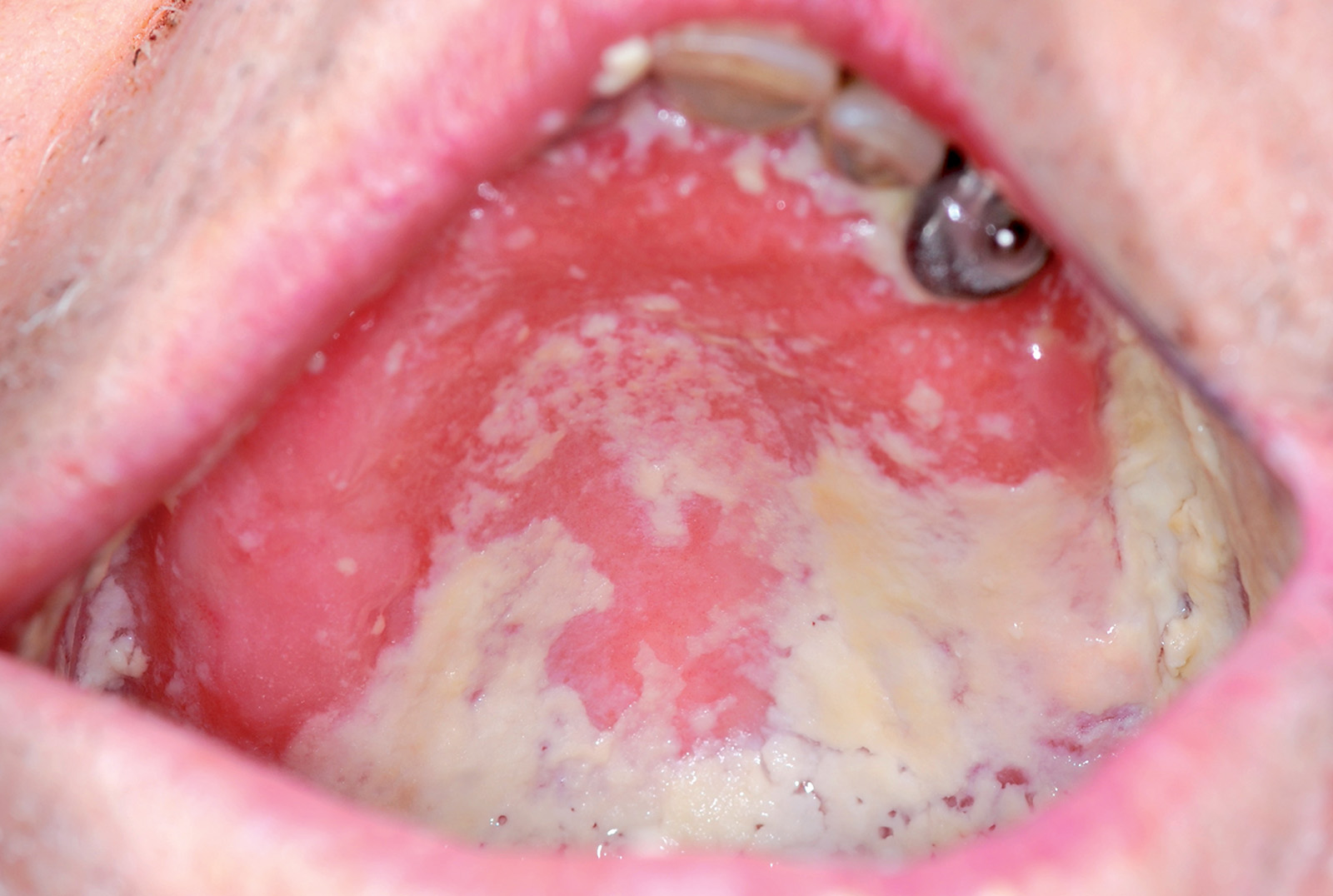
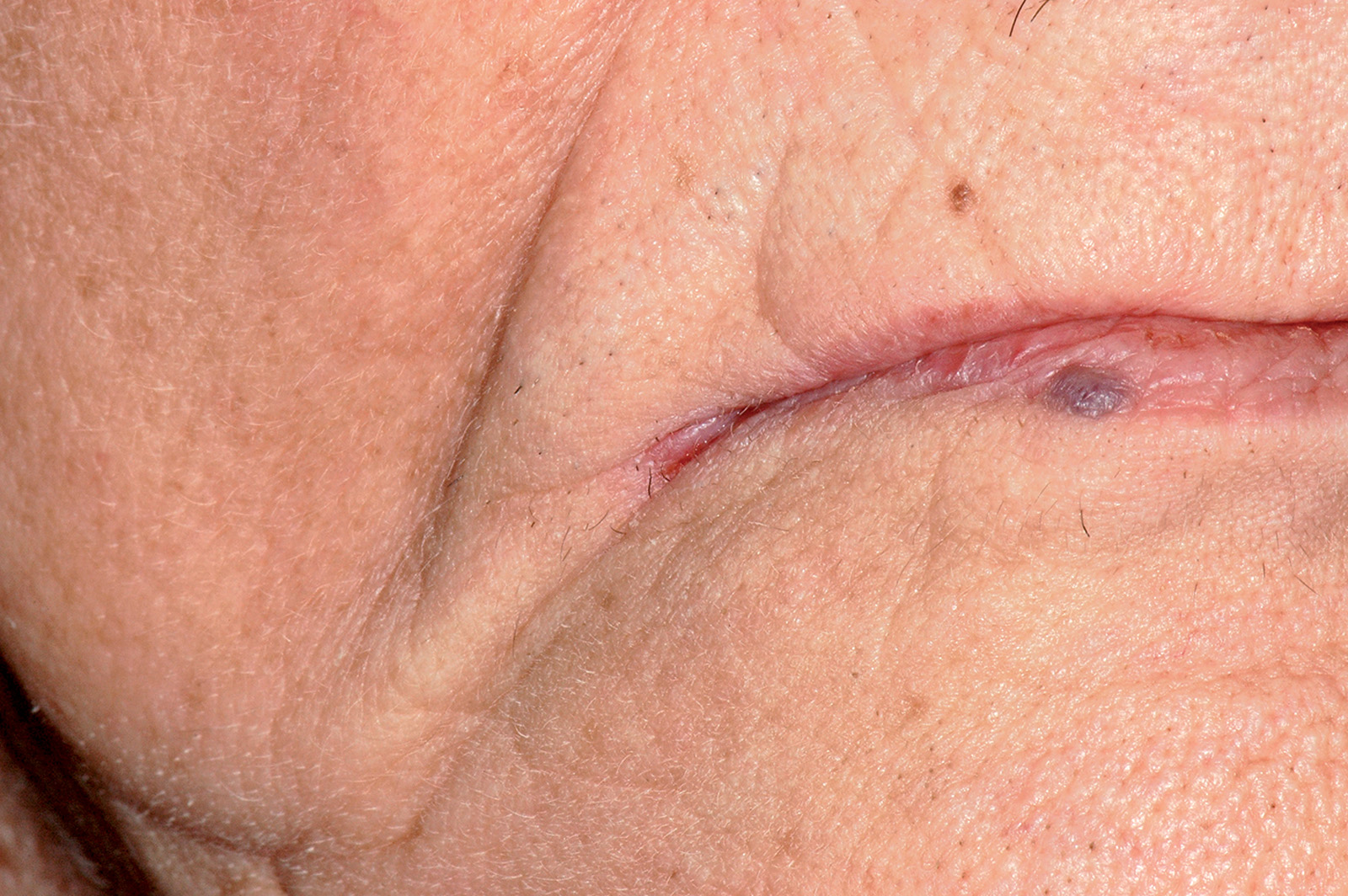
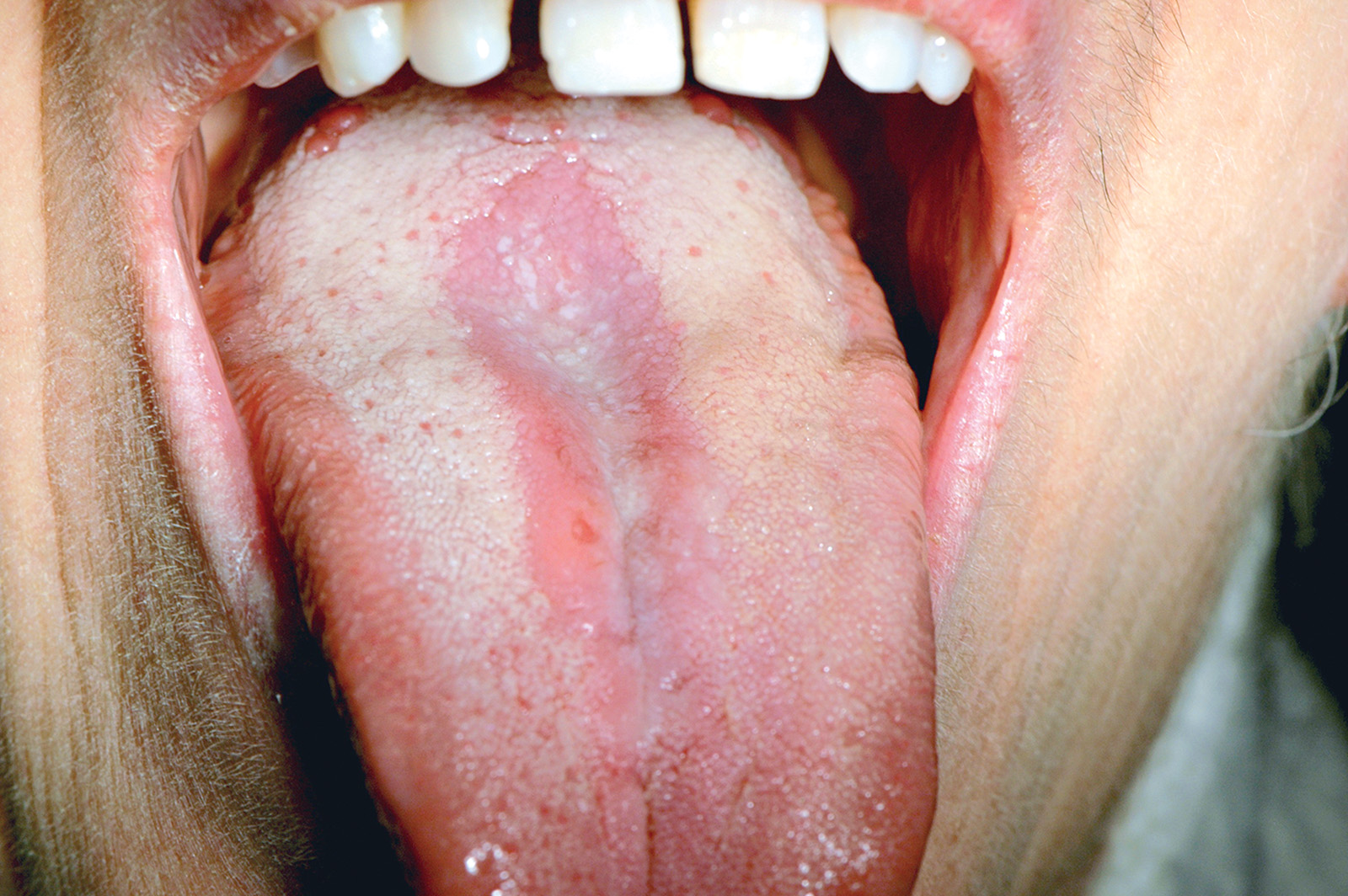
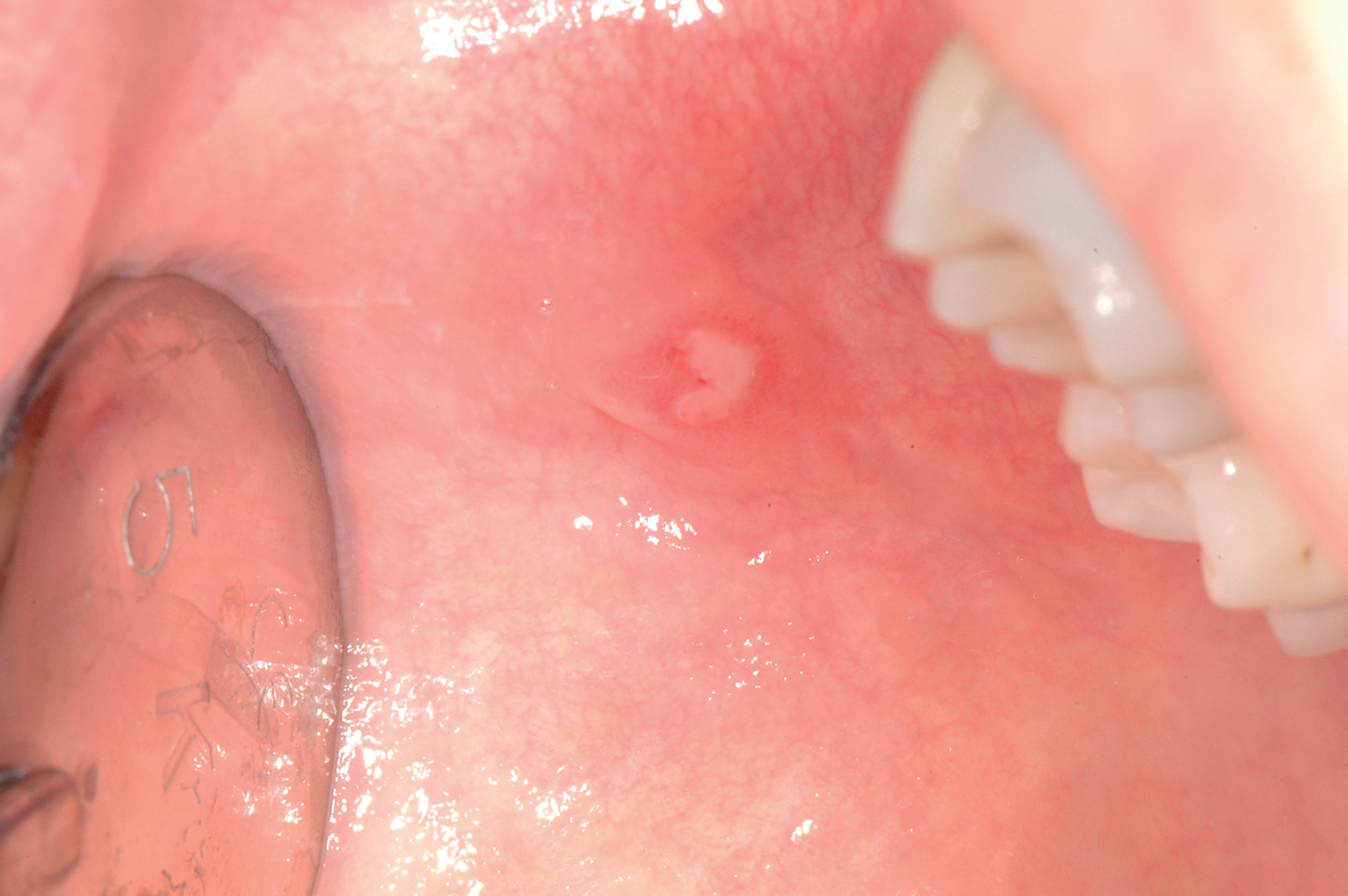
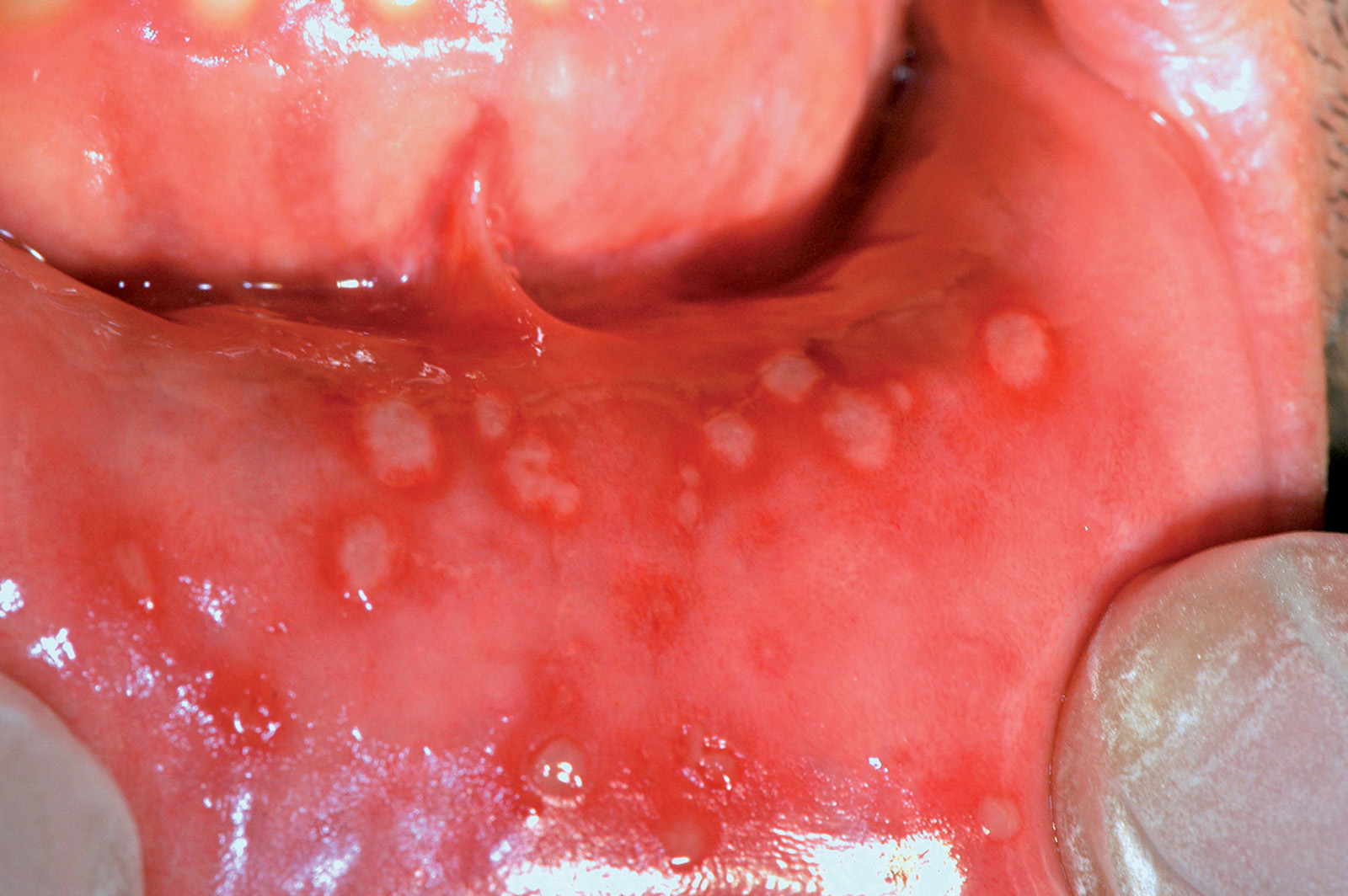
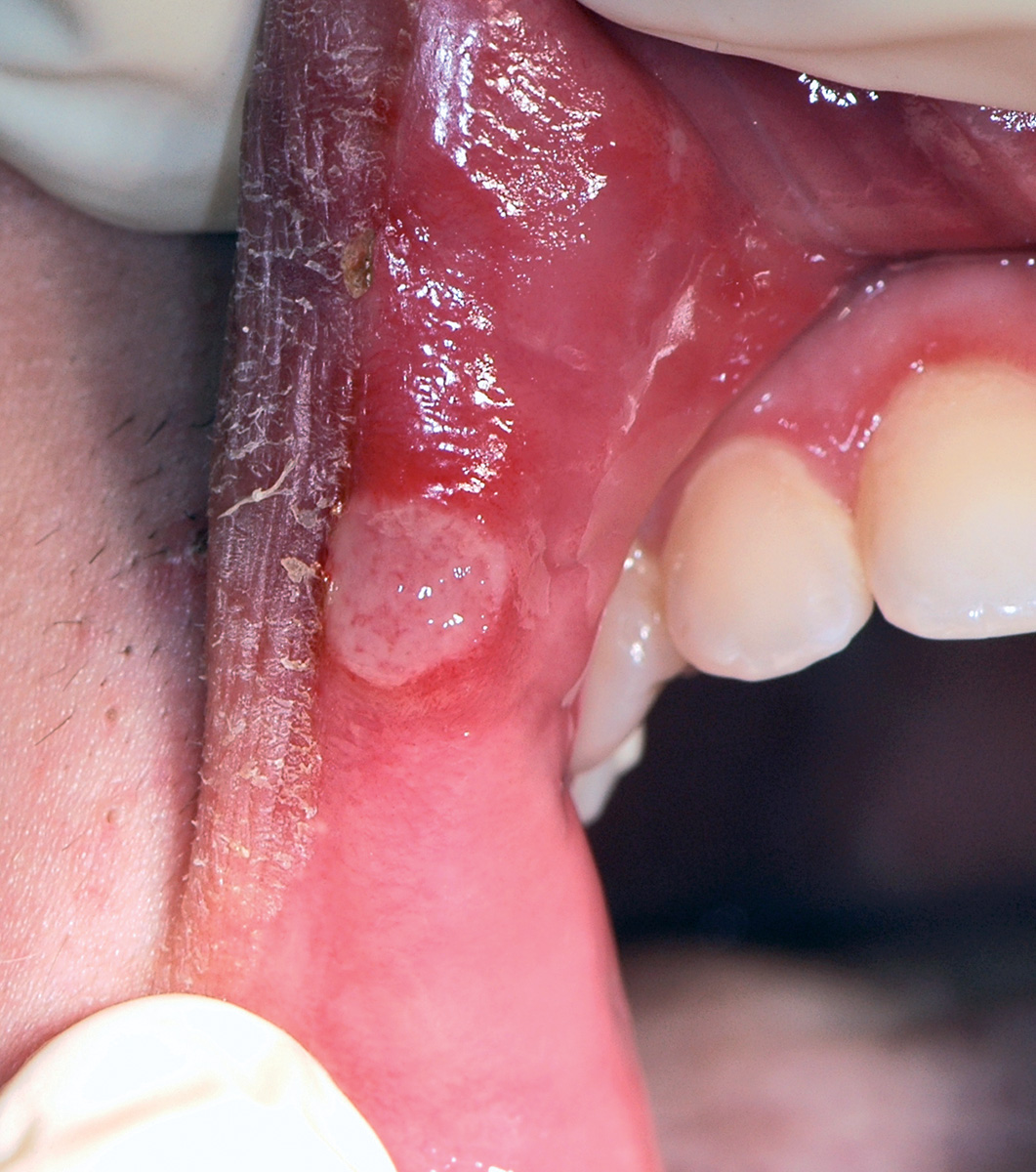
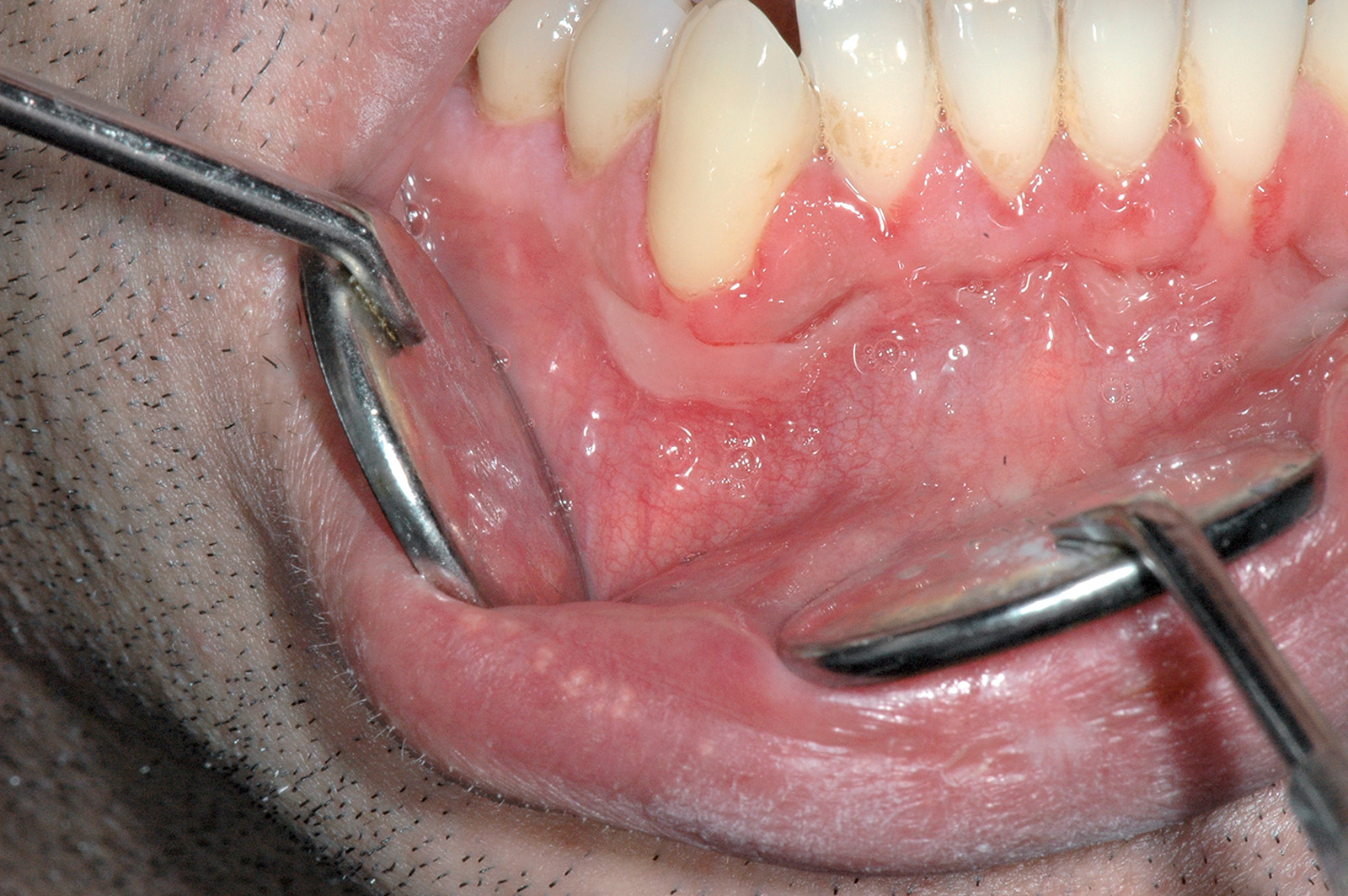

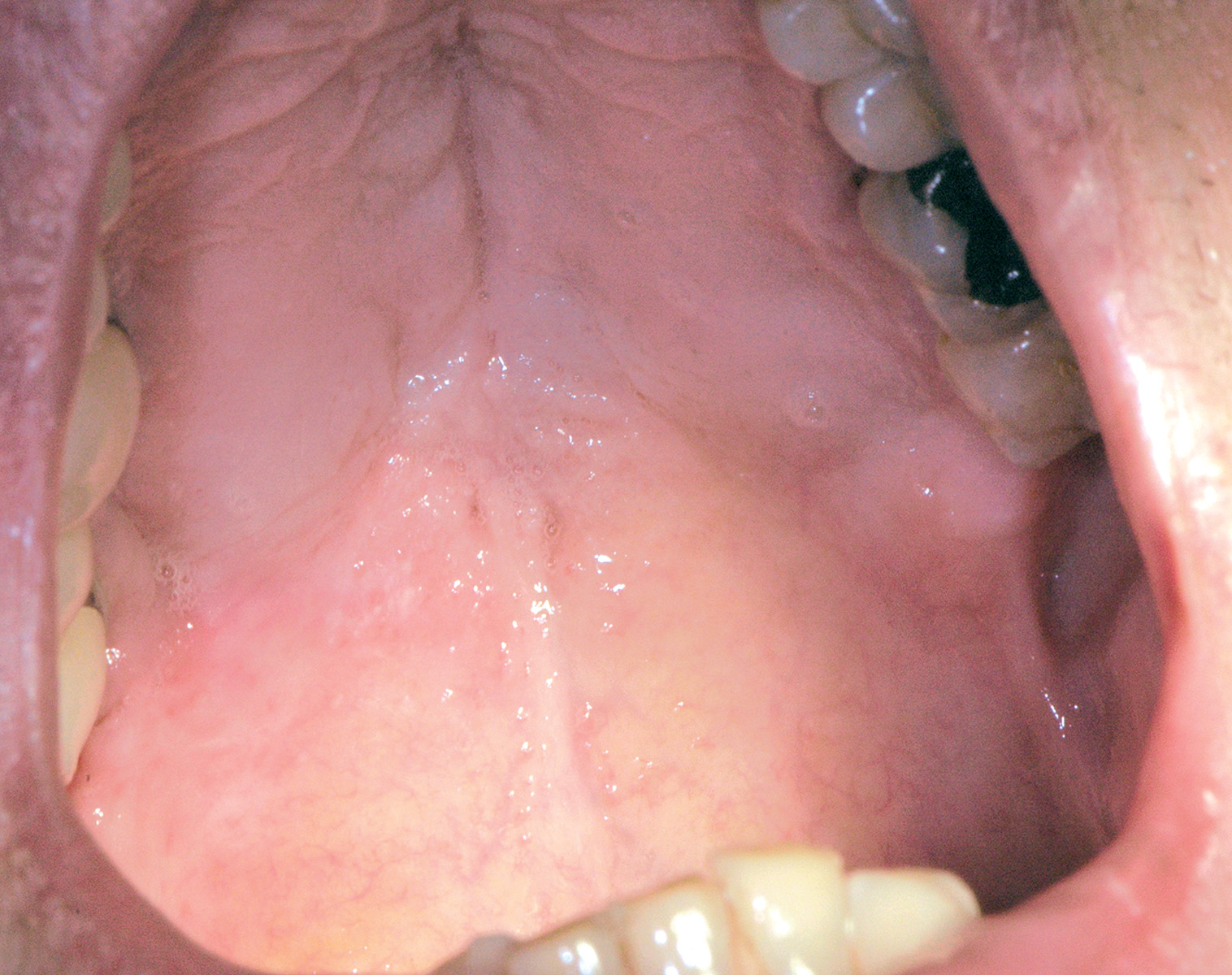
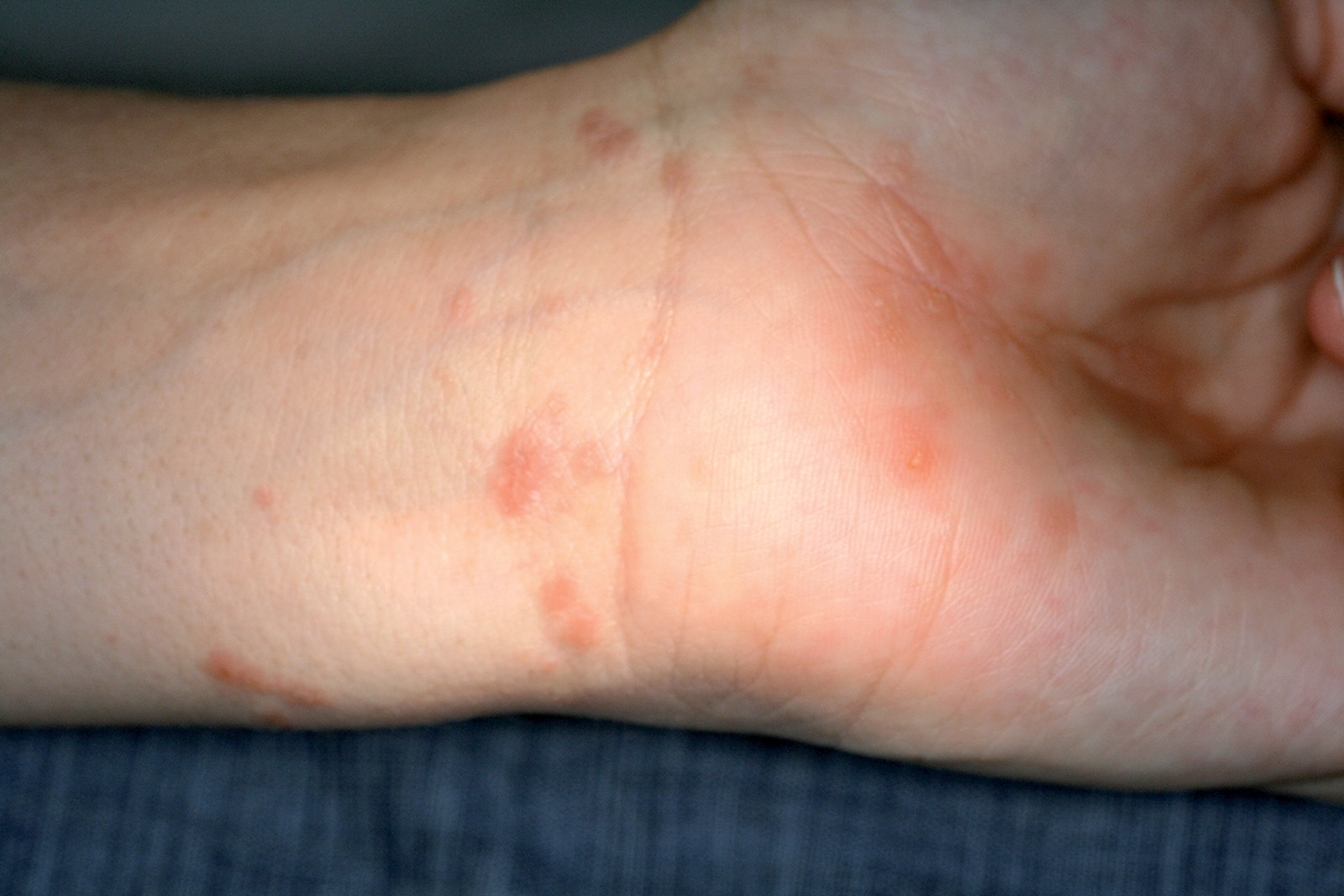
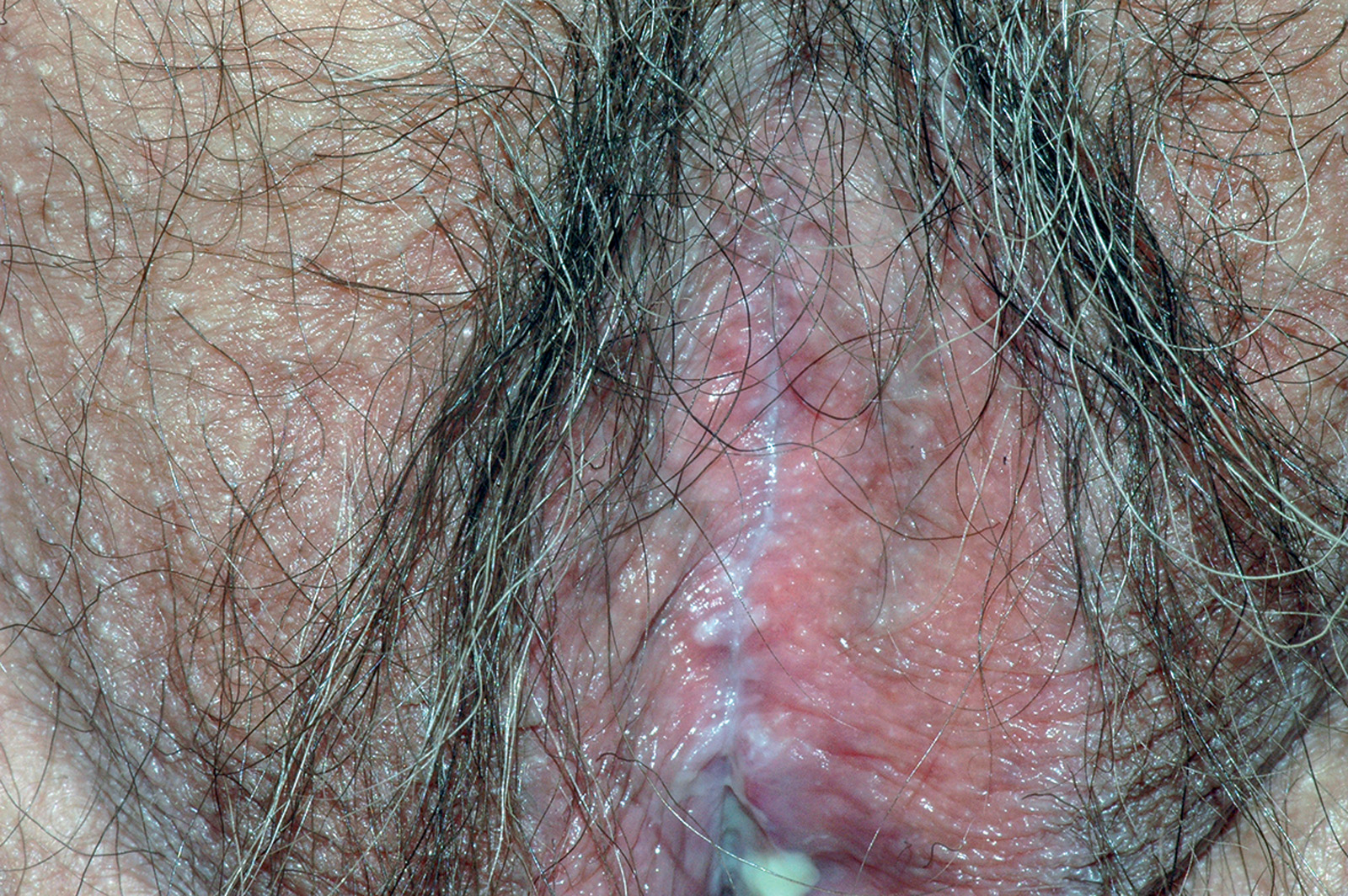
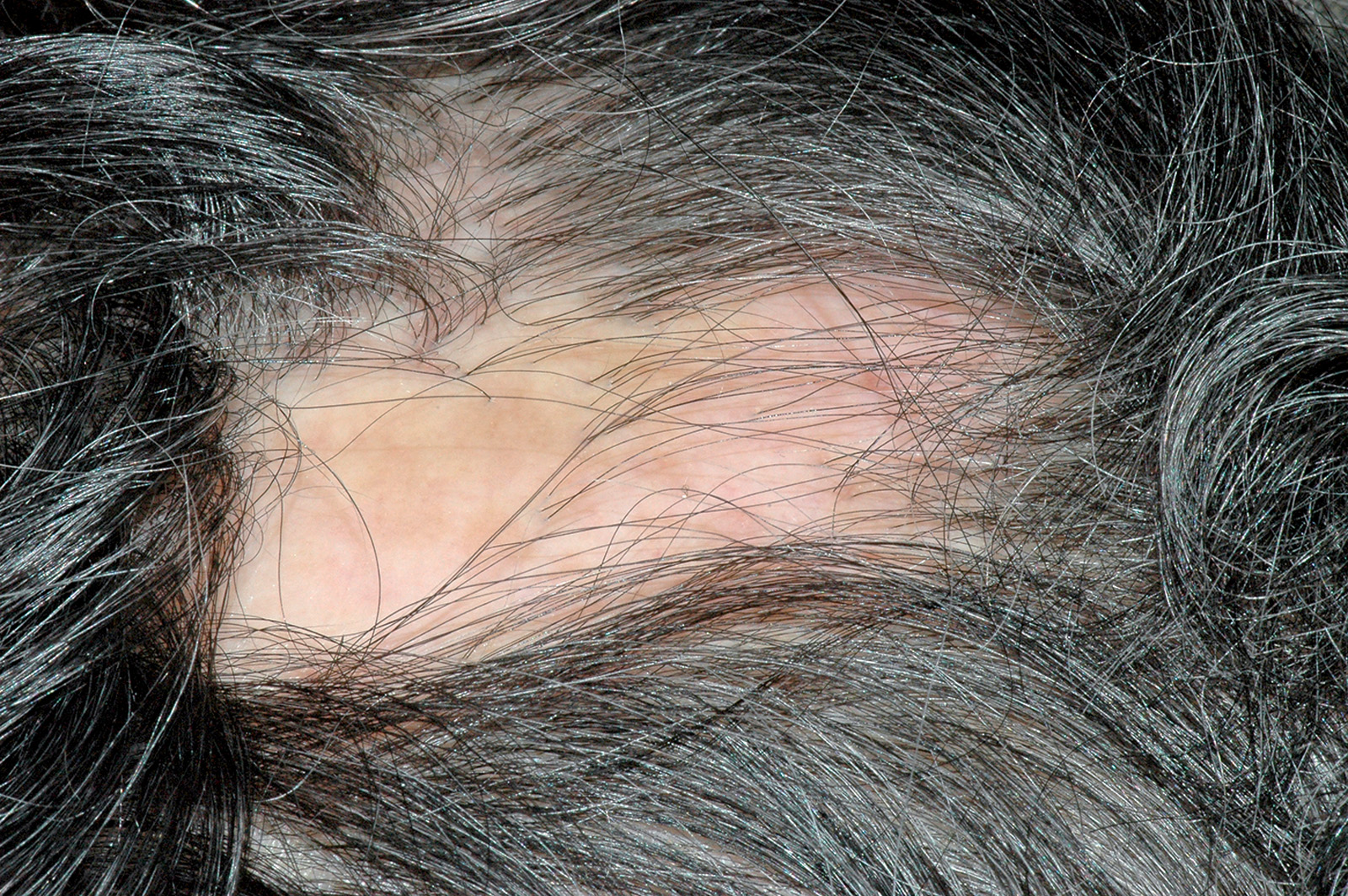
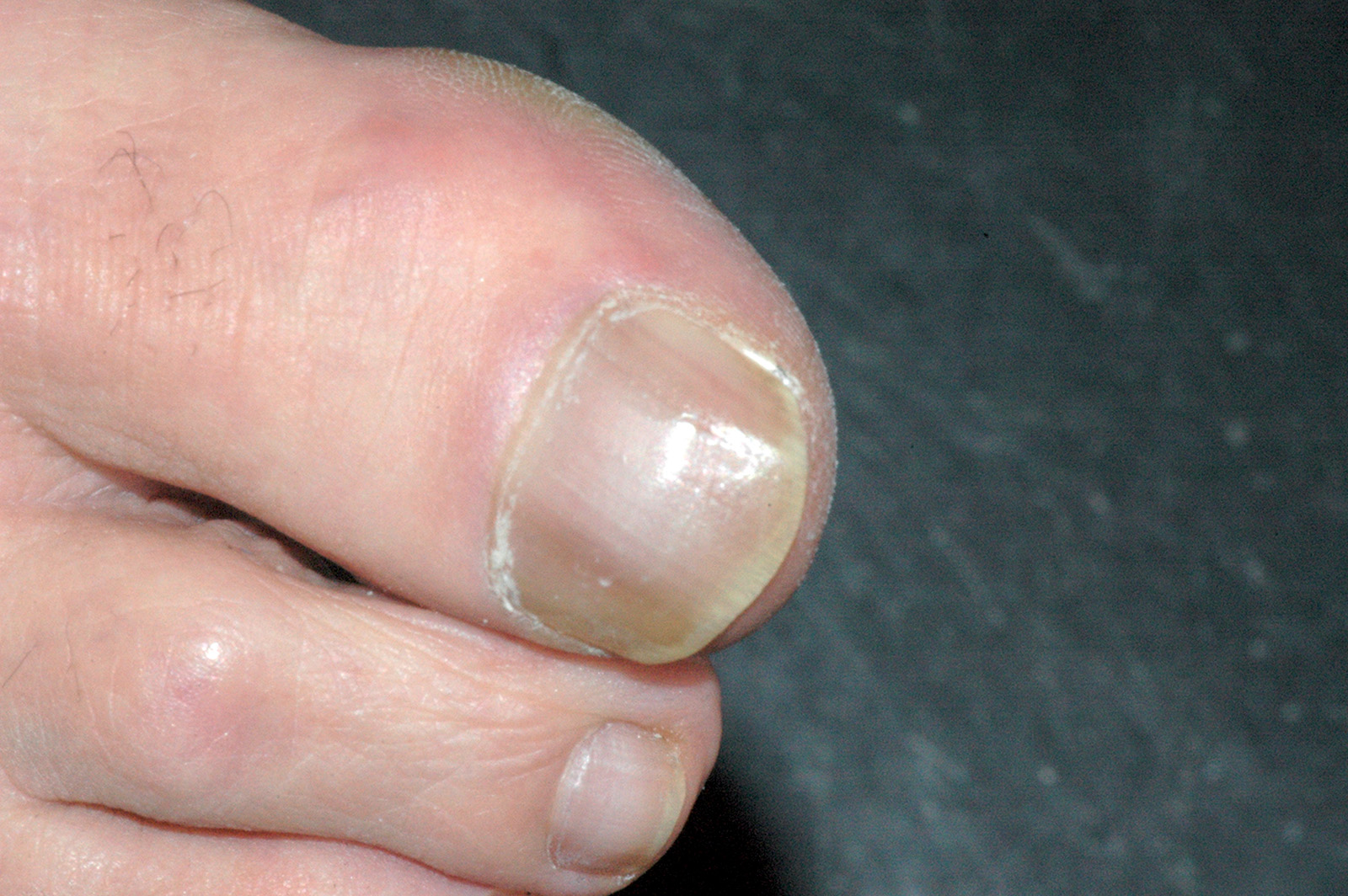
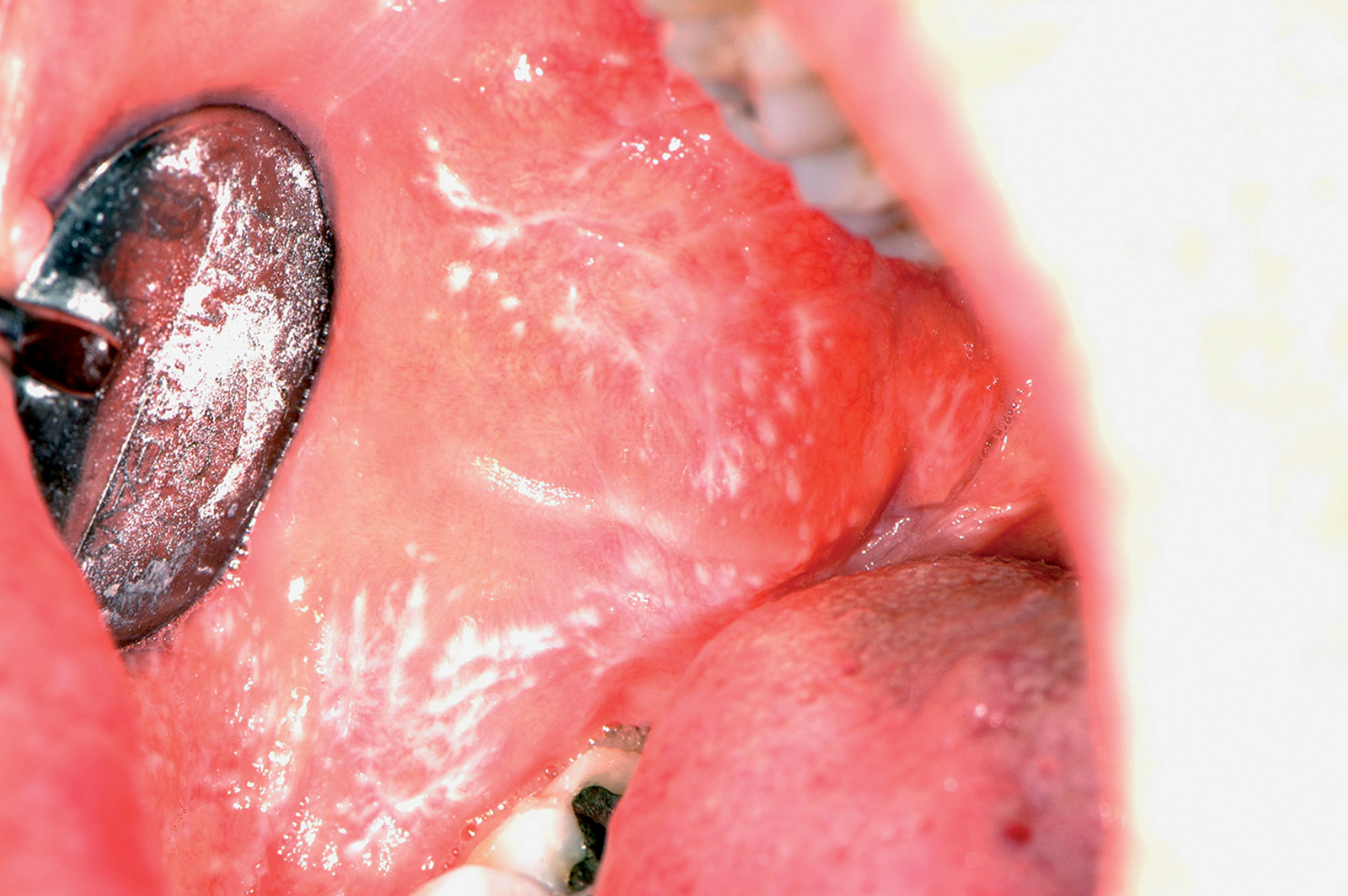
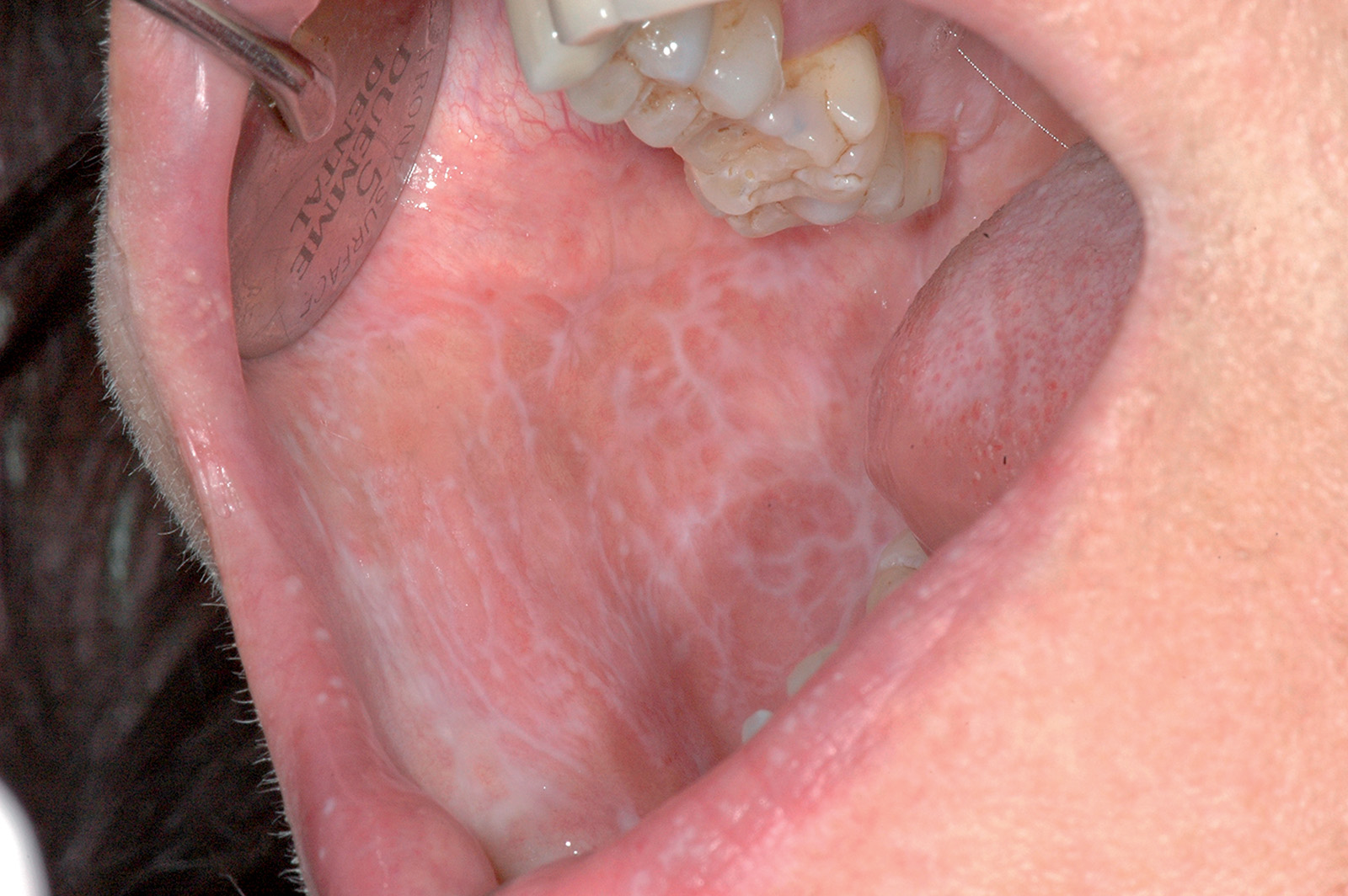
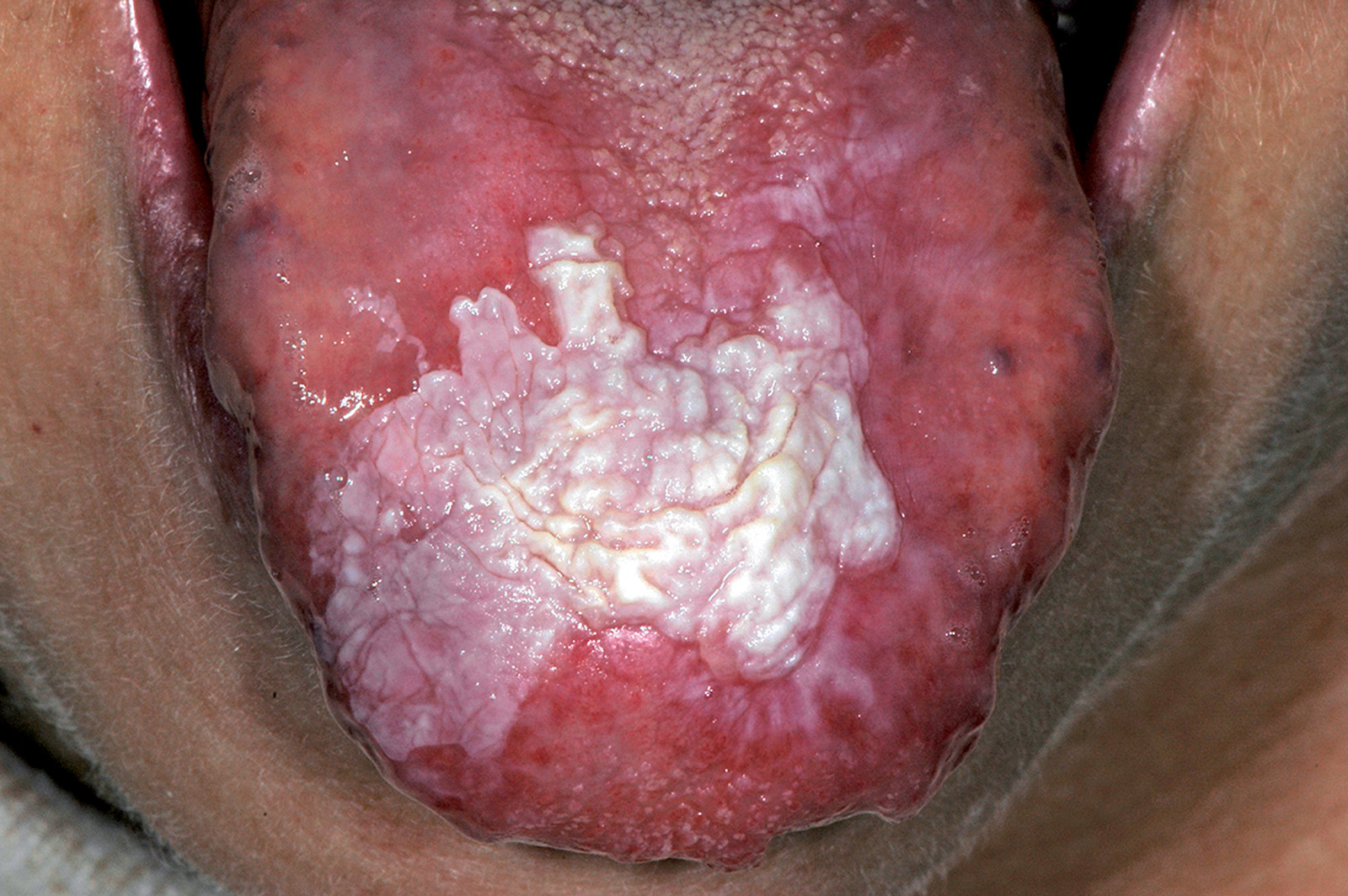
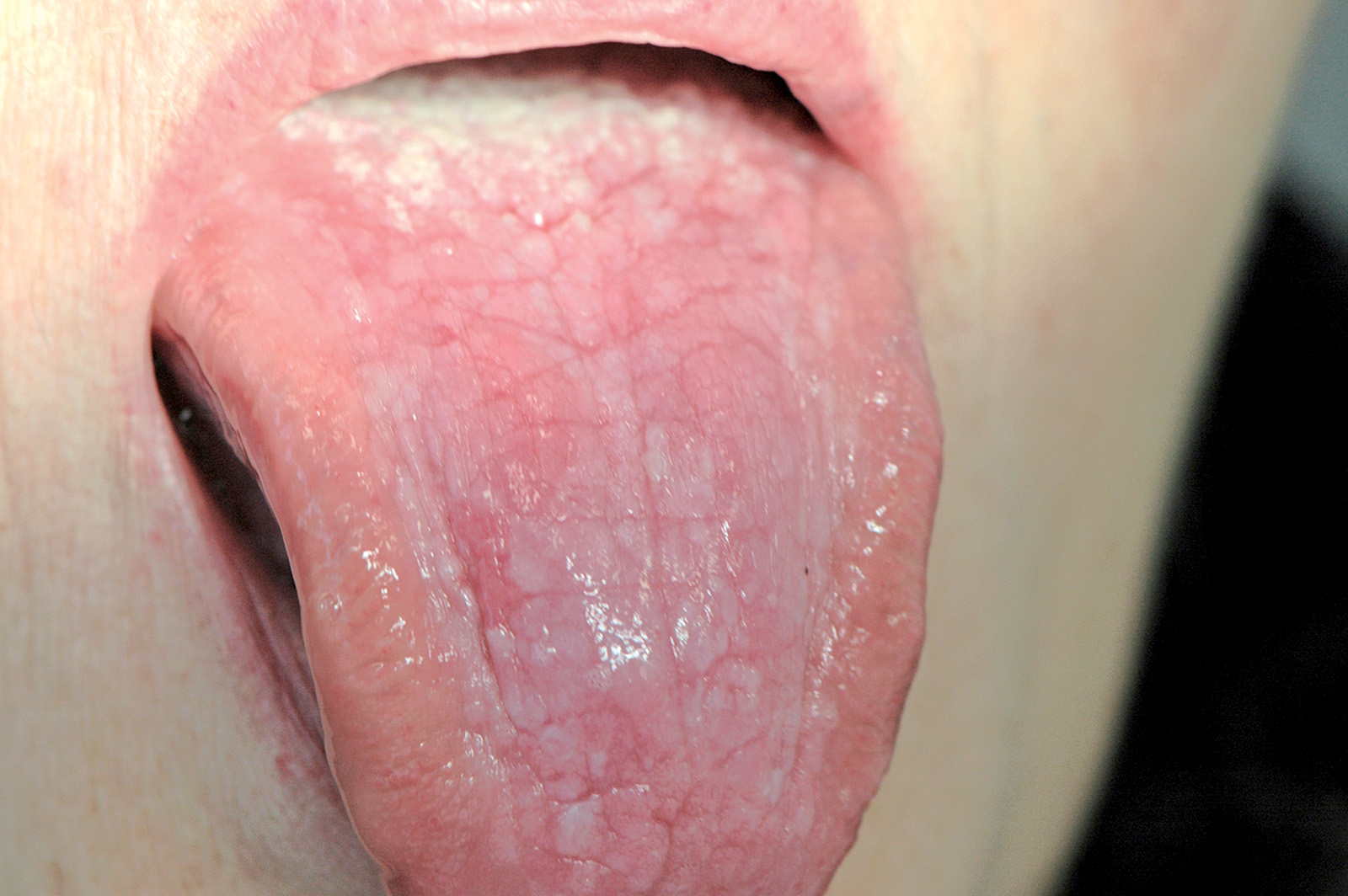
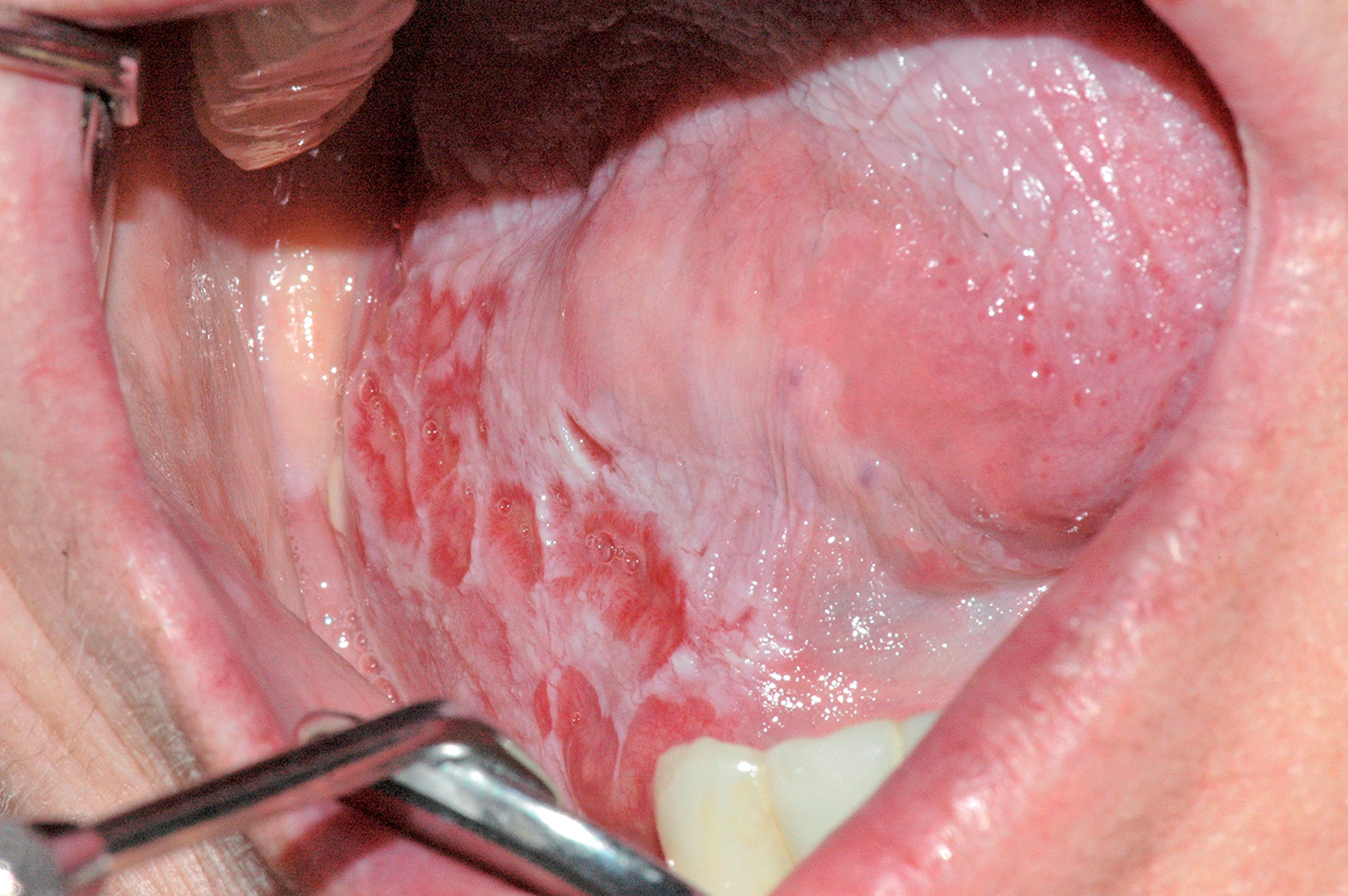
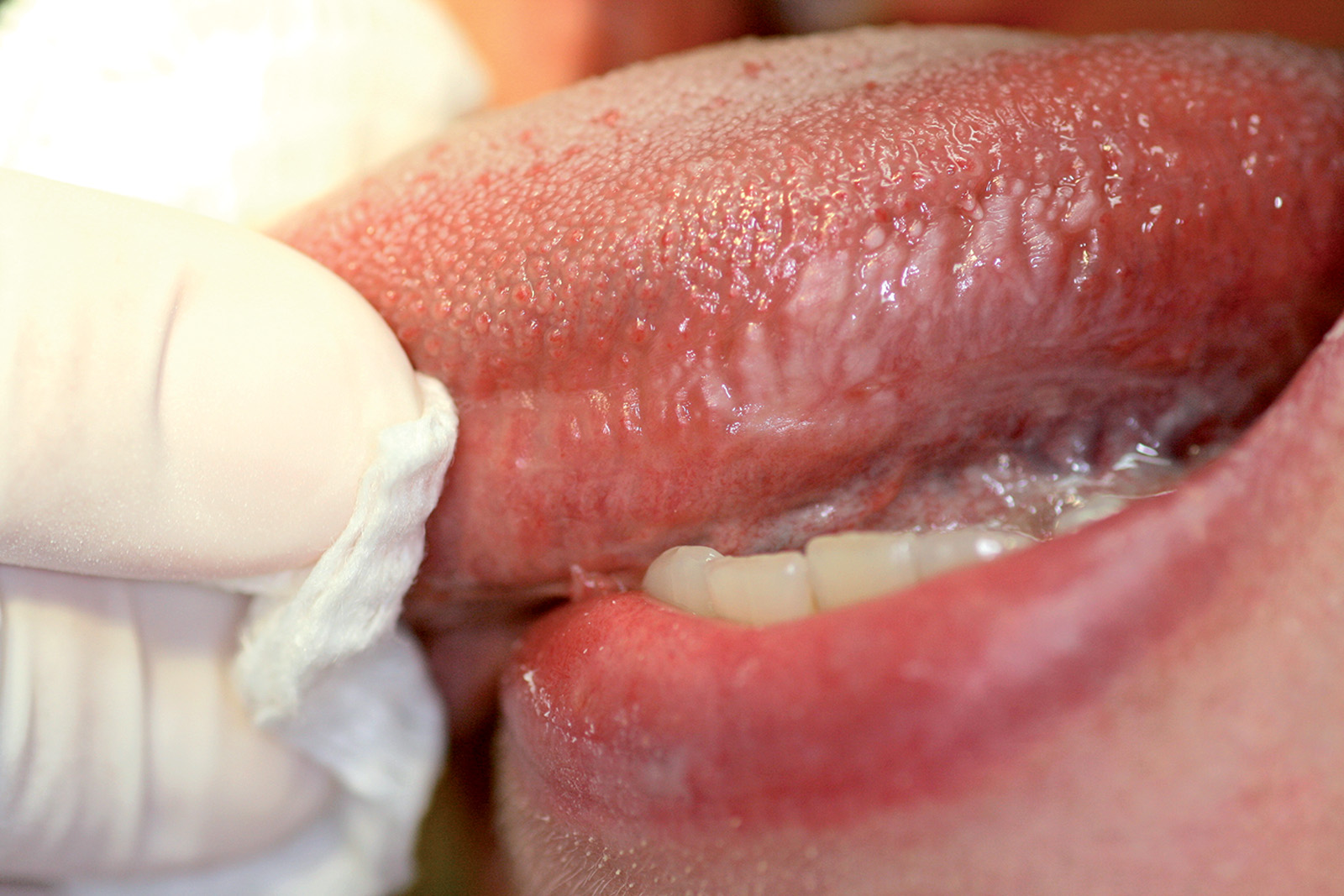
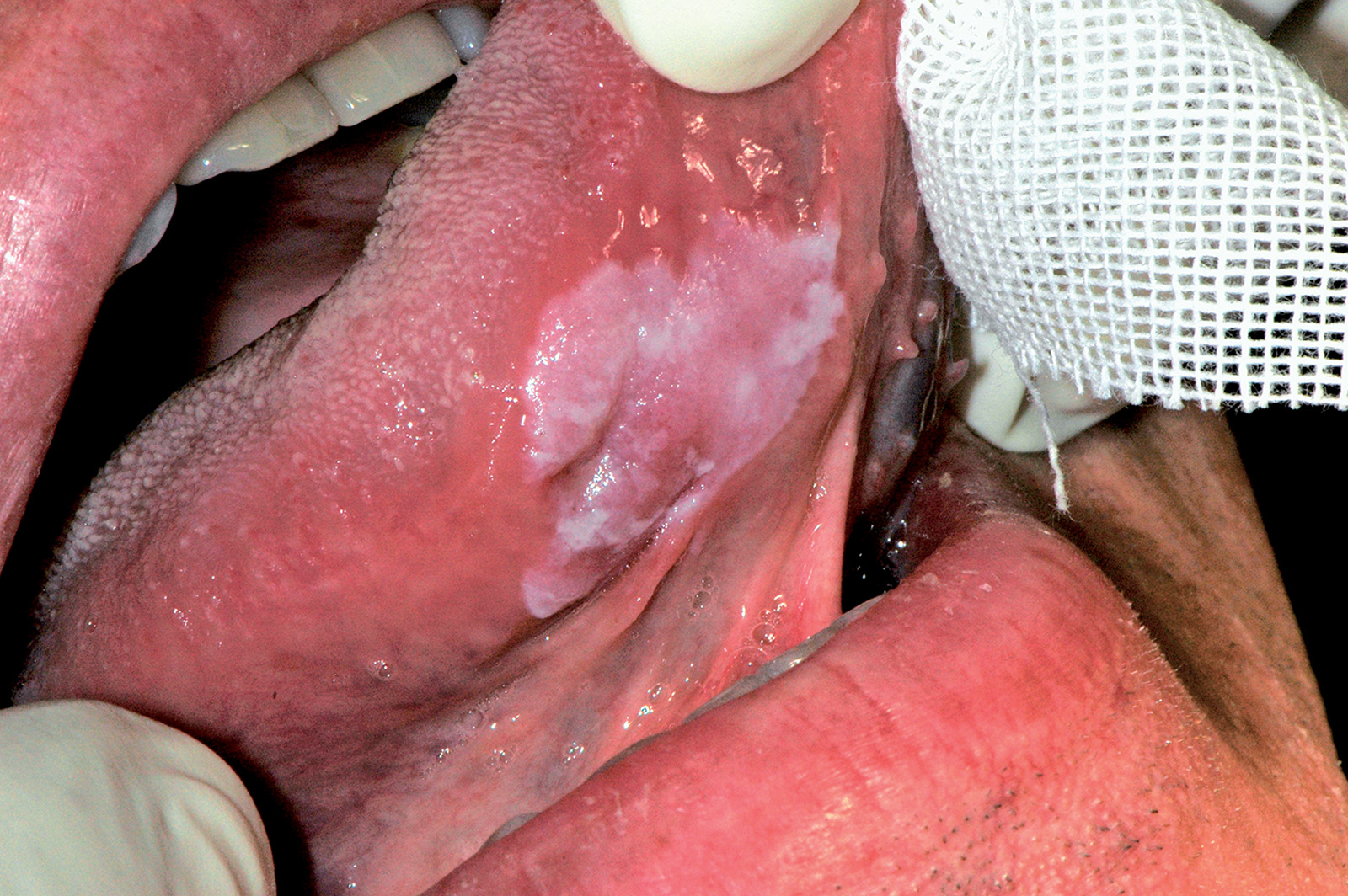
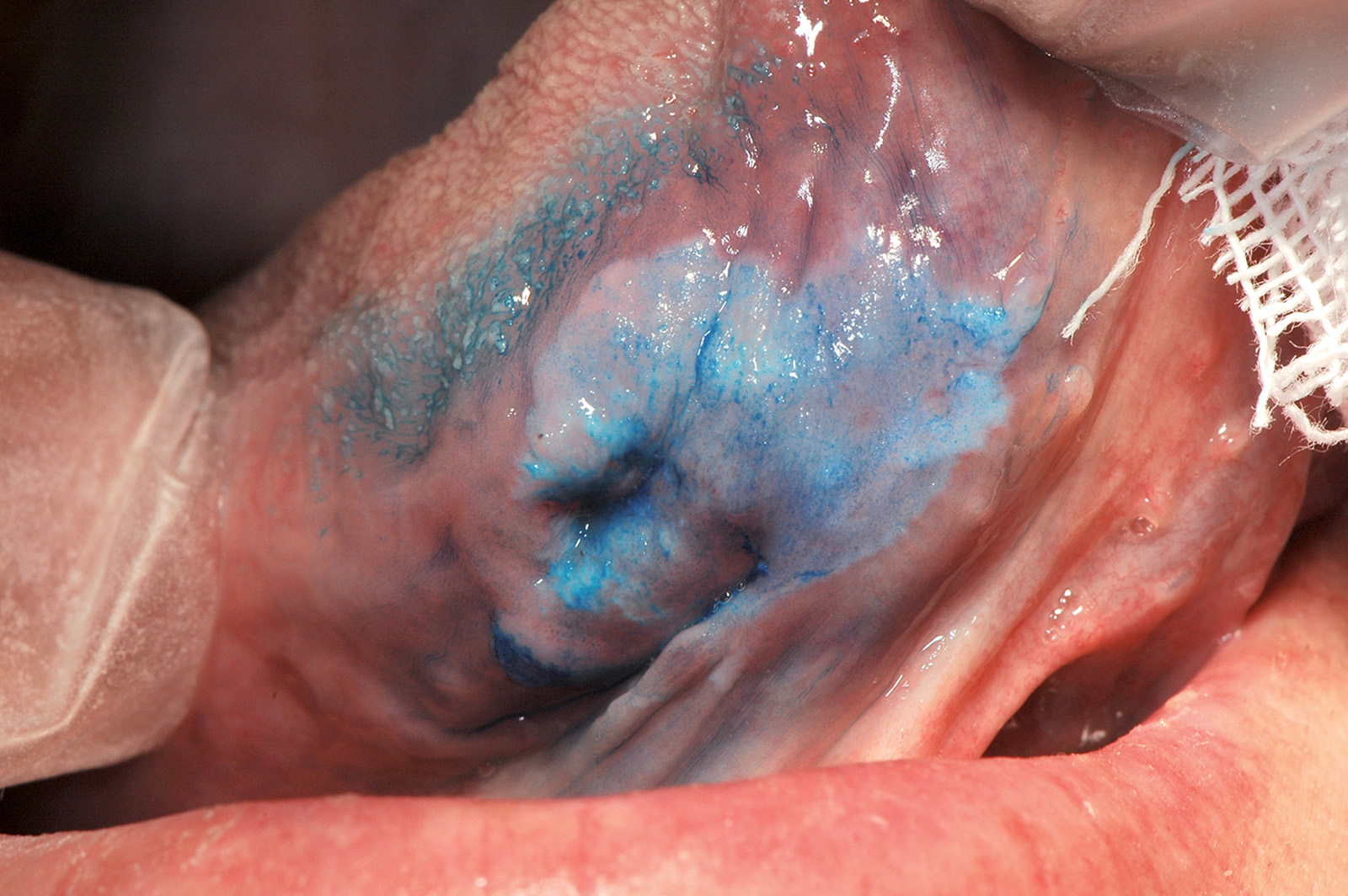
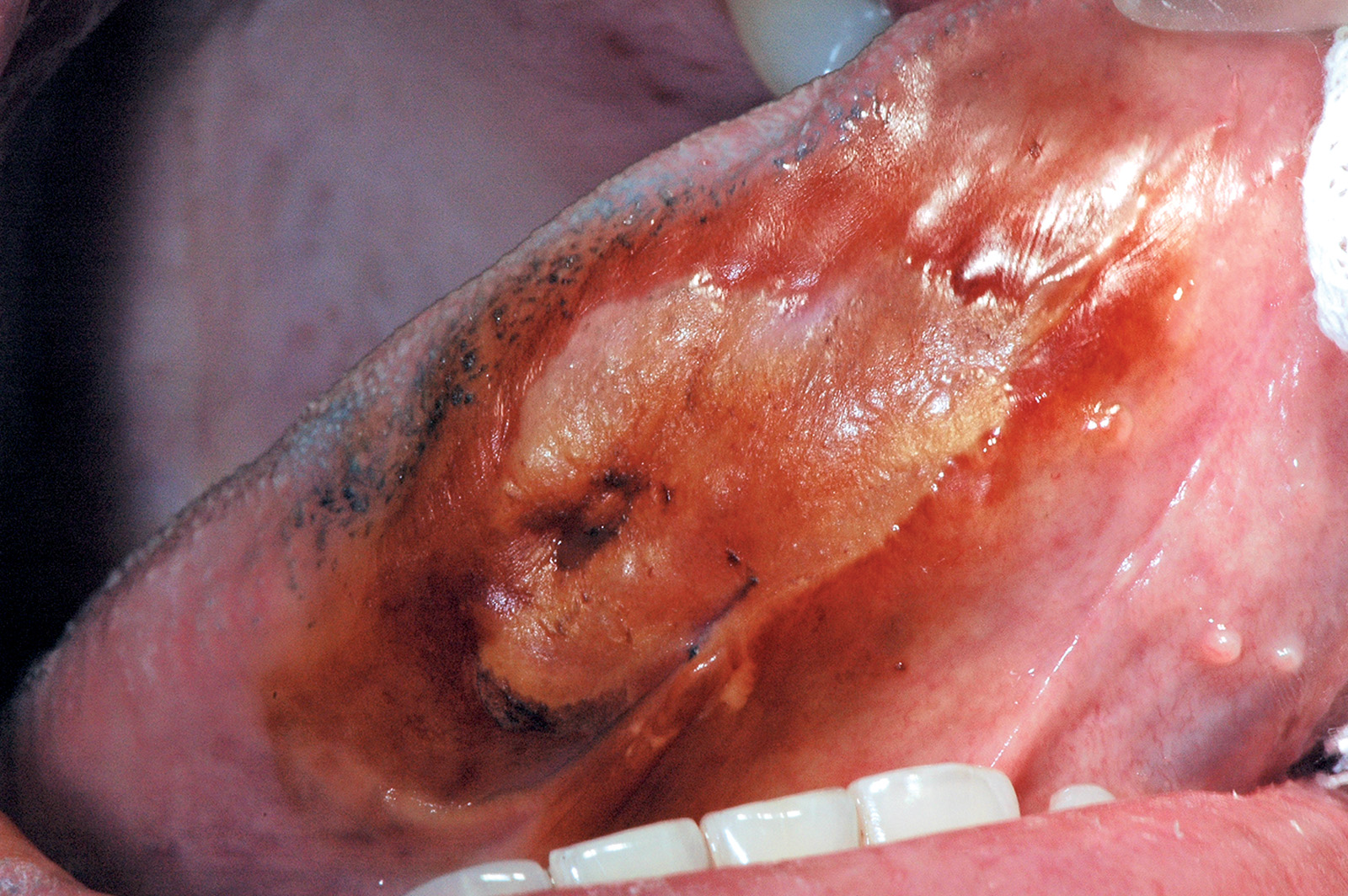
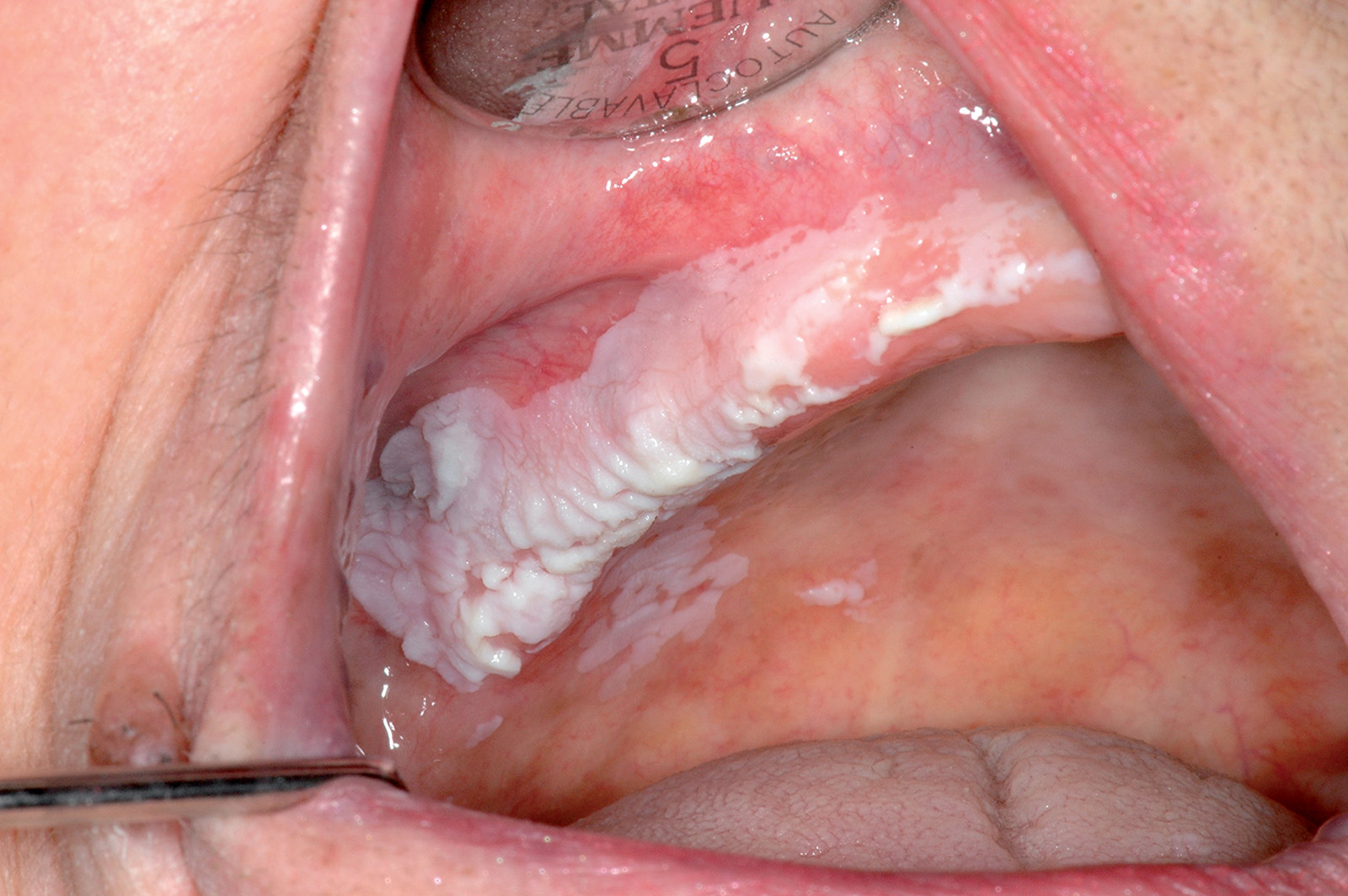
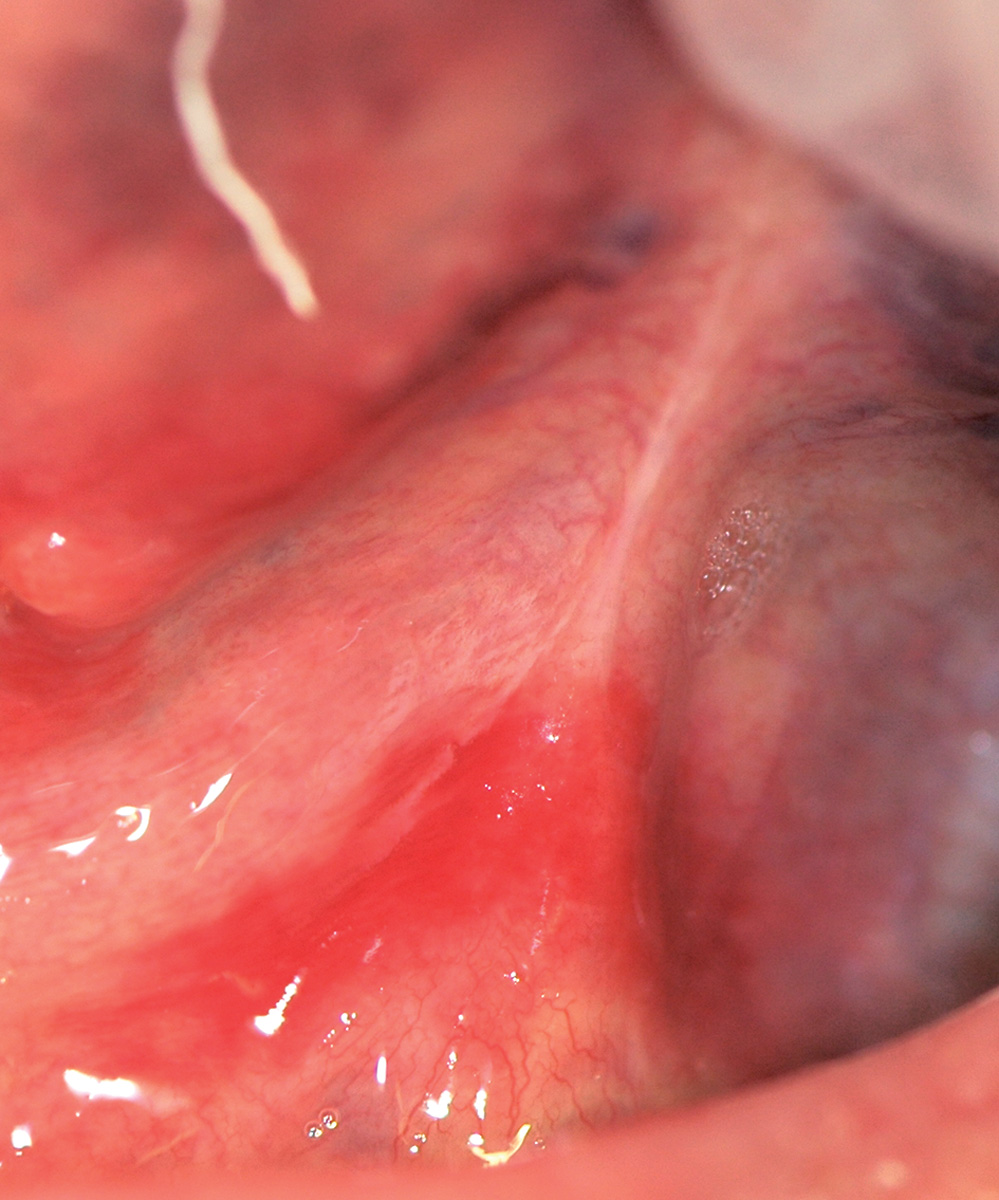
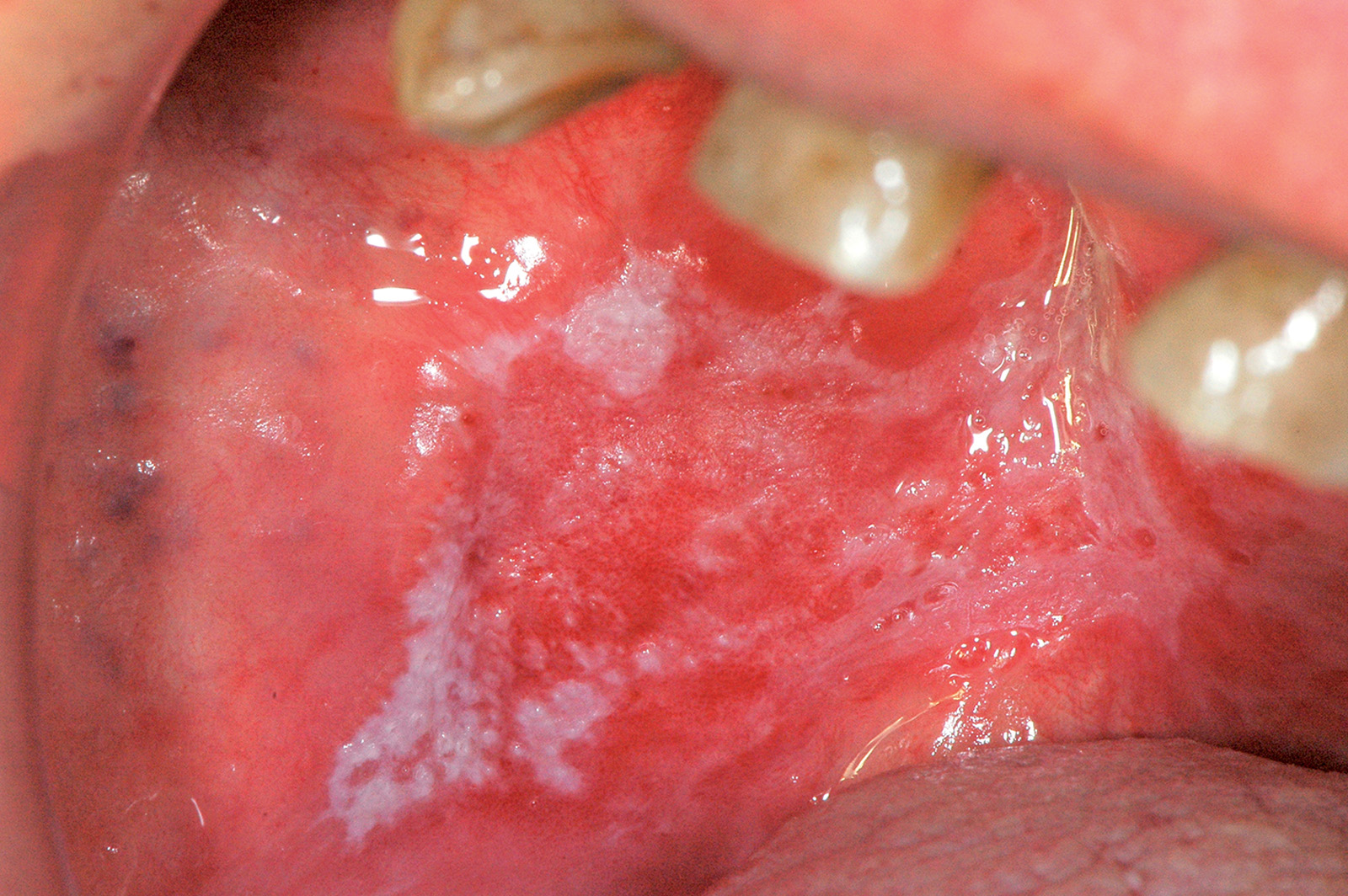
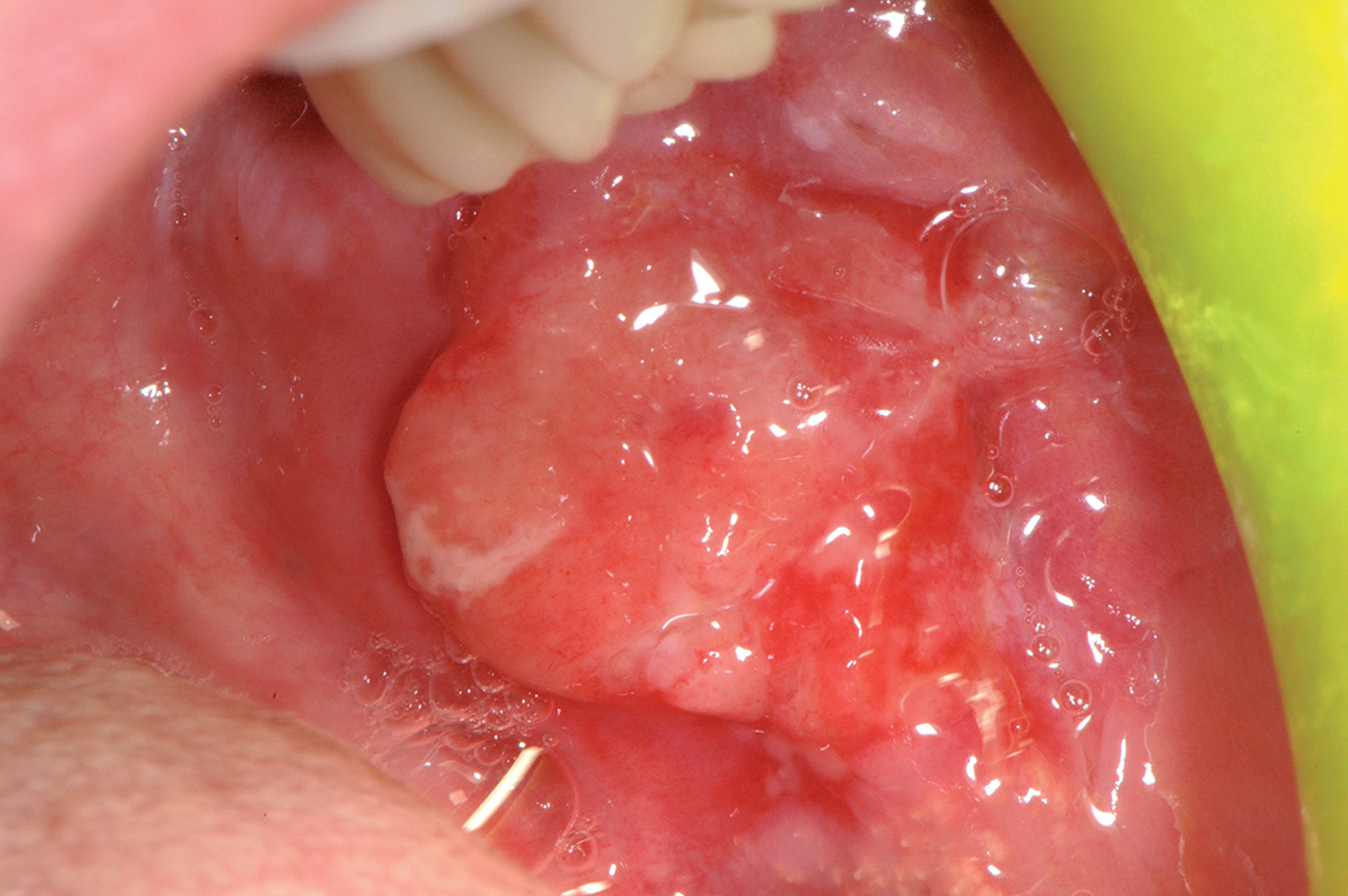
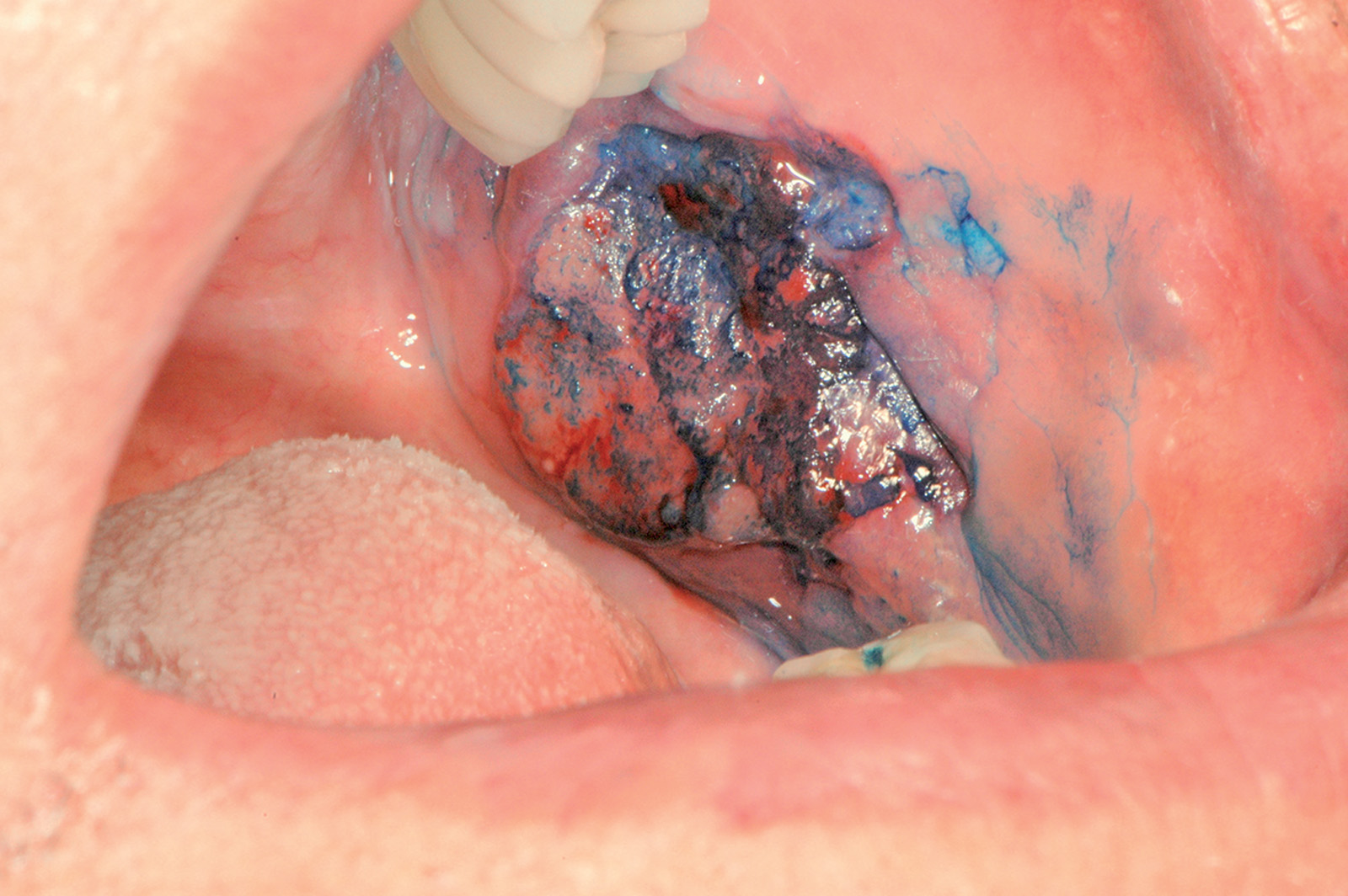
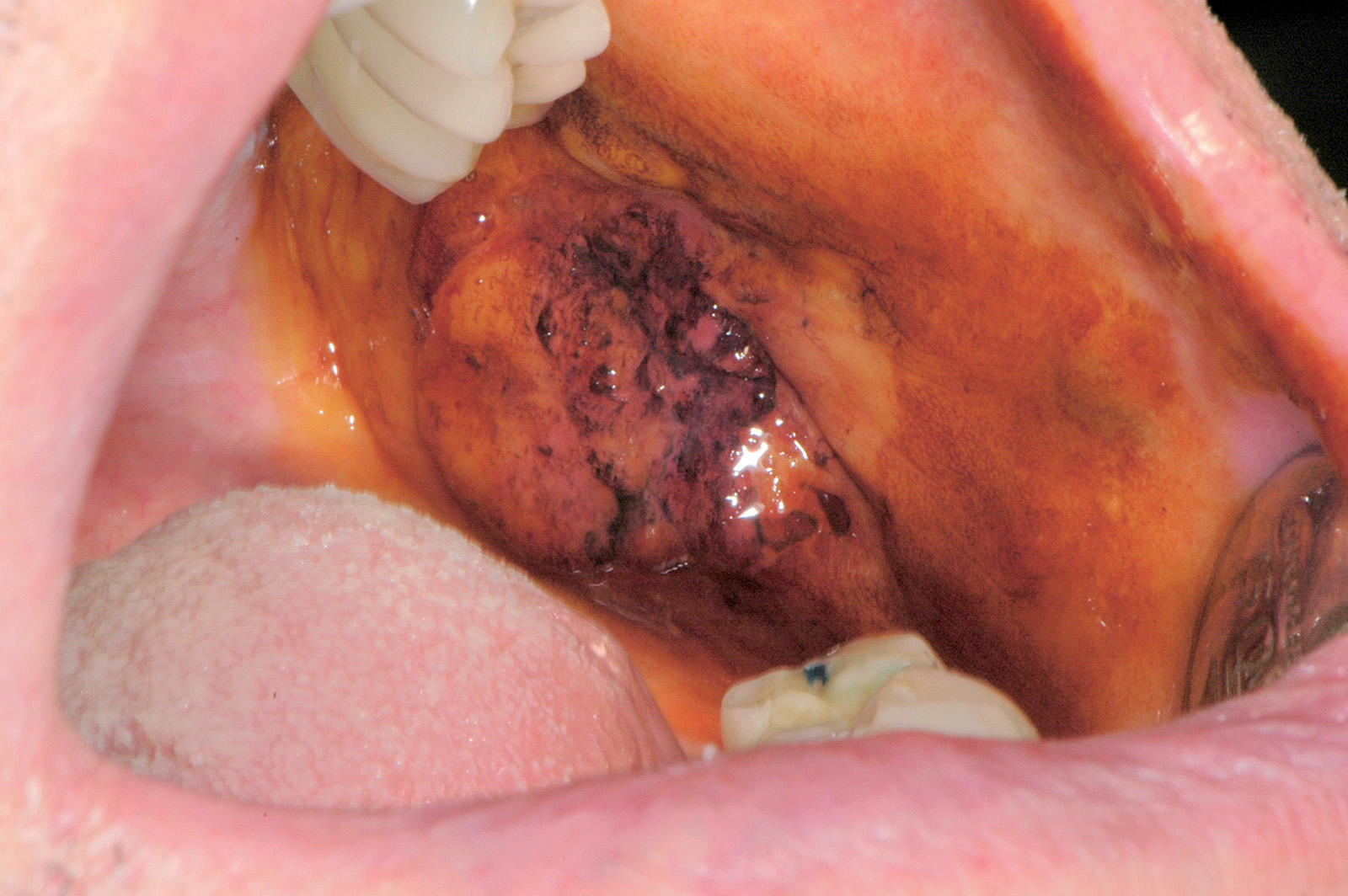



Excellent site, awesome pics. Congrats Prof. Dr. Serpico!