Introduzione. Lo scopo di questo studio è la valutazione della qualità della vita post-operatoria di pazienti sottoposti a chirurgia endodontica nei molari del mascellare in caso di perforazione della membrana sinusale durante la chirurgia.
Materiali e metodi. Sono stati inclusi pazienti sottoposti a microchirurgia endodontica a livello delle regioni molari e premolari del mascellare. I pazienti sono stati soggetti a screening e sono stati analizzati i dati derivati dal questionario sulla qualità della vita. È stato comparato l’uso di plasma ricco di fattori di crescita (PRGF), gruppo test, con un gruppo controllo nei casi in cui avveniva perforazione della membrana di Schneider durante la rimozione della lesione.
Risultati. Sono stati inclusi un totale di 20 pazienti di cui 12 appartenenti al gruppo controllo e 8 al gruppo test. Non si sono riscontrate significative differenze dei parametri clinici al baseline. Si è visto un miglioramento della qualità della vita nel gruppo test. Le attività funzionali risultavano meno compromesse nel gruppo test e il gonfiore più alto nel gruppo controllo. Nel gruppo test il dolore è risultato inferiore rispetto al gruppo controllo i primi sei giorni dopo la chirurgia e anche l’assunzione di antidolorifici è stata inferiore nei pazienti del gruppo test.
Discussione. In generale, una piccola perforazione del seno (meno di 6 mm di diametro) durante la chirurgia endodontica non causa gravi complicanze. L’uso di concentrati piastrinici potrebbe essere efficace nel ridurre l’impatto sulla qualità della vita dei pazienti, riducendo il dolore e gli effetti collaterali della chirurgia oltre al gonfiore.
Parole chiave: apicectomia, chirurgia endodontica, concentrati piastrinici, PRGF, perforazione della membrana del seno.
L’introduzione di strumenti microchirurgici e d’ingrandimento nella moderna chirurgia endodontica1 rappresentano un importante miglioramento nel trattamento dell’apice radicolare e dei tessuti molli1-4. Sono stati descritti svariati protocolli di trattamento che tengono in considerazione sia strumenti d’ingrandimento come il microscopio operatorio5-7, l’endoscopio8 o lenti ingranditrici9-11, sia materiali da otturazione dell’apice come MTA5,10, Super-EBA7,11 o materiali da otturazione intermedi5,10. Una tale eterogeinicità rende difficile valutare i fattori che influenzano il successo della chirurgia apicale e definire un preciso protocollo di trattamento1. Inoltre, in una recente revisione della letteratura si è mostrato come la moderna microchirurgia endodontica possa essere predicibile in termini di guarigione della lesione e regressione di segni e sintomi clinici1,2,12. È stato inoltre ipotizzato che un approccio chirurgico meno invasivo può essere più tollerabile per il paziente di quello convenzionale13. Infatti dolore, gonfiore ed ematomi possono frequentemente comparire dopo la chirurgia endodontica14. Le radici dei molari mascellari sono spesso in stretta relazione con il pavimento del seno mascellare. Questo richiede una particolare attenzione quando si interviene con la chirurgia endodontica in questa regione15. Infatti si può verificare una perforazione occasionale della membrana di Schneider nel corso del trattamento dell’apice nei casi in cui ci sia vicinanza o invasione dello spazio antrale da parte di tessuto infiammatorio periapicale15-17. Le perforazioni della membrana del seno possono causare molteplici conseguenze sia psicologiche che cliniche. Un trauma della membrana di Schneider può inibire l’attività ciliare predisponendo a modificazioni della mucosa e riducendo la resistenza alle infezioni18.
Inoltre, in caso di perforazione sono relativamente frequenti complicazioni cliniche come sanguinamento dal naso, ostruzione del seno mascellare a causa dell’infiammazione e infezioni acute o croniche del seno stesso18-20. Il plasma ricco di fattori di crescita (PRGF) grazie alle sue proprietà meccaniche e aggregative può essere uno strumento utile per il trattamento della perforazione del seno mascellare21. In aggiunta, il PRGF si è mostrato essere correlato a un minor disagio post-operatorio dopo la chirurgia periapicale22. In letteratura non ci sono studi che valutino la qualità della vita dopo un danno alla membrana del seno manifestatosi occasionalmente nel corso di una chirurgia periapicale. L’obiettivo di questa valutazione retrospettiva comparativa è stato quello di valutare se l’uso del PRGF nel corso di chirurgia endodontica dei molari mascellari potesse migliorare la qualità della vita dei pazienti in caso di perforazione della membrana del seno.
MATERIALI E METODI
La chirurgia endodontica dei molari mascellari è stata eseguita tra il 2007 e il 2010 da un chirurgo esperto (ST) sia all’interno della clinica universitaria che nell’ambito dell’attività privata. I risultati sono stati valutati sia considerando le cartelle cliniche dei pazienti che attraverso l’uso di radiografie periapicali prese prima della chirurgia, dopo la chirurgia, dopo 6 mesi dalla chirurgia e poi annualmente.
Selezione dei pazienti e criteri di inclusione
Sono stati adottati i seguenti criteri di inclusione:
• pazienti senza alcuna controindicazione medica generale alla chirurgia orale (ASA-1 e ASA-2);
• denti con una lesione periradicolare di origine strettamente endodontica i cui ritrattamenti non chirurgici sono stati considerati infattibili o sono falliti precedentemente;
• denti con un’adeguata ricostruzione finale con nessuna evidenza clinica di infiltrazione coronale;
• almeno 6 mm di porzione apicale del canale priva di perni endodontici;
• pazienti che fumano meno di 10 sigarette al giorno;
• pazienti con un solo dente mascellare che necessita di chirurgia mascellare;
• difetto con diametro compreso tra 4 e 15 mm valutato radiograficamente;
• pazienti sottoposti a chirurgia endodontica nella regione mascellare posteriore e che sono andati incontro a perforazione della membrana del seno durante la chirurgia;
• pazienti che hanno compilato il questionario sulla qualità della vita;
• pazienti che hanno seguito la visita di follow-up almeno 1 anno.
Criteri di esclusione alla chirurgia:
• presenza di ogni tipo di frattura radicolare verticale;
• una grave perdita di osso alveolare determinata con sondaggio parodontale (profondità al sondaggio >5 mm);
• denti con perforazione dell’area della forcazione o a livello dei canali laterali;
• denti con danni da trauma;
• difetti ossei che coinvolgono sia la parete buccale che quella linguale;
• presenza di sinusite o altre patologie del seno come la sindrome endoantrale descritta da Selden17-19.
Sono stati considerati i dati di tutti i pazienti andati incontro a lacerazione della membrana del seno mascellare. Se il PRGF veniva utilizzato per trattare la fenestrazione, il paziente era inserito nel gruppo test, altrimenti in quello controllo. Sono stati inseriti nello studio i dati clinici di nove maschi e 11 femmine. L’età media complessiva è stata 40.4±12.1 anni (range da 29 a 55). Sono stati trattati un totale di 20 elementi dentari, 18 di questi erano primi molari e due secondi molari. Tutti i denti trattati presentavano una lesione a livello di una delle radici buccali. Sedici lesioni possono essere classificate di Classe III così come descritto da Oberli15 e quattro di Classe II. Nel gruppo test l’età ha avuto una variabilità da 29 a 55 anni (con una media di 42.6±13.8 anni) e sono stati trattati quattro maschi e quattro femmine. La dimensione media della lesione periapicale era 8±2mm (range da 4,5 a 10 mm). Nel gruppo test sono stati trattati sette primi molari e un secondo molare. Una lesione è stata classificata di Classe II e sette di Classe III15. Nel gruppo controllo sono stati trattati cinque maschi e sette femmine, la cui età varia dai 32 ai 52 anni (con una media di 37.6±14.8 anni). La misura media della lesione periapicale, verificata nel corso della chirurgia attraverso l’uso di una sonda parodontale, era di 7,5±3,5 mm (con un range variabile da 4 a 11 mm). Nel gruppo controllo sono stati trattati undici primi molari e un secondo molare. Tre lesioni sono state classificate di Classe II e nove di Classe III15. Tutte le perforazioni della membrana avevano diametro inferiore ai 6 mm, misurate con un calibro chirurgico (BTI Biotechnology Institute, Vitoria, Alava, Spain). Lo studio è stato condotto seguendo i principi contenuti nella Dichiarazione dell’Associazione medica mondiale di Helsinki del 1975 per la ricerca biomedica che coinvolge esseri umani, modificata nel 200023. L’approvazione etica è stata ottenuta dalla Review Board dell’IRCCS Istituto Ortopedico Galeazzi (numero 3.15-2007). Tutti i pazienti hanno fornito il loro consenso informato scritto.
Preparazione del PRGF
Il sangue periferico (10 ml) è stato prelevato pre-chirurgicamente prima della somministrazione dell’anestesia locale e raccolto in provette di vetro da laboratorio da 5 cc pretrattate con trisodio citrato al 3,8% come agente anticoagulante. La provetta è stata centrifugata a 460 x g a temperatura ambiente per 8 minuti in una centrifuga appositamente costruita per l’uso di questa tecnica (PRGF System®, BTI Biotechnology Institute, Vitoria, Alava, Spain). Dopo la centrifugazione, la componente plasmatica è stata separata in due frazioni con l’uso di pipette da laboratorio. La più bassa frazione di circa 1 cc, immediatamente sopra il buffy coat, è il PRGF (Figura 1), mentre la frazione superiore (circa 1 cc) è il plasma povero di fattori di crescita (PPGF). Le due frazioni sono state raccolte in provette sterili fino al loro utilizzo. La preparazione totale per questa tecnica richiede approssimativamente 10-15 minuti. Pochi minuti prima dell’uso, 50 μl di CaCl2 al 10% sono stati aggiunti a ogni centimetro cubo di PRGF per favorire la formazione del coagulo. Questo ha permesso la creazione di un gel di consistenza meccanica stabile e facile da maneggiare.
Procedura chirurgica
Gli interventi sono stati eseguiti da un chirurgo esperto (ST). Prima della chirurgia tutti i pazienti sono stati sottoposti a uno sciacquo con soluzione di clorexidina allo 0,2% per un minuto come antisettico per ridurre la contaminazione del campo chirurgico. È stata somministrata anestesia locale con l’uso di articaina al 4% e adrenalina 1:100,000. Il lembo consisteva in una singola incisione di rilascio verticale e in un’incisione orizzontale. Le incisioni verticali sono state poste distali di almeno un dente dall’elemento che deve essere trattato. La parte iniziale dell’incisione verticale è stata effettuata perpendicolare al decorso marginale della gengiva nella direzione della sezione media della papilla e gradualmente direzionandola parallelamente all’asse del dente. Quindi, l’incisione decorre verticale parallela all’asse dei denti e ai vasi sanguigni sovraperiostali nella mucosa e nella gengiva con un’incisione di rilascio paramediana (Figura 2). Sono state effettuate due diverse incisioni alla base della papilla che determinano un lembo a spessore parziale come descritto da Velvart24. Sul versante buccale, oltre al dente, gli spazi interprossimali vengono uniti con un’incisione intrasulculare che separa la gengiva dall’osso crestale. L’incisione sulculare raggiunge l’inizio di quella alla base della papilla più vicina dall’incisione di rilascio. Un lembo a spessore parziale, che inizia 2 mm apicalmente alla base del difetto osseo, viene esteso in direzione mesiodistale e apicale per ridurre la trazione che esercitano i muscoli sul lembo e facilitare la passivazione dello stesso.
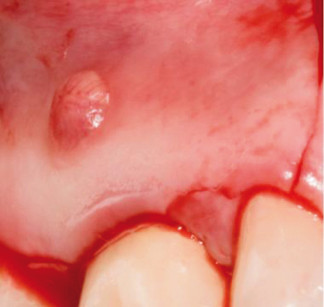
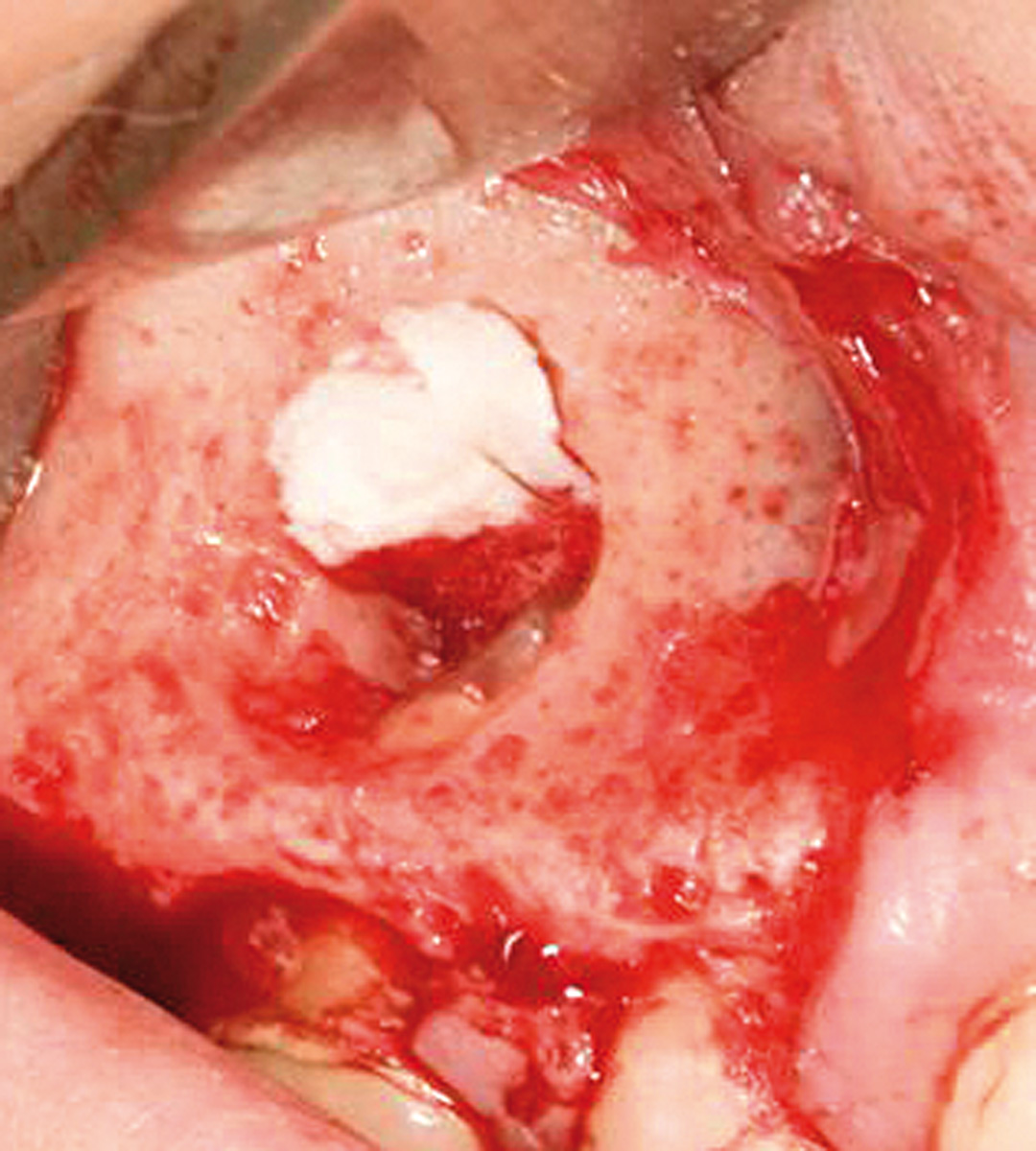
Il lembo viene quindi mobilizzato, riflesso e delicatamente ritratto durante il trattamento apicale. L’accesso chirurgico alla radice è stato realizzato attraverso l’osso corticale mediante un fresa a rosetta, se necessario. L’abrasione dell’osso viene realizzata con un approccio a colpo di pennello, a una bassa velocità di rotazione, irrigando costantemente con acqua sterile. Viene quindi rimossa la lesione periradicolare mediante raspe da osso e curette angolate periodontali. Il tessuto curettato viene infine inserito in una soluzione di formalina al 10% per la diagnosi patologica. A causa della vicinanza tra la lesione e la membrana di Schneider durante l’escissione, può presentarsi una perforazione della membrana stessa (Figura 3). Dopo l’esposizione dell’apice, 2,5-3 mm di quest’ultimo vengono rimossi usando una fresa con un taglio perpendicolare all’asse lungo del dente. Gli apici vengono trattati con punte in zirconio nitrato (Dentsplay Maillefer Instruments, Ballaigues, Switzerland) montate su strumenti a ultrasuoni (Piezon Master 700.EMS, Nyon, Switzerland). Le cavità preparate vengono quindi asciugate con coni di carta. Infine, è stato usato cemento all’ossido di zinco rinforzato (Bosworth SuperEba, Harry J. Bosworth Company, Skokie, IL, USA) per riempire la cavità retrograda. È stato utilizzato un endoscopio per visualizzare correttamente tutte le fasi del trattamento dell’apice8.
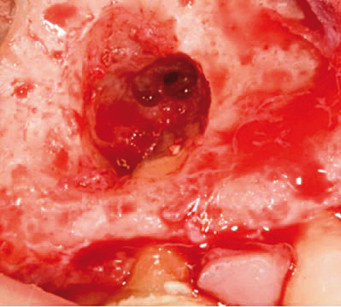
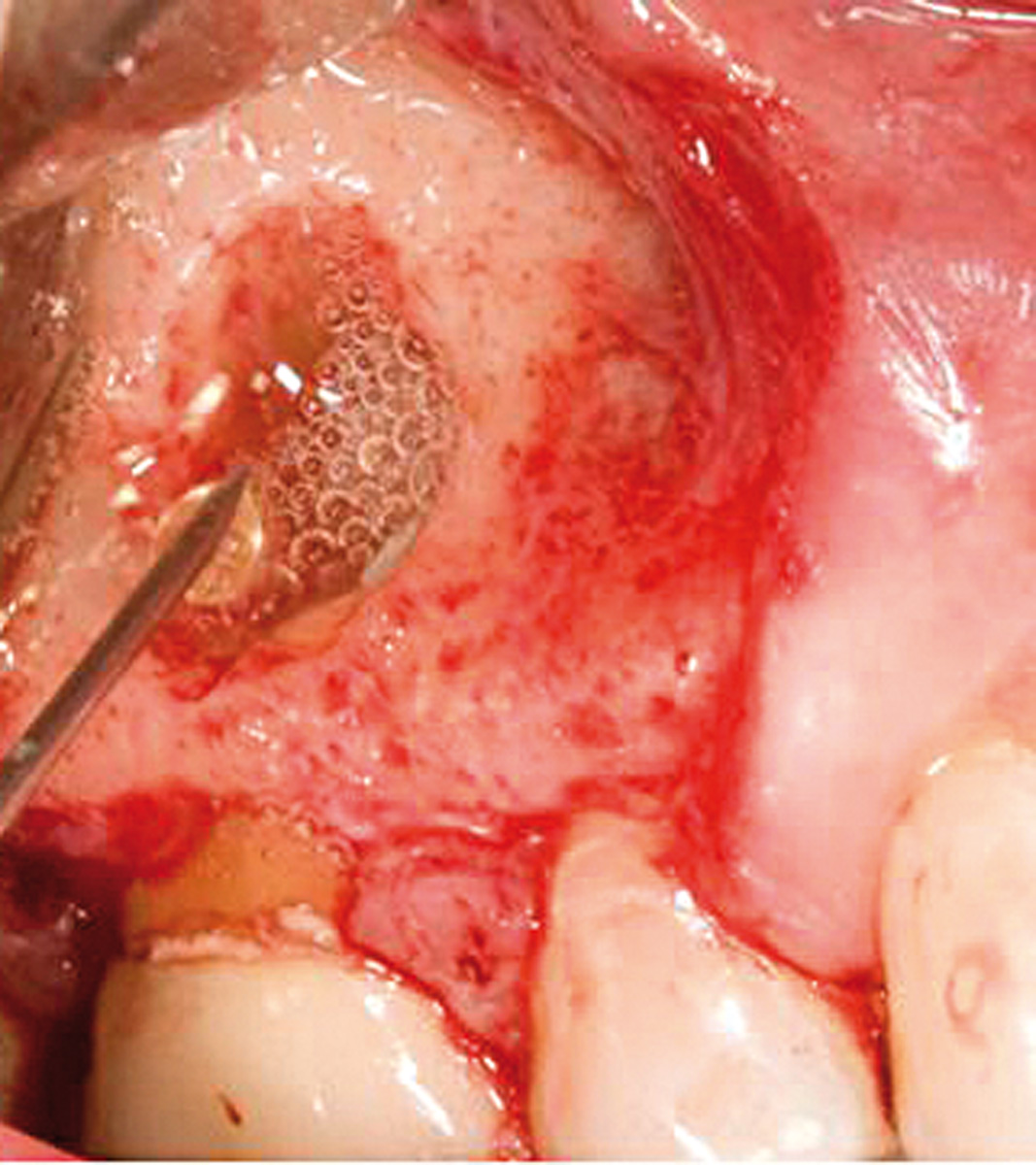
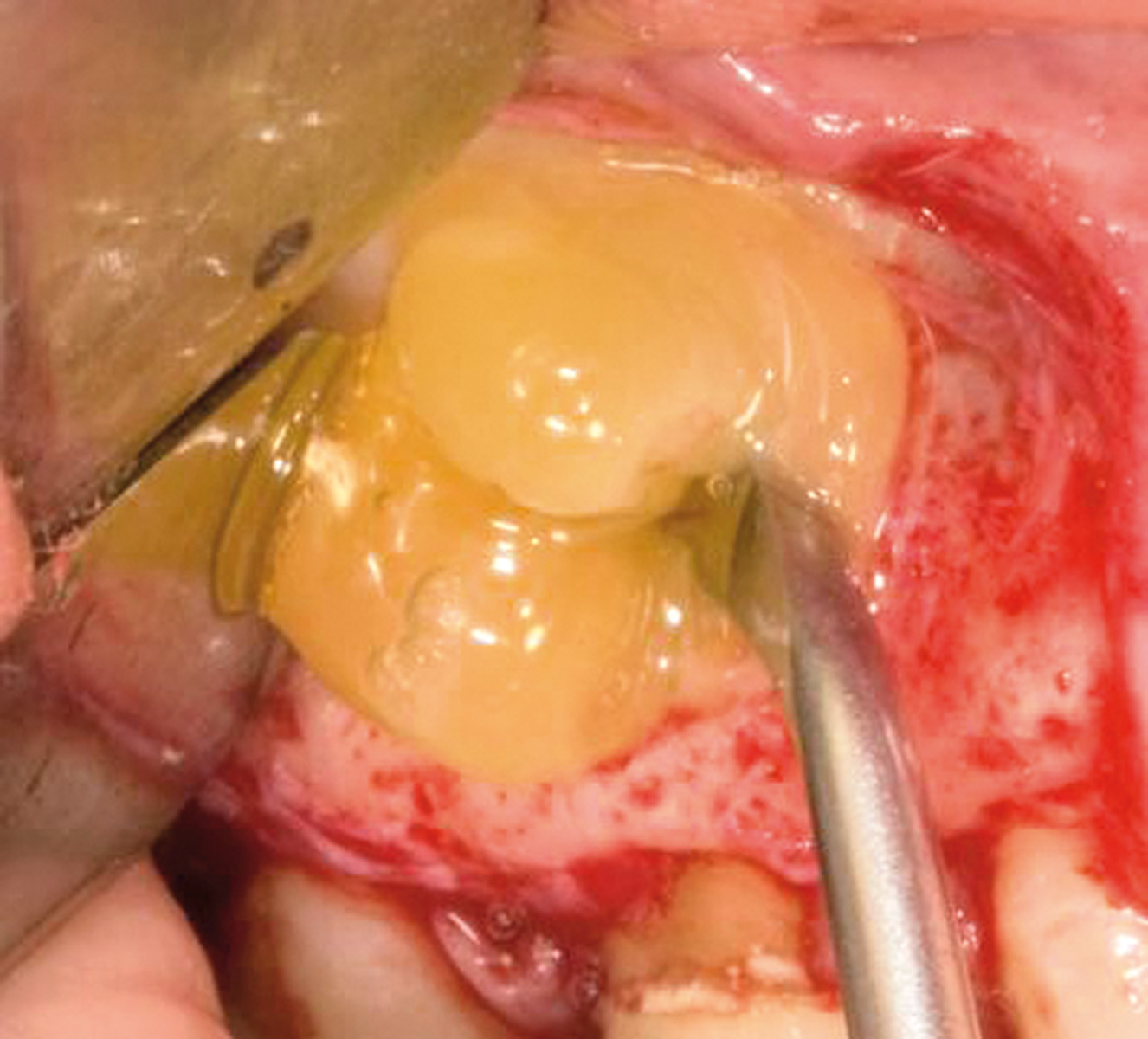
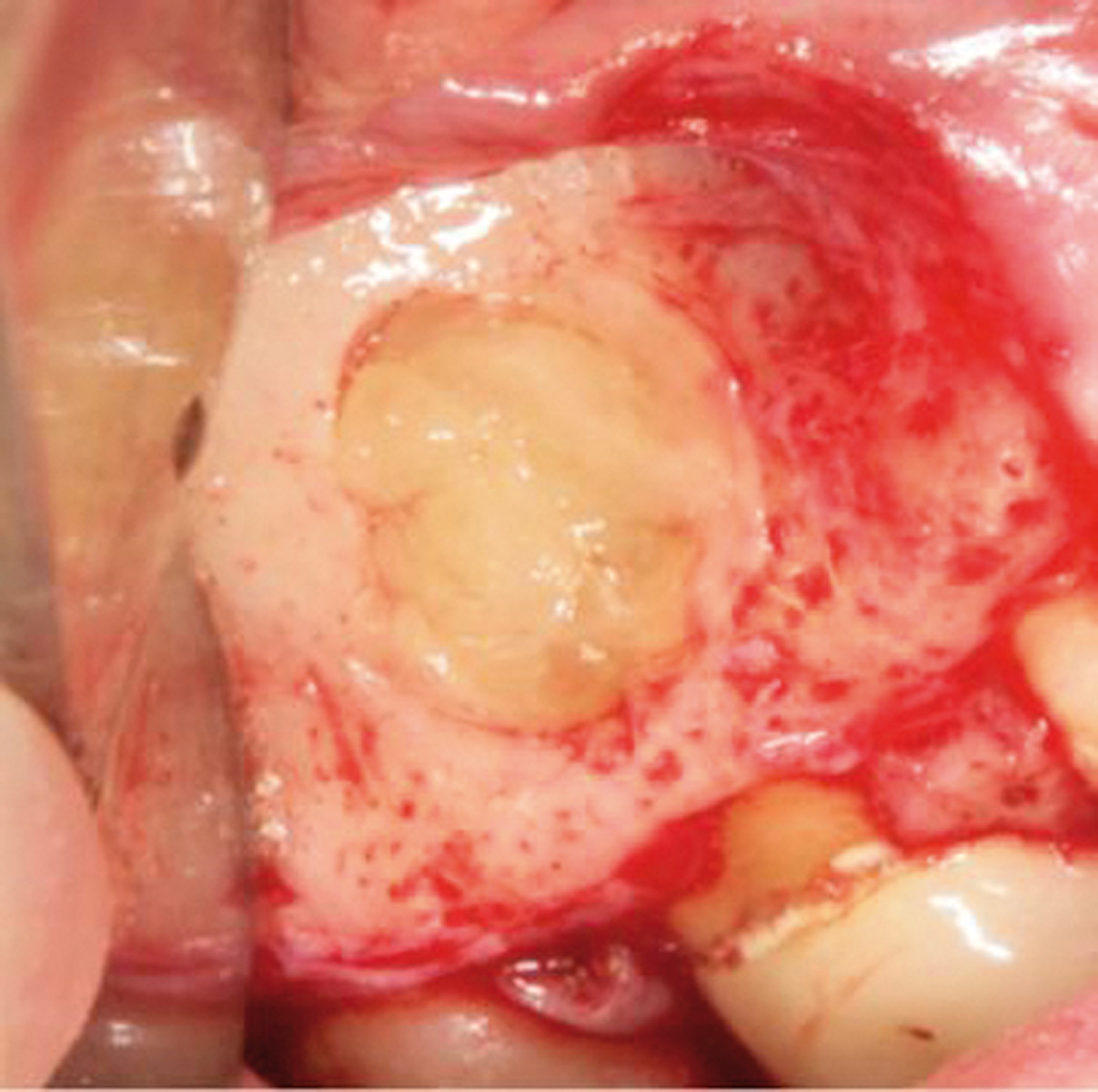
Prima di iniziare il trattamento dell’apice, il seno è stato protetto dalla possibile dispersione dei materiali con una spugna gelatinosa emostatica di collagene riassorbibile 1 cm×1 cm×1 cm (Spongostan®/Surgifoam®, FerrosanA/S, Sydmarken 5, DK-2860 Soeborg, Denmark) (Figura 4). La spugna è stata rimossa dopo il trattamento della radice. Il sito chirurgico è stato riempito con il PVRGF insolubile (Figura 5), un clot di PRGF è stato applicato sulla perforazione (Figura 6), e un altro clot per riempire la cavità ossea (Figura 7). Il lembo riflesso è stato riposizionato, compresso e, per finire, suturato con una sutura microchirurgica in poliammide 5/0 (Ethicon Inc., Johnson & Johnson, Piscataway, NJ, USA). Il PRGF insolubile è stato delicatamente inserito con un ago atraumatico nel sito della sutura.
Protocollo di follow-up post-chirurgico
Istruzioni post-operatorie
I pazienti sono stati istruiti a non eseguire niente che potesse rapidamente innalzare o abbassare la pressione sinusale come: starnutire a bocca chiusa, soffiare il naso, volare, succhiare dalla cannuccia, nuotare, fare immersioni, gonfiare palloni o suonare strumenti a fiato per 10 giorni. Inoltre, i pazienti sono stati istruiti a evitare manovre di igiene troppo vigorose, cibi caldi e duri, attività fisica intensa, fumo e di toccarsi le gengive per almeno 3 giorni dopo la chirurgia. Sono stati somministrati impacchi di ghiaccio dopo la chirurgia. In aggiunta i pazienti venivano invitati a effettuare sciacqui delicati con clorexidina 0,2%, due volte al giorno per 7 giorni. A tutti i soggetti è stato prescritto un antinfiammatorio non steroideo (FANS) per controllare dolore, gonfiore e infiammazione, se necessario. Le suture sono state rimosse a 7 giorni post-chirurgia.
Parametri di valutazione della qualità della vita
È stato somministrato a tutti i pazienti un questionario appositamente preparato, usato in precedenti studi25-27, per valutare la limitazione delle funzioni nel post-operatorio (per esempio, masticare, parlare, dormire, attività quotidiane e lavoro perso), così come il dolore e la presenza di altri sintomi (gonfiore, sanguinamento, nausea, alito e/o sapore cattivo). Per assegnare il dolore è stata adottata una scala analogica visuale (VAS) di 10 cm: 0=nessun dolore e 100=dolore irresistibile. Per gli altri sintomi e limitazioni funzionali, la risposta era basata su una scala a 5 punti (Likert-type scale), con un range da 1 (nessuno) a 5 (moltissimo). Infine, ai pazienti è stato chiesto se avessero preso analgesici e in che quantità in ogni giorno del post-operatorio. I pazienti ricevevano i questionari da compilare quotidianamente a partire dal giorno della chirurgia per una settimana. Gli stessi questionari sono stati consegnati a mano o rimandati per posta. Sono state registrate complicanze come sanguinamenti nasali, ostruzioni nasali o sinusali o sinusiti, e la loro durata.
Criteri di valutazione della guarigione
Al follow up di 1 anno il successo è stato categorizzato come qui di seguito indicato. (1) “successo” che include 2 sottogruppi: completa guarigione, sia clinica che radiografica, guarigione incompleta, normalità clinica e netta riduzione della radiotrasparenza in rx; (2) “guarigione incerta” (presenza di radiotrasperenza in assenza di segni e sintomi, o presenza di segni/sintomi associati a non completa guarigione radiografica); (3) “fallimento”(segni, sintomi e mancata guarigione in rx)14,28,29. Le radiografie periapicali sono state raccolte a ogni follow-up (3 e 6 mesi) mediante tecnica a raggi paralleli. La valutazione delle stesse era affidata a due esaminatori in cieco (MDF and SC), che indipendentemente hanno eseguito la loro valutazione (pre-operatoria, post-operatoria e a 1 anno) a un ingrandimento di 4,3x usando lenti d’ingrandimento. In caso di giudizio non uniforme tra i due esaminatori, la radiografia veniva rivalutata insieme dagli stessi (Figure 8, 9). Solo dopo giudizio univoco il caso veniva assegnato a una delle classi di guarigione.
Analisi statistica
È stato usato il test di Fisher per valutare una differenza statisticamente significativa tra i gruppi per analgesici presi, lavoro perso e ogni altra variabile relativa a funzione e sintomi per ogni giorno del post-operatorio. Per questo test è stata realizzata una tabella 2×4 per ognuna delle osservazioni. La differenza tra i 2 gruppi riguardo al dolore in ogni giornata del post-operatorio veniva stabilita usando un t test per gruppi non appaiati. Il paziente è stato considerato come un’unità dell’analisi. Era considerata come livello significativo una probabilità p=0,05. Per l’analisi statistica è stato usato il software Statistica® (StatSoft, Inc., Tulsa, OK, USA) versione 5.0.
RISULTATI
Venti pazienti hanno soddisfatto i criteri di inclusione e sono stati inseriti nello studio. Otto pazienti sono stati trattati con PRGF e 12 senza usare alcun materiale. Tutti hanno compilato i questionari e non ci sono stati dropout. Non è stata osservata differenza statisticamente significativa al baseline tra i gruppi relativamente alla classe di lesione descritta da Oberli15, età, genere, presenza/assenza di patologie sistemiche che potessero essere causa di scompenso metabolico come diabete, fumo e grandezza della lesione. Non ci sono stati effetti significativi di queste variabili sui risultati. L’esito dei questionari è riepilogato nella Tabella 1. È stato osservato un miglioramento significativo della qualità della vita nel gruppo test considerando sintomi come gonfiore, alito e/o sapore cattivo, dolore. Movimenti funzionali come aprire la bocca, masticare, parlare o difficoltà ad alimentarsi con alcuni cibi e attività quotidiane sono risultati migliori nel gruppo test. Il gonfiore era significativamente ridotto nel gruppo test per i 6 giorni post-chirurgia, nessuna differenza è stata osservata relativamente alla difficoltà a dormire, nausea e giorni di lavoro perso.
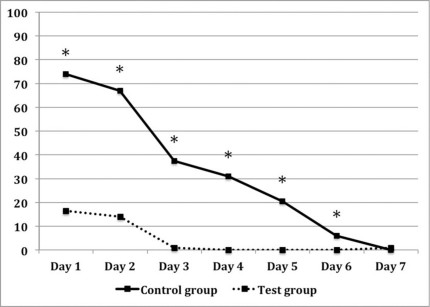
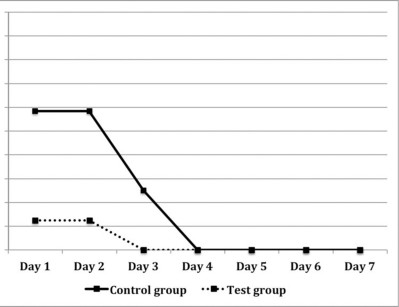
La Figura 10 mostra i risultati del dolore percepito usando una scala VAS. Nel gruppo test il dolore dei primi 6 giorni è risultato significativamente minore che nei controlli, differenza maggiore notata nei primi 5 giorni (p<0.001). Analogamente, l’assunzione di antidolorifici è stata minore nei pazienti appartenenti al gruppo test (Figura 11). Inoltre non è stata osservata nessuna differenza significativa (p=0,057 nei primi 2 giorni e 0,0474 nel terzo giorno) per questo parametro. Tre pazienti nel gruppo controllo hanno subito dei sanguinamenti spontanei durante le prime 24 h post-chirurgia, mentre non si è verificato nessun sanguinamento nel gruppo test. A un anno, tutti i casi erano classificati come successi in termine di guarigione. A ogni scheda di follow-up, la membrana schneideriana appariva normale e il seno fisiologicamente sano in accordo con i criteri stabiliti18,30. Istologicamente, le lesioni periapicali sono state classificate come granulomi.
DISCUSSIONE
La prossimità delle radici dei molari superiori rispetto al pavimento del seno, così come la presenza di lesioni apicali che si estendono nel seno, sono fattori di rischio predisponenti alla perforazione della membrana sinusale durante la chirurgia15,16,31-33. La frequenza delle perforazioni varia da un 9,6% secondo una revisione retrospettiva di Oberli nel 200715 a un 50%31. È stato inoltre dimostrato che in caso di perforazione durante la chirurgia che coinvolge il seno mascellare i risultati clinici del trattamento non vengono compromessi a patto che il materiale estraneo e i frammenti di apice non entrino nel seno mascellare durante la preparazione dell’apice34. È stato descritto l’uso di una garza come chiusura provvisoria della perforazione35. In questo studio è stata usata una membrana riassorbibile di collagene per obliterare la perforazione durante le manovre chirurgiche e impedire il passaggio di materiali nel seno; quindi, dopo il trattamento dell’apice, è stata rimossa. Inoltre è stato anche descritto che in caso di perforazioni minori di 5-6 mm non è richiesto nessun trattamento specifico e che non ci sono particolari complicazioni nel post-operatorio35. In questo studio sono stati inclusi nell’osservazione post-chirurgica solo pazienti con lesioni vicine al pavimento del seno o invadenti la cavità e appartenenti alle Classi II e III di Oberli15. In tutti i casi la perforazione si era verificata successivamente alla preparazione della cavità ossea o durante la rimozione della lesione stessa. Non sono mai stati necessari ulteriori trattamenti come l’elevazione della membrana per chiudere la comunicazione, in accordo con quanto descritto in letteratura36.
I concentrati piastrinici sono ampiamente usati in odontoiatria. È stato dimostrato che sono efficaci nella rigenerazione parodontale37 e, dopo estrazione dentale, nel favorire la guarigione dell’alveolo post-estrattivo38. Sono stati apprezzati risultati favorevoli nell’uso di piastrine anche nella chirurgia del seno mascellare39, consentendo una guarigione migliore sia dei tessuti duri e molli nel sito chirurgico sia promuovendo neoformazione ossea40,41. Nelle chirurgie riguardanti la membrana e la cavità sinusale sono stati descritti in letteratura diversi vantaggi nell’uso del PRGF. In primis la biocompatibilità e le proprietà emostatiche facilitano le procedure chirurgiche42 e permettono un sigillo minimamente invasivo senza trattamento in caso di piccole perforazioni, come descritto nel presente studio. Poi uno degli aspetti principali è che parte del concentrato piastrinico ha la capacità di ridurre l’infiammazione conseguente alla chirurgia con effetti sulla qualità della vita post-operatoria del paziente. Questo effetto si spiega sia grazie alla soppressione delle chemochine pro-infiammatorie come IL-143,44 sia all’effetto antimicrobico intrinseco45. Considerando questi aspetti è possibile dire che le proprietà del PRGF hanno un ruolo determinante nel ridurre i comuni sintomi come dolore, gonfiore così come è stato osservato nei pazienti trattati in questo studio. Un lavoro precedente riguardo alla qualità della vita dopo chirurgia periradicolare suggeriva che quando venivano impiegate tecniche minimamente invasive per la gestione dei tessuti molli, e soprattutto per il tessuto interdentale e la papilla, c’era un miglioramento del post-operatorio25.
I dati del presente studio mostrano che l’uso di PRGF in associazione a moderne tecniche di chirurgia endodontica possono avere effetti positivi nel post-operatorio del paziente che ha subito chirurgia periradicolare nel mascellare superiore con una complicanza di perforazione della membrana sinusale. In aggiunta considerando che nessun paziente ha subito gravi complicanze post-operatorie, è lecito ipotizzare che piccole perforazioni della membrana schneideriana non incidono negativamente sul raggiungimento dei risultati a breve termine della chirurgia endodontica nei denti mascellari posteriori. Altri studi relativi alla funzione del seno e alle sue modificazioni dopo queste complicanze permetteranno una comprensione migliore delle conseguenze della guarigione della membrana. In aggiunta si potrebbe valutare l’uso di radiologia 3D (tomografia computerizzata-CT e cone beam-CT) per effettuare una diagnosi più dettagliata della relazione tra lesione e il seno mascellare, prevenendo così l’invasione del lume sinusale.
Corrispondenza
silvio.taschieri@unimi.it
Bibliografia
1. Tsesis I, Faivishevsky V, Kfir A, Rosen E. Outcome of surgical endodontic treatment performed by a modern technique: a meta-analysis of literature. J Endod 2009;35(11):1505-11.
2. Tsesis I, Rosen E, Schwartz-Arad D, Fuss Z. Retrospective evaluation of surgical endodontic treatment: traditional versus modern technique. J Endod 2006;32(5):412-6.
3. Velvart P. Papilla base incision: a new approach to recession-free healing of the interdental papilla after endodontic surgery. Int Endod J 2002;35(5):453-60.
4. Setzer FC, Shah SB, Kohli MR, Karabucak B, Kim S. Outcome of endodontic surgery: a meta-analysis of the literature-Part 1: Comparison of traditional root-end surgery and endodontic microsurgery. J Endod 2010;36(11):1757-65.
5. Chong BS, Pitt Ford TR, Hudson MB. A prospective clinical study of Mineral Trioxide Aggregate and IRM when used as root-end filling materials in endodontic surgery. Int Endod J 2003;36(8):520-6.
6. Kim E, Song JS, Jung IY, Lee SJ, Kim S. Prospective clinical study evaluating endodontic microsurgery outcomes for cases with lesions of endodontic origin compared with cases with lesions of combined periodontal-endodontic origin. J Endod 2008;34(5):546-51.
7. Pecora G, De Leonardis D, Ibrahim N, Bovi M, Cornelini R. The use of calcium sulphate in the surgical treatment of a “through and through” periradicular lesion. Int Endod J 2001;34(3):189-97.
8. Taschieri S, Del Fabbro M, Testori T, Francetti L, Weinstein R. Endodontic surgery using 2 different magnification devices: preliminary results of a randomized controlled study. J Oral Maxillofac Surg 2006;64(2):235-42.
9. Taschieri S, Del Fabbro M, Testori T, Francetti L, Weinstein R. Endodontic surgery with ultrasonic retrotips: one-year follow-up. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005;100(3):380-7.
10. Lindeboom JA, Frenken JW, Valkenburg P, van den Akker HP. The role of preoperative prophylactic antibiotic administration in periapical endodontic surgery: a randomized, prospective double-blind placebo-controlled study. Int Endod J 2005;38(12):877-81.
11. Maddalone M, Gagliani M. Periapical endodontic surgery: a 3-year follow-up study. Int Endod J 2003;36(3):193-8.
12. Del Fabbro M, Taschieri S, Lodi G, Banfi G, Weinstein RL. Magnification devices for endodontic therapy. Cochrane Database Syst Rev 2009;(3):CD005969. doi:10.1002/14651858.CD005969.
13. Pecora G, Andreana S. Use of dental operating microscope in endodontic surgery. Oral Surg Oral Med Oral Pathol 1993;75(6):751-8.
14. Gutmann JL, Harrison JW. Surgical endodontics. Boston: Blackwell Scientific Publications, 1991.
15. Oberli K, Bornstein MM, von Arx T. Periapical surgery and the maxillary sinus: radiographic parameters for clinical outcome. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007;103(6):848-53.
16. Ericson S, Finne K, Persson G. Results of apicoectomy of maxillary canines, premolars and molars with special reference to oroantral communication as a prognostic factor. Int J Oral Surg 1974;3(6):386-93.
17. Selden HS. Endo-Antral syndrome and various endodontic complications. J Endod 1999;25(5):389-93.
18. Pignataro L, Mantovani M, Torretta S, Felisati G, Sambataro G. ENT assessment in the integrated management of candidate for (maxillary) sinus lift. Acta Otorhinolaringol Ital 2008;28:110-9.
19. Watzek G, Bernhart T, Ulm C. Complications of sinus perforations and their management in endodontics. Dental Clinics of North America 1997;41:563-83.
20. Doud Galli S, Lebowitz R, Giacchi R, Glickman R, Jacobs J. Chronic sinusitis complicating sinus lift surgery. American Journal of Rhinology 2001;15:181-6.
21. Chen FM, Zhang J, Zhang M, An Y, Chen F, Wu ZF. A review on endogenous regenerative technology in periodontal regenerative medicine. Biomaterials 2011;32(12):3189-209.
22. Taschieri S, Rosano G, Weinstein T, Bortolin M, Del Fabbro M. Treatment of through-and-through bone lesion using autologous growth factors and xenogeneic bone graft: a case report. Oral Maxillofac Impl 2012;16(1):57-64.
23. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA 2000;284(23):3043-5.
24. Velvart P. Papilla base incision: a new approach to recession-free healing of the interdental papilla after endodontic surgery. Int Endod J 2002;35:453-460.
25. Del Fabbro M, Taschieri S, Weinstein R. Qualità della vita after microscopic periradicular surgery using two different incision techniques: a randomized clinical study. Int Endod J 2009;42(4):360-7.
26. Shugars DA, Benson K, White RP Jr, Simpson KN, Bader JD. Developing a measure of patient perceptions of short-term outcomes of third molar surgery. J Oral Maxillofac Surg 1996;54(12):1402-8.
27. Tsesis I, Shoshani Y, Givol N, Yahalom R, Fuss Z, Taicher S. Comparison of qualità della vita after surgical endodontic treatment using two techniques: a prospective study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005;99(3):367-71.
28. Molven O, Halse A, Grung B. Observer strategy and the radiographic classification of healing after endodontic surgery. Int J Oral Macillofac Surg 1987;16:432-9.
29. Molven O, Halse A, Grung B. Incomplete healing (scar tissue) after periapical surgery. Radiographics findings 8-12 years after treatment. J Endod 1996;22:264-8.
30. Doud Galli S, Lebowitz R, Giacchi R, Glickman R, Jacobs J. Chronic sinusitis complicating sinus lift surgery. Am J Rhinol 2001;15:181-6.
31. Persson G. Periapical surgery of molars. Int J Oral Surg 1982;11(2):96-100.
32. Rud J, Rud V. Surgical endodontics of upper molars: relation to the maxillary sinus and operation in acute state of infection. J Endod 1998;24(4):260-1.
33. Freedman A, Horowitz I. Complications after apicoectomy in maxillary premolar and molar teeth. Int J Oral Maxillofac Surg 1999;28(3):192-4.
34. Hauman CH, Chandler NP, Tong DC. Endodontic implications of the maxillary sinus: a review. Int Endod J 2002;35(2):127-41.
35. Garcia B, Martorell L, Marti E, Peñarrocha M. Periapical surgery of maxillary posterior teeth. A review of the literature. Med Oral Patol Oral Cir Bucal 2006;11(2):E146-50.
36. Testori T, Wallace SS, Del Fabbro M, Taschieri S, Trisi P, Capelli M, Weinstein RL. Repair of large sinus membrane perforations using stabilized collagen barrier membranes: surgical techniques with histologic and radiographic evidence of success. Int J Periodontics Restorative Dent 2008;28(1):9-17.
37. Del Fabbro M, Bortolin M, Taschieri S, Weinstein R. Is platelet concentrate advantageous for the surgical treatment of periodontal diseases? A systematic review and meta-analysis. J Periodontol 2011;82(8):1100-11.
38. Del Fabbro M, Bortolin M, Taschieri S. Is autologous platelet concentrate beneficial for post-extraction socket healing? A systematic review. Int J Oral Maxillofac Surg 2011;40(9):891-900.
39. Del Fabbro M, Bortolin M, Taschieri S, Weinstein RL. Effect of autologous growth factors in maxillary sinus augmentation: a systematic review. Clin Implant Dent Relat Res 2013;15(2):205-16.
40. Anitua E, Prado R, Orive G. A lateral approach for sinus elevation using PRGF technology. Clin Implant Dent Relat Res 2009;11(1):e23-31.
41. Anitua E, Prado R, Orive G. Bilateral sinus elevation evaluating plasma rich in growth factors technology: a report of five cases. Clin Implant Dent Relat Res 2012;14(1):51-60.
42. Anitua E, Sanchez M, Nurden AT, Nurden P, Orive G, Andia I. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol 2006;24(5):227-34.
43. El-Sharkawy H, Kantarci A, Deady J, Hasturk H, Liu H, Alshahat M, Van Dyke TE. Platelet-rich plasma: growth factors and pro- and anti-inflammatory properties. J Periodontol 2007;78(4):661-9.
44. Woodall J Jr, Tucci M, Mishra A, Asfour A, Benghuzzi H. Cellular effects of platelet rich plasmainterleukin1 release from prp treated macrophages. Biomed Sci Instrum 2008;44:489-94.
45. Bielecki TM, Gazdzik TS, Arendt J, Szczepanski T, Krol W, Wielkoszynski T. Antibacterial effect of autologous platelet gel enriched with growth factors and other active substances: an in vitro study. J Bone Joint Surg Br 2007;89(3):417-20.