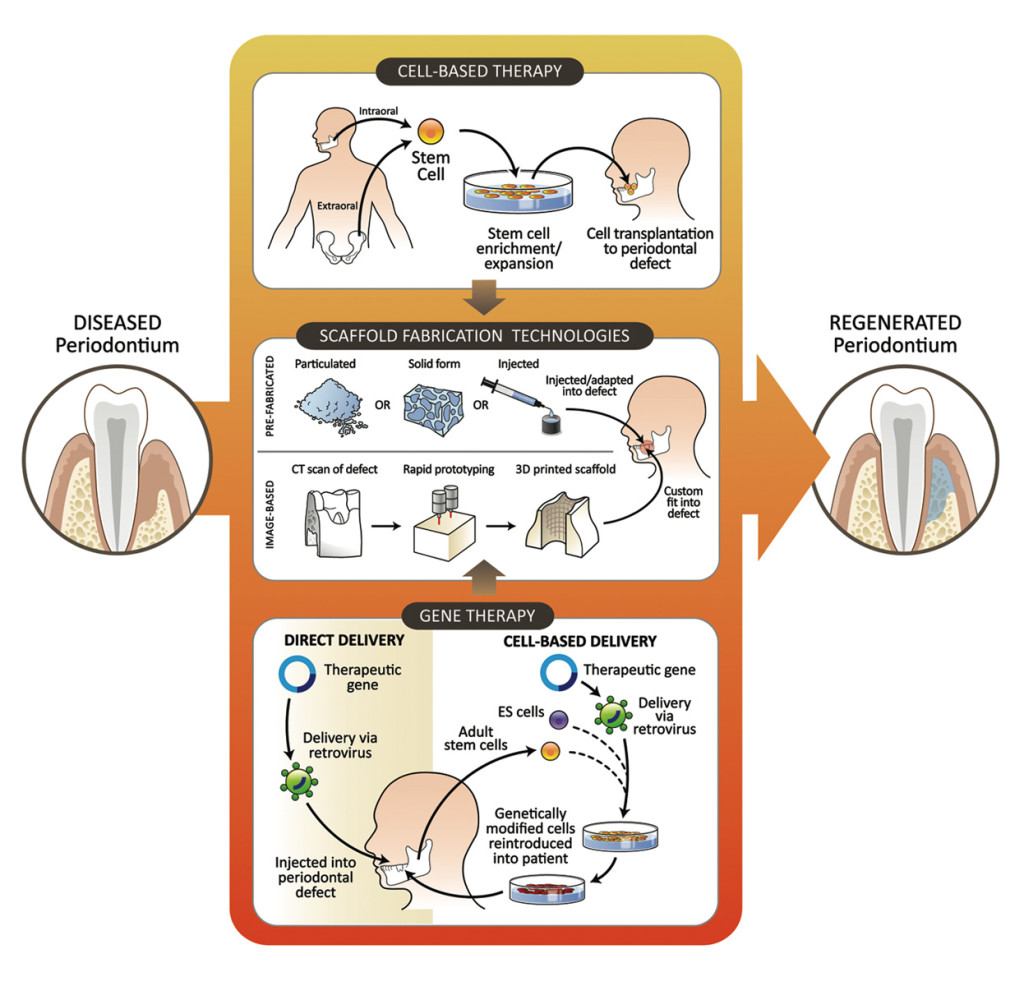
La scienza dell’Ingegneria Tissutale cerca continuamente di trovare strategie più facili, più veloci e maggiormente predicibili per la rigenerazione di tessuti persi per eventi patologici o traumatici. Tra le diverse strategie di Ingegneria Tissutale oggi studiate per la rigenerazione di nuovi tessuti, le terapie cellulari risultano particolarmente promettenti. In odontoiatria questa e altre tecniche di Ingegneria Tissutale trovano applicazione pratica nella rigenerazione di osso, polpa dentale o mucosa cheratinizzata1 (figura 1).
 Gli impianti dentali sono tra le protesi di maggior successo in medicina; fin dalla loro introduzione hanno permesso nuovi approcci terapeutici per pazienti affetti da diversi tipi di edentulia. Data l’estesa utilizzazione degli impianti in odontoiatria (l’Italia vanta il più alto indice di penetrazione al mondo), le terapie di rigenerazione ossea hanno assunto particolare importanza nelle tecniche di preparazione del sito implantare che sono spesso necessarie quando non sono presenti volumi ossei tali da garantire un corretto posizionamento dell’impianto.
Gli impianti dentali sono tra le protesi di maggior successo in medicina; fin dalla loro introduzione hanno permesso nuovi approcci terapeutici per pazienti affetti da diversi tipi di edentulia. Data l’estesa utilizzazione degli impianti in odontoiatria (l’Italia vanta il più alto indice di penetrazione al mondo), le terapie di rigenerazione ossea hanno assunto particolare importanza nelle tecniche di preparazione del sito implantare che sono spesso necessarie quando non sono presenti volumi ossei tali da garantire un corretto posizionamento dell’impianto.
La rigenerazione di un nuovo tessuto
In generale, la rigenerazione di nuovi tessuti richiede l’uso di bio-materiali che possono essere identificati in diverse categorie: impalcature (scaffolds), fattori di crescita e cellule.
Ognuno di questi elementi gioca un ruolo di fondamentale importanza nel processo di guarigione in fasi temporalmente interconnesse2. Nelle terapie rigenerative convenzionali le cellule devono raggiungere la zona dove il nuovo tessuto deve essere generato, migrando dalla periferia della sede di innesto. Gli scaffolds sono utilizzati sia come supporto alla migrazione cellulare sia come impalcature per la deposizione della matrice organica.
Diversi tipi di scaffolds sono comunemente introdotti nello studio odontoiatrico come ad esempio sostituti ossei da innesto.
La migrazione e la differenziazione cellulari sono regolate e stimolate da fattori di crescita che modulano l’attività cellulare e forniscono lo stimolo alle cellule a differenziarsi e produrre la matrice per lo sviluppo del tessuto. I fattori di crescita stimolano anche la produzione di segnali angiogenici che inducono la formazione di una nuova rete vascolare, essenziale per il funzionamento delle cellule quale fonte di nutrienti e ossigeno e quale via di rimozione dei cataboliti. I tentativi di integrazione di fattori di crescita in odontoiatria risalgono all’introduzione del plasma ricco di piastrine (PRP)3 e del plasma ricco di fattori di crescita (PRGF)4. Più recentemente fattori di crescita ricombinanti sono stati analizzati, inclusi il fattore di crescita derivato dalle piastrine (rh PDGF-BB)5-11 e le proteine morfogenetiche dell’osso (BMPs)12-14. Le tecniche di Terapia Cellulare forniscono un’ulteriore fonte di cellule nell’area di interesse. Invece di dipendere completamente dalla capacità delle cellule dell’organismo ospite per la rigenerazione di un nuovo tessuto e per la produzione di fattori di crescita, le cellule innestate sono pronte alla produzione di nuovi tessuti e permettono un rilascio costante di citochine durante le varie fasi della guarigione.
Terapia Cellulare
Due principali tipi cellulari sono utilizzati nell’ingegnerizzazione di un nuovo tessuto: cellule somatiche e cellule staminali. Durante il processo di differenziazione le cellule staminali mantengono la loro capacità di autorinnovamento ma perdono quella di differenziarsi verso diverse linee cellulari. Alla fine del processo di differenziazione, le cellule staminali unipotenti manterranno la capacità di autorinnovamento ma saranno capaci di differenziarsi verso un’unica linea cellulare. Da queste derivano cellule somatiche (ad esempio, muscolari, nervose, del sistema immunitario) che non hanno proprietà di autorinnovamento ma che possono comunque essere coltivate e utilizzate nell’ingegnerizzazione di nuovi tessuti.
Cellule somatiche
Cellule somatiche coltivate e rivolte alla costruzione di tessuti sono state studiate e testate in diverse branche della medicina contemporanea, ma solo recentemente queste strategie sono state utilizzate in parodontologia. Dogan et al. hanno trovato migliore rigenerazione ossea utilizzando cellule derivate dal legamento parodontale in difetti forcali creati artificialmente in relazione ai controlli15. Fibroblasti coltivati sono stati usati nel trattamento di insufficienze papillari interdentali con risultati soddisfacenti16. Un’equivalente di mucosa orale umana ingegnerizzata è stata assemblata con successo ex vivo da Izumi et al. e sembra essere un’accettabile sostituto per procedure di innesto intraorale nell’uomo17. McGuire et al. hanno paragonato l’efficacia di cheratinociti e fibroblasti neonatali con l’innesto di gengiva libera dimostrando che l’uso di tali cellule porta alla creazione di un’adeguata banda di gengiva cheratinizzata senza bisogno di ricorrere a un sito donatore18,19. Inoltre, Morelli et al. hanno scoperto che l’espressione di biomarkers associata all’angiogenesi in siti trattati con questo composto cellulare vivente è sovra-regolata in relazione agli innesti di gengiva libera durante le prime fasi di guarigione20. In una serie di case-reports Somerman et al. hanno dimostrato la possibilità di utilizzo di terapie cellulari con cementoblasti clonati21. Zhao et al. hanno trovato che il trapianto di cementoblasti clonati in carriers di acido poli(lattico-co-glicolico) (PLGA) porta alla riparazione di grandi difetti parodontali in un modello murino22. Jin et al. hanno mostrato che l’utilizzo di fibroblasti cutanei transdotti con il gene BMP-7 in difetti ossei parodontali promuove la generazione di nuovi tessuti, inclusi osso, legamento parodontale funzionale e cemento radicolare23. Queste strategie offrono prospettive nello sviluppo di terapie ottimali per la rigenerazione parodontale, tuttavia l’uso di cellule somatiche permette solamente la rigenerazione di tessuti ai quali le cellule innestate sono destinate; inoltre, la possibilità di ottenere rigenerazione è strettamente legata alle concentrazioni di cellule raggiunte nell’area di innesto.
Cellule staminali
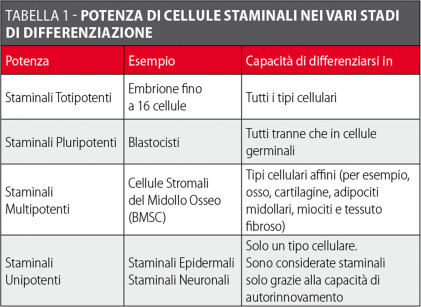
Le cellule staminali, d’altra parte, mantengono la capacità di autorinnovamento attraverso divisione cellulare mitotica e possono differenziarsi verso diversi tipi di cellule specializzate (Tabella 1).
 Uno dei benefici più importanti nell’utilizzo di certe popolazioni di cellule staminali è che una volta trapiantate nel sito di innesto possono differenziarsi in cellule strettamente osteogeniche così come in “cellule di supporto all’osteogenesi”. Tali cellule di supporto sono definite come cellule che non producono direttamente osso ma che generano strutture che facilitano questo processo (come ad esempio la rete vascolare). Un altro vantaggio concerne la capacità di autorinnovamento, che permette alle cellule di proliferare continuamente durante la guarigione fin tanto che i segnali del tessuto ospite lo richiederanno. È stato altresì ipotizzato che cellule staminali mesenchimali possano avere un ruolo nella prevenzione dell’infiammazione nel sito di innesto24 permettendo una più veloce rigenerazione tissutale.
Uno dei benefici più importanti nell’utilizzo di certe popolazioni di cellule staminali è che una volta trapiantate nel sito di innesto possono differenziarsi in cellule strettamente osteogeniche così come in “cellule di supporto all’osteogenesi”. Tali cellule di supporto sono definite come cellule che non producono direttamente osso ma che generano strutture che facilitano questo processo (come ad esempio la rete vascolare). Un altro vantaggio concerne la capacità di autorinnovamento, che permette alle cellule di proliferare continuamente durante la guarigione fin tanto che i segnali del tessuto ospite lo richiederanno. È stato altresì ipotizzato che cellule staminali mesenchimali possano avere un ruolo nella prevenzione dell’infiammazione nel sito di innesto24 permettendo una più veloce rigenerazione tissutale.
Cellule stromali del midollo osseo
La fonte principale di cellule staminali utilizzata in medicina è costituita dallo stroma del midollo osseo contenente cellule stromali del midollo osseo (BMSC)25. Queste cellule sono anche dette cellule staminali mesenchimali (MSCs) e sono caratterizzate da una elevata capacità di autorinnovamento e dall’abilità di generare tessuto osseo, cartilagine, adipociti midollari, miociti e tessuto fibroso quando trapiantate in vivo.
Ognuno di questi tessuti può essere originato da una singola Unità Formanti Colonie fibroblastiche (UFC-F o CFU-F)26.
Lungo il percorso di differenziazione, stimoli differenziativi limitativi o induttivi possono portare a cellule caratterizzate da una minore capacità di autorinnovamento e da un maggior grado di differenziazione25; eppure questo percorso sembra essere reversibile in modo tale che un adipocita adulto possa de-differenziarsi a livelli di maggior capacità generative e poi differenziarsi verso il percorso osteogenico27.
Nonostante l’importanza di tali considerazioni, prenderemo in analisi principalmente cellule originate da Unità Formanti Colonie osteoblastiche (UFC-OB o CFU-OB).
Cellule osteoprogenitrici sottoposte a determinati stimoli entrano in mitosi e producono cellule che si differenziano in pre-osteoblasti e successivamente in osteoblasti. Diversi studi hanno confermato formazione ossea in localizzazioni ectopiche, dove erano state impiantate MSCs28. Questo potrebbe essere il risultato della capacità delle MSCs di stimolare la produzione di molecole osteoinduttive29.
In chirurgia maxillo-faciale, blocchi ossei allogenici impregnati di midollo osseo aspirato dalla cresta iliaca anteriore sono stati usati con successo nel trattamento di pazienti con creste alveolari severamente compromesse offrendo un’alternativa meno invasiva rispetto al prelievo di osso da una seconda sede chirurgica30. Un case report ha utilizzato MSCs isolate da aspirati di midollo dalla cresta in combinazione a plasma ricco di piastrine in difetti parodontali angolari e ha suggerito un possibile ruolo di questo composto cellulare in rigenerazione parodontale31.
Uno studio di Marei et al. ha trovato che impiantando uno scaffold poroso ingegnerizzato e innestato di BMSCs era possibile ottenere una migliore preservazione delle pareti alveolari rispetto ai gruppi controllo32. Trapiantate in un difetto osseo, le MSCs hanno dimostrato di rimanere nella sede di innesto contribuendo alla formazione ossea in qualità di cellule osteoblastiche differenziate. In questo studio, la rigenerazione ossea mediata da MSC è risultata maggiore rispetto ai gruppi controllo33.
Aspirati di midollo osseo freschi utilizzati come materiale da innesto nell’alveolo post-estrattivo hanno dimostrato riassorbimento osseo di grado minore in rapporto ai controlli34.
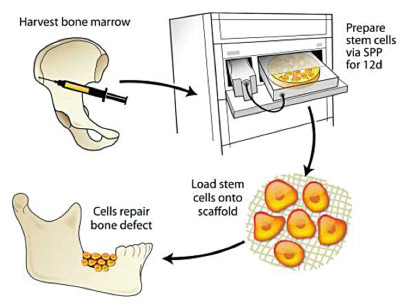
Il nostro gruppo ha recentemente valutato Tissue Repair Cells, un composto cellulare derivante da midollo osseo autologo coltivato utilizzando bioreattori automatizzati raggiungendo concentrazioni di cellule staminali non raggiungibili attraverso un semplice aspirato midollare (figura 2). Abbiamo scoperto che questo composto cellulare è capace di produrre una significativa concentrazione di citochine e che mantiene l’abilità delle cellule di differenziarsi in cellule endoteliali e produrre fattori angiogenici35. Il fondamento logico dietro l’uso di questo composto non è solamente relativo alla capacità di apportare MSCs in uno stadio di differenziazione precoce ma anche alla capacità di apportare cellule osteogeniche di sostegno che non producono osso direttamente ma ne facilitano la deposizione attraverso la creazione di strutture indispensabili al processo di rigenerazione (ad esempio, la rete vascolare). Inoltre, queste cellule sono state largamente caratterizzate dimostrando coefficienti medi di espansione delle concentrazioni cellulari di 234 per le cellule staminali mesenchimali CD90+ (Thy1), di 405 per le CD166+ e di 780 per le CD 105/166+36 e sono state utilizzate per oltre 12 anni nel trattamento di più di 300 pazienti senza che sia mai stato riportato alcun evento avverso relativo al trattamento.
Altre fonti di cellule staminali
Altre possibili fonti di cellule staminali sono state analizzate: quelle derivate dall’adipe (ASCs) hanno dimostrato di promuovere rigenerazione parodontale in vivo. Poiché aspirati di tessuto adiposo sono facilmente disponibili e il loro prelievo induce minima morbidità, le ASCs potrebbero essere utili in future tecniche di rigenerazione parodontale basate su terapie cellulari37.
Oltre che nel midollo osseo, è stato riportato che cellule staminali post-natali sono presenti in tessuti adulti quali il fegato, i muscoli, la polpa dentale (DPSCs) e il legamento parodontale (PDLSCs). Le MSCs esistono in vari tessuti dentali e possono differenziarsi in osteoblasti, adipociti e altri tipi cellulari con diverso rendimento38. Si è dimostrato che la criopreservazione di terzi molari è una metodica adeguata e con un buon rapporto efficacia/prezzo per la preservazione delle cellule MSC e che queste mantengono le loro caratteristiche di cellule staminali mesenchimali. Questa scoperta ha aperto la strada alla possibile costituzione di una banca di MSC con minimo bisogno di manipolazioni39.
Cellule staminali sono state isolate da polpa dentale di denti decidui e hanno dimostrato di mantenere la capacità di differenziarsi in osteoblasti e indurre la formazione di osso, dentina e polpa dentale40-42. Seo et al. sono riusciti a ottenere da legamenti parodontali criopreservati di denti decidui estratti cellule staminali post-natali con normali caratteristiche di cellule staminali del legamento parodontale43. Le cellule umane del legamento parodontale hanno la capacità di differenziarsi in cellule simili a cementoblasti, adipociti, e cellule formanti collagene capaci di generare strutture simili a cemento/legamento parodontale contribuendo alla riparazione dei tessuti parodontali44.
Recentemente, attraverso il trapianto di cellule progenitrici del legamento parodontale è stato dimostrato il principio di poter ottenere strutture ibride legamento-impianto dentale45,46. Perciò esiste un considerevole potenziale per l’uso di cellule staminali o di cellule progenitrici del legamento parodontale per formare in vivo tessuti parodontali duri e molli.
Attraverso manipolazione genetica un gruppo dell’Università di Kyoto è stato capace di riprogrammare cellule somatiche murine generando cellule staminali pluripotenti indotte (iPS cells) che sembrano essere completamente simili alle cellule staminali normalmente utilizzate47. Lo stesso gruppo è stato anche capace di riprogrammare fibroblasti del derma adulto a uno stato di cellule pluripotenti48. In maniera simile, al Genome Center del Wisconsin linee di cellule staminali pluripotenti indotte sono state derivate da cellule somatiche umane riprogrammando il nucleo delle cellule somatiche a uno stadio di minor differenziazione49. Risultati simili sono stati ottenuti dall’interazione tra due gruppi dal Children’s Hospital di Boston e dal Dana Farber Cancer Institute di Boston50. Eliminate certe limitazioni tecniche (per esempio, la mutazione attraverso virus) questi risultati potrebbero permettere l’utilizzo di cellule staminali senza gli svantaggi legati alle tecniche necessarie al prelievo di midollo dal paziente stesso.
In alternativa alla riprogrammazione di cellule somatiche, risultati incoraggianti sono stati ottenuti verso l’istituzione di banche di cellule iPS che presentano tipi diversi di antigeni leucocitari umani (HLA). Questa collaborazione tra le università di Kyoto e di Gifu ha dimostrato la possibilità di utilizzare cellule della polpa dentale (DPCs) come fonte per l’istituzione di banche di cellule iPS che si stima possano coprire circa il 20% della popolazione giapponese51.
La possibilità di istituire banche di linee di cellule staminali umane pluripotenti (hPSC) suddivise per tipo di HLA potrebbe migliorare il rapporto efficacia/prezzo e l’attuabilità dei diversi sistemi di terapia cellulare in medicina e odontoiatria unitamente a una maggiore sicurezza e possibilità di controllo di tali terapie.
Conclusioni
Molti sforzi sono stati diretti nella ricerca di strategie rigenerative più veloci, più efficaci e maggiormente predicibili. Un gran volume di letteratura è stato pubblicato sull’uso di scaffolds e recentemente anche tecniche utilizzanti fattori di crescita e terapie cellulari sono state valutate. Tecniche di terapia cellulare hanno dimostrato un ottimo potenziale nella rigenerazione di nuovi tessuti. L’uso di cellule staminali mesenchimali autologhe è sicuro ed è stato studiato a fondo; questa metodica costituisce perciò la più promettente linea di ricerca per il prossimo futuro. In ogni modo, molti studi hanno suggerito che nuove fonti di cellule staminali potrebbero aprire la porta verso interessanti linee di ricerca.
Sebbene le terapie cellulari abbiano innumerevoli possibili applicazioni e saranno sicuramente sempre di più utilizzate nel trattamento di molte patologie mediche e odontoiatriche, sembra che sia necessario unire gli sforzi verso una linea di ricerca unificata diretta al trattamento di pazienti con metodologie e materiali standardizzati in modo da poter giustificare con un adeguato supporto della letteratura scientifica l’integrazione delle terapie cellulari nella pratica clinica.
Bibliografia
1. Rios HF et al. Cell- and Gene-Based Therapeutic Strategies for Periodontal Regenerative Medicine. J Periodontol.
2.Taba M Jr et al. Current concepts in periodontal bioengineering. Orthod Craniofac Res 2005; 8(4):292-302.
3. Marx RE et al. Platelet-rich plasma: Growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998;85(6):638-46.
4. Anitua E. Plasma rich in growth factors: preliminary results of use in the preparation of future sites for implants. Int J Oral Maxillofac Implants 1999;14(4):529-35.
5. Camelo M. et al. Periodontal regeneration in human Class II furcations using purified recombinant human platelet-derived growth factor-BB (rhPDGF-BB) with bone allograft. Int J Periodontics Restorative Dent 2003;23(3):213-25.
6. Nevins M et al. Periodontal regeneration in humans using recombinant human platelet-derived growth factor-BB (rhPDGF-BB) and allogenic bone. J Periodontol 2003;74(9):1282-92.
7. Nevins M. et al. Platelet-derived growth factor stimulates bone fill and rate of attachment level gain: results of a large multicenter randomized controlled trial. J Periodontol 2005;76(12):2205-15.
8. McGuire MK et al. rhPDGF-BB promotes healing of periodontal defects: 24-month clinical and radiographic observations. Int J Periodontics Restorative Dent 2006;26(3):223-31.
9. Simion M et al. Vertical ridge augmentation by means of deproteinized bovine bone block and recombinant human platelet-derived growth factor-BB: a histologic study in a dog model. Int J Periodontics Restorative Dent 2006;26(5):415-23.
10. Simion M et al. Vertical ridge augmentation using an equine block infused with recombinant human platelet-derived growth factor-BB: a histologic study in a canine model. Int J Periodontics Restorative Dent 2009;29(3):245-55.
11. Nevins ML et al. Human histologic evaluation of mineralized collagen bone substitute and recombinant platelet-derived growth factor-BB to create bone for implant placement in extraction socket defects at 4 and 6 months: a case series. Int J Periodontics Restorative Dent 2009;29(2):129-39.
12. Howell TH et al. A feasibility study evaluating rhBMP-2/absorbable collagen sponge device for local alveolar ridge preservation or augmentation. Int J Periodontics Restorative Dent 1997;17(2):124-39.
13. Cochran DL et al. Evaluation of recombinant human bone morphogenetic protein-2 in oral applications including the use of endosseous implants: 3-year results of a pilot study in humans. J Periodontol 2000;71(8):1241-57.
14. Fiorellini JP et al. Randomized study evaluating recombinant human bone morphogenetic protein-2 for extraction socket augmentation. J Periodontol 2005;76(4):605-13.
15. Dogan A et al. Assessment of periodontal healing by seeding of fibroblast-like cells derived from regenerated periodontal ligament in artificial furcation defects in a dog: a pilot study. Tissue Eng 2002;8(2):273-82.
16. McGuire MK, Scheyer ET. A randomized, double-blind, placebo-controlled study to determine the safety and efficacy of cultured and expanded autologous fibroblast injections for the treatment of interdental papillary insufficiency associated with the papilla priming procedure. J Periodontol 2007;78(1):4-17.
17. Izumi K et al. Intraoral grafting of an ex vivo produced oral mucosa equivalent: a preliminary report. Int J Oral Maxillofac Surg 2003;32(2):188-97.
18. McGuire MK et al. A pilot study to evaluate a tissue-engineered bilayered cell therapy as an alternative to tissue from the palate. J Periodontol 2008;79(10):1847-56.
19. McGuire MK et al. Living Cellular Construct for Increasing the Width of Keratinized Gingiva. Results from a Randomized, Within-Patient, Controlled Trial. J Periodontol 2011. [Epub ahead of print]
20. Morelli T et al. Angiogenic biomarkers and healing of living cellular constructs. J Dent Res;90(4):456-62.
21. Somerman MJ et al. Evolution of periodontal regeneration: from the roots’ point of view. J Periodontal Res 1999;34(7):420-4.
22. Zhao M et al. Cementoblast delivery for periodontal tissue engineering. J Periodontol 2004;75(1):154-61.
23. Jin QM et al. Gene therapy of bone morphogenetic protein for periodontal tissue engineering. J Periodontol 2003;74(2):202-13.
24. Grande DA et al. Repair of articular cartilage defects using mesenchymal stem cells. Tissue Eng 1995;1(4):345-53.
25. Owen P et al. Bone marrow transplantation: cancer therapy comes of age. J Med Assoc Ga 1998;87(2):145-6, 148.
26. Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues. Science 1997;276(5309):71-4.
27. Park SR, Oreffo RO, Triffitt JT. Interconversion potential of cloned human marrow adipocytes in vitro. Bone 1999;24(6):549-54.
28. Cooper LF et al. Incipient analysis of mesenchymal stem-cell-derived osteogenesis. J Dent Res 2001;80(1):314-20.
29. Nakade O et al. Effect of extracellular calcium on the gene expression of bone morphogenetic protein-2 and -4 of normal human bone cells. J Bone Miner Metab 2001;19(1):13-9.
30. Soltan M et al. Bone Block Allograft Impregnated With Bone Marrow Aspirate. Implant Dent 2007;16(4):329-339.
31. Yamada Y et al. A novel approach to periodontal tissue regeneration with mesenchymal stem cells and platelet-rich plasma using tissue engineering technology: A clinical case report. Int J Periodontics Restorative Dent 2006;26(4):363-9.
32. Marei MK et al. Preservation and regeneration of alveolar bone by tissue-engineered implants. Tissue Eng 2005;11(5-6):751-67.
33. De Kok IJ et al. Evaluation of mesenchymal stem cells following implantation in alveolar sockets: a canine safety study. Int J Oral Maxillofac Implants 2005;20(4):511-8.
34. Pelegrine AA et al. Clinical and histomorphometric evaluation of extraction sockets treated with an autologous bone marrow graft. Clin Oral Implants Res 2010;21(5):535-42.
35. Kaigler D et al. Angiogenic and Osteogenic Potential of Bone Repair Cells for Craniofacial Regeneration. Tissue Eng Part A 2010;16(9):2809-20.
36. Dennis JE et al. Clinical-scale expansion of a mixed population of bone-marrow-derived stem and progenitor cells for potential use in bone-tissue regeneration. Stem Cells 2007;25(10):2575-82.
37. Tobita M et al. Periodontal Tissue Regeneration with Adipose-Derived Stem Cells. Tissue Eng 2007.
38. Jo YY et al. Isolation and characterization of postnatal stem cells from human dental tissues. Tissue Eng 2007;13(4):767-73.
39. Perry BC et al. Collection, cryopreservation, and characterization of human dental pulp-derived mesenchymal stem cells for banking and clinical use. Tissue Eng Part C Methods 2008;14(2):149-56.
40. Laino G et al. An approachable human adult stem cell source for hard-tissue engineering. J Cell Physiol 2006;206(3):693-701.
41. Miura M et al. SHED: stem cells from human exfoliated deciduous teeth. Proc Natl Acad Sci USA 2003;100(10):5807-12.
42. Cordeiro MM et al. Dental pulp tissue engineering with stem cells from exfoliated deciduous teeth. J Endod 2008;34(8):962-9.
43. Seo BM et al. Recovery of stem cells from cryopreserved periodontal ligament. J Dent Res 2005;84(10):907-12.
44. Seo BM et al. Investigation of multipotent postnatal stem cells from human periodontal ligament. Lancet 2004;364(9429):149-55.
45. Gault P et al. Tissue-engineered ligament: implant constructs for tooth replacement. J Clin Periodontol;37(8):750-8.
46. Giannobile WV. Getting to the root of dental implant tissue engineering. J Clin Periodontol 2010;37(8):747-9.
47. Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 2006;126(4):
663-76.
48. Takahashi K et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 2007;131(5):861-72.
49. Yu J et al. Induced pluripotent stem cell lines derived from human somatic cells. Science 2007;318(5858):1917-20.
50. Park IH et al. Reprogramming of human somatic cells to pluripotency with defined factors. Nature 2008;451(7175):141-6.
51. Tamaoki N et al. Dental Pulp Cells for Induced Pluripotent Stem Cell Banking. J Dent Res 2010;89:773-8.