Riassunto
Nel presente lavoro vengono descritti dei protocolli operativi per poter affrontare con sufficiente sicurezza casi clinici avanzati, come il carico immediato, la rigenerazione ossea guidata (GBR) e il trattamento dei siti post estrattivi immediati. Oggi possediamo molte tecniche per potere trattare tali situazioni ma forse è necessario, in base alla letteratura scientifica, tracciare delle linee guida che possano orientare l’operatore verso un trattamento il più possibile prevedibile. Particolare enfasi viene dedicata alla Frequenza di Risonanza, uno strumento di grande ausilio in situazioni a rischio e capace di monitorare le condizioni di stabilità implantare in qualsiasi fase del trattamento.
Summary
The present work introduces clinical protocols designed to treat, with enough confidence, advanced clinical cases, such as immediate loading, guided bone regeneration (GBR) and immediate extraction sites. Today we have many techniques for dealing with such challenging situations but perhaps it is necessary, according to the literature, draw guidelines to help the operator toward a treatment as predictable as possible. Particular emphasis is given to the Resonance Frequency Analysis, an instrument of utmost importance in risk situations and able to monitor the conditions of implant stability at any stage of treatment.
Carico immediato
Il protocollo originale di implantologia osteointegrata, redatto dal professor Brånemark alcuni decenni fa, prevedeva un periodo di guarigione di 3-6 mesi durante i quali l’impianto doveva rimanere in ambiente sommerso allo scopo di evitare ogni trauma nella fase guarigione. Negli anni successivi alcuni ricercatori osservarono che il processo di osteintegrazione poteva avvenire anche in ambiente transmucoso, l’abutment veniva direttamente connesso all’impianto al momento della sua installazione1-3, limitando la chirurgia a un’unica fase.
Un ulteriore sviluppo della procedura implantare è stata realizzato agli inizi degli anni ’90, quando alcuni clinici iniziarono a caricare immediatamente impianti posizionati nella sinfisi mentoniera, ottenendo risultati clinici sorprendenti4,5. Naturalmente la sinfisi mentoniera rappresenta la zona più prevedibile per eseguire il carico immediato, sia per la quantità che per la qualità dell’osso.
Nelle altre aree dei mascellari la quantità e la qualità dell’osso erano meno favorevoli, e infatti inizialmente queste zone davano dei risultati meno soddisfacenti. Per poter estendere il carico immediato anche alle zone con osso più soffice è stato necessario comprendere i fattori e i prerequisiti che stavano alla base della metodica.
Il fattore principale nel carico immediato è rappresentato dalla stabilità implantare nell’osso, che può essere di tipo primario o secondario:
stabilità primaria. È la stabilità meccanica dell’impianto ottenibile al momento dell’inserzione e dipende da alcuni fattori:
- tecnica chirurgica. Il sito chirurgico può essere sottopreparato per ottenere un maggiore ingaggio al momento dell’inserzione6,
- geometria dell’impianto. Una forma conica dell’impianto aumenta considerevolmente la stabilità, specie in osso soffice7,
- sufficiente quantità e qualità di osso. Deve esserci una quantità di osso sufficiente sia in senso orizzontale che verticale. La presenza di osso corticale è associata a un aumento di stabilità implantare con corrispondente incremento dei valori ISQ di Frequenza di Risonanza8. In caso di esposizione di parte dell’impianto è necessario applicare una tecnica GBR per ottenere la copertura ossea delle spire;
stabilità secondaria. È la stabilità biologica che si determina nelle settimane successive all’installazione implantare e si può identificare con l’osteointegrazione. La stabilità secondaria dipende dalle caratteristiche della superficie impiantare: impianti con superficie ruvida sono in grado di accelerare il processo di osteointegrazione4,9,10.
La stabilità primaria (meccanica) può diminuire lentamente a partire dal giorno dell’intervento mentre quella secondaria (biologica) mostra un costante incremento (Figura 1).
Nel carico immediato è fondamentale avere:
- una stabilità primaria ottimale che impedisca micromovimenti dell’impianto durante le prime settimane di guarigione;
- una stabilità secondaria più precoce, che induca un più rapido processo di osteointegrazione.
Come abbiamo detto, gli impianti con una geometria leggermente conica determinano una compressione ed espansione ossea durante l’inserimento, garantendo una maggiore stabilità primaria. Vanden Bogaerde e coll.11. In uno studio multicentrico prospettico hanno installato 124 impianti conici a superficie liscia in mascellari superiori e mandibole posteriori, li hanno caricati precocemente entro 15 giorni dalla chirurgia, e ne hanno osservato i risultati a 18 mesi. La percentuale totale di sopravvivenza implantare è stata del 96,8%.
Nelle prime settimane dopo la chirurgia implantare si assiste a un rimaneggiamento del tessuto osseo perimplantare con possibili cambiamenti nella stabilità.
Abrahamsson e coll.12 hanno condotto uno studio nel cane analizzando da un punto di vista istologico le modificazioni che avvengono nell’interfaccia osso-impianto durante le prime settimane di guarigione.
Il comparto della ferita chirurgica viene inizialmente occupato da coagulo (eritrociti intrappolati in una rete di fibrina) e tessuto di granulazione, rimpiazzato presto da una matrice provvisoria. Il processo di formazione ossea inizia già nella prima settimana con formazione di “woven bone” che continua nelle successive 2 settimane. Dopo 4 settimane inizia già a osservarsi la formazione di osso lamellare e osso midollare. Nello studio è stato, inoltre, osservato che tutto il processo viene accelerato dalla superficie implantare ruvida. Questo lavoro ha evidenziato come vi sia, nel periodo iniziale di guarigione, un considerevole rimaneggiamento osseo con fenomeni infiammatori, di riassorbimento e quindi neoapposizione ossea. Tutto ciò potrebbe essere responsabile del calo di stabilità implantare spesso osservabile clinicamente (mediante frequenza di risonanza) intorno alla 3a-4a settimana.
Gli impianti con superficie ruvida hanno quindi la caratteristica di velocizzare il processo di osteointegrazione, fattore molto importante nel carico immediato. Vanden Bogaerde e coll.13 hanno condotto uno studio multicentrico con un protocollo analogo al loro lavoro precedente (2003) ma utilizzando impianti a superficie ruvida (ossidata). Sono stati posizionati 111 impianti in zone edentule dei mascellari e delle mandibole posteriori e caricati precocemente entro 9 giorni dall’installazione. La valutazione a 18 mesi mostrava il fallimento di un solo impianto con una percentuale di sopravvivenza del 99,1 %.
Analizzando i vantaggi del carico immediato riscontriamo:
- possibilità di ricostruire in tempi brevissimi la funzione estetica compromessa;
- possibilità di ripristinare, almeno parzialmente, la funzione masticatoria compromessa;
- possibilità di conservare i livelli dei tessuti duri e molli;
- abbreviazione significativa dei tempi protesici;
- tempi e costi ridotti per il paziente.
Se invece prendiamo in analisi gli svantaggi del carico immediato, si evidenzia:
- necessità di un monitoraggio frequente nelle prime settimane;
- necessità della collaborazione costante del paziente (selezione del paziente);
- necessità di un protocollo estremamente rigido (non ottemperandolo, anche solo parzialmente, vi sono maggiori possibilità di fallimento implantare);
- necessità di un training particolare dell’operatore.
Emergono due tipologie di controindicazioni al carico immediato:
- assolute, il trattamento non deve essere eseguito nei casi di:
– stabilità primaria insufficiente,
– nella sostituzione degli incisivi superiori e presenza di deep bite,
– fenomeni infiammatori acuti,
– parodontite non trattata; - relative (il trattamento può essere eseguito con un rigido protocollo di controllo) in caso di:
– malattie generali,
– bruxismo,
– parodontite trattata.
Perché, e come, misurare la stabilità implantare
L’implantologia odierna è sempre più protesa a risolvere casi avanzati con situazioni dentali e ossee severamente compromesse. Vi è sempre maggiore richiesta di eseguire il carico precoce o immediato, di trattare immediatamente siti post estrattivi freschi, di combinare carico immediato e rigenerazione ossea, di trattare pazienti con forte bruxismo o con occlusioni anomale. Tutto ciò ha generato una forte necessità di dover quantificare, e quindi misurare, la stabilità implantare non solo all’installazione dell’impianto, ma anche nelle settimane successive.
In altre parole abbiamo bisogno di maggiore capacità diagnostica, allo scopo di:
- sapere quando applicare il carico all’impianto, immediatamente, precocemente o tardivamente;
- sapere quando eliminare il carico dall’impianto, possibilità di “early warning”;
- valutare le condizioni di un impianto in qualsiasi momento;
- trattare con maggiore sicurezza casi a rischio, e quindi fornire al paziente maggiori garanzie;
- avere un’“impronta digitale” dell’impianto che ci consenta una migliore comunicazione con i pazienti e con i colleghi con cui collaboriamo.
La stabilità implantare può essere misurata con diverse metodiche: vediamole.
Torque di inserzione:
- è la misurazione della forza di inserzione dell’impianto fino al valore di completo adattamento all’osso (Seating Torque);
- è una metodica affidabile, ma ci fornisce un unico valore, al momento dell’inserimento dell’impianto, quindi misura solo la stabilità primaria;
- il torque misura le forze di torsione.
Frequenza di risonanza (RFA):
- si tratta di una metodica messa a punto dal dottor Meredith negli anni ’9014,15, sviluppata continuamente nei decenni successivi e oggi realmente affidabile e ripetibile. Centinaia di pubblicazioni internazionali confermano la validità del sistema;
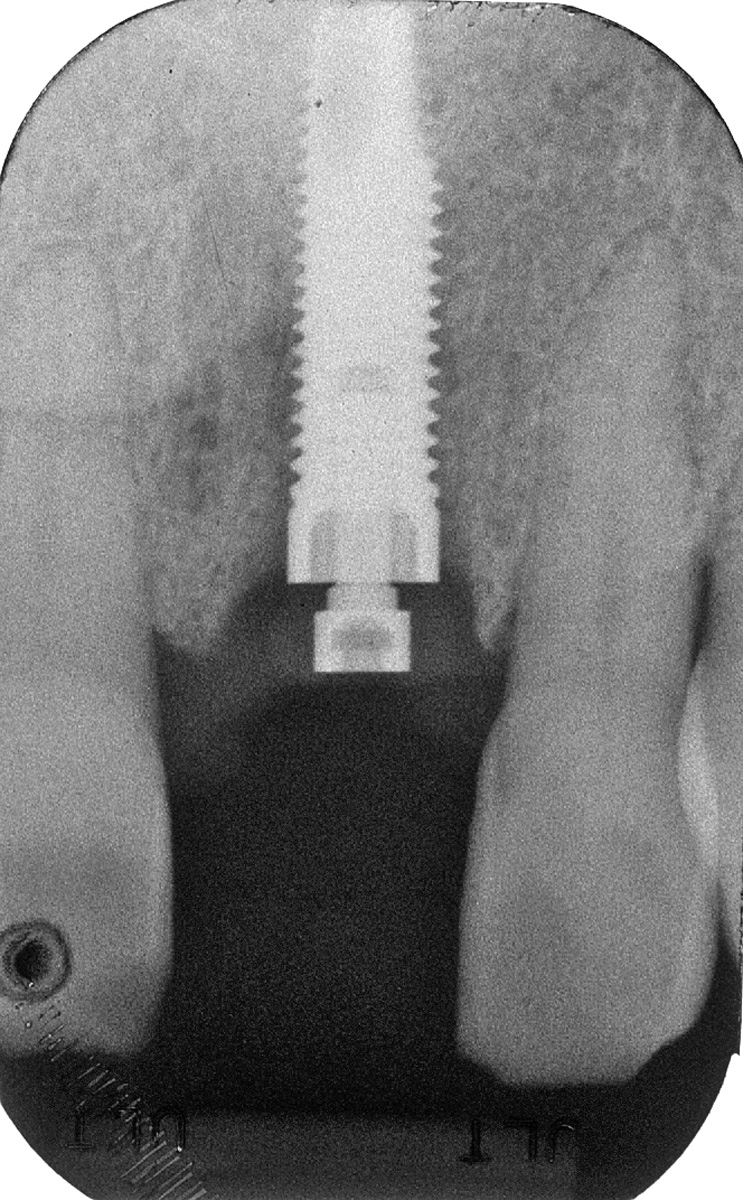
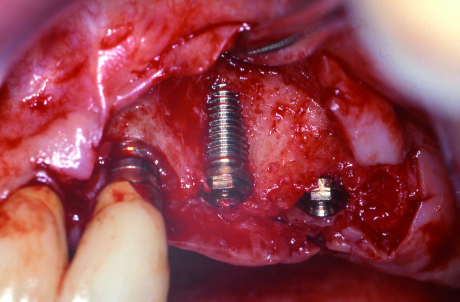
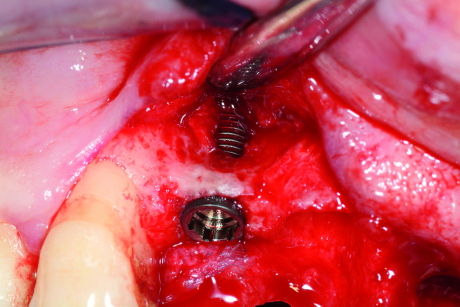
- si basa sul principio del diapason. L’apparecchio emette impulsi magnetici verso uno “smartpeg” inserito sull’impianto, registrandone poi un valore numerico in ISQ (Implant Stability Quotient). La misurazione avviene in modalità “wireless” (Figure 2-3);
-
2. Registrazione del valore di ISQ: un perno magnetico (Smartpeg) viene avvitato sull’impianto e la punta della sonda registra il valore di stabilità in modalità wireless. 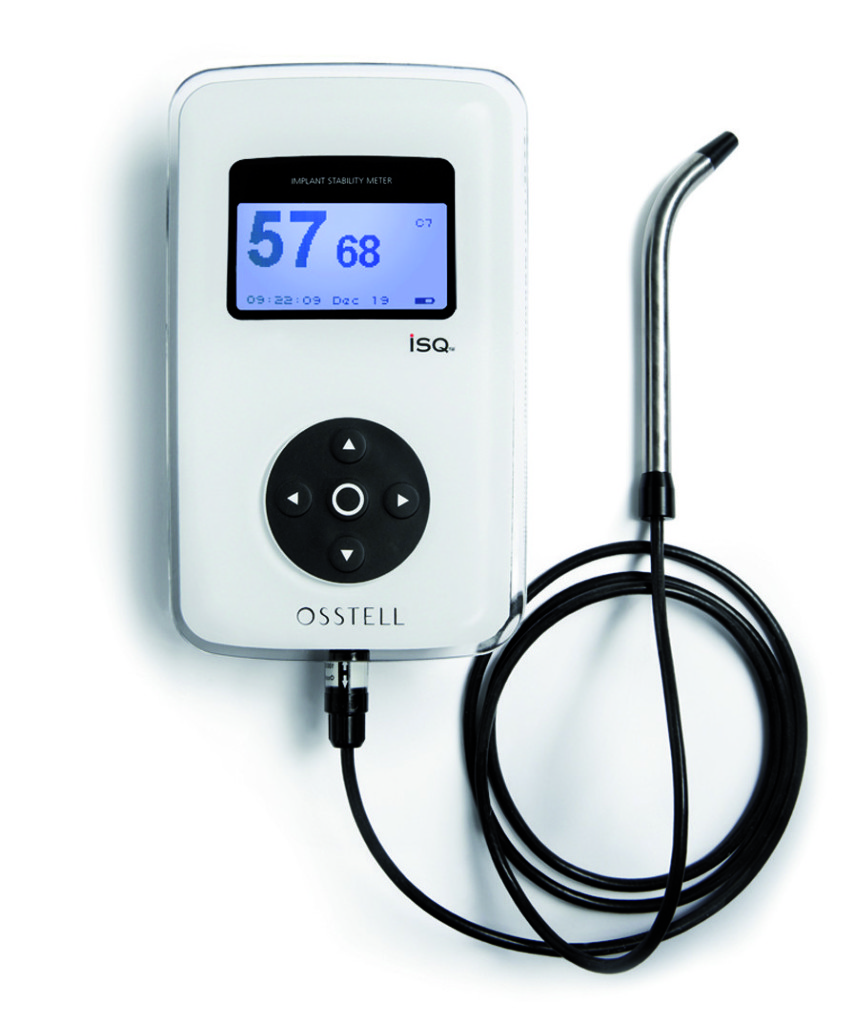
3. Apparecchio per la Frequenza di Risonanza. - è una misurazione molto precisa e può essere ripetuta in qualsiasi momento del trattamento, quindi misura sia la stabilità primaria che quella secondaria;
- ci può fornire due misurazioni del singolo impianto, secondo due assi ortogonali (mesio-distale e bucco-linguale);
- misura il contatto osso-impianto soprattutto nel terzo coronale dell’impianto;
- misura la resistenza ai movimenti in lateralità.
Indicazioni cliniche all’uso della frequenza di risonanza
Carico immediato
La RFA è utile in numerose situazioni cliniche, ma è da considerarsi indispensabile nella procedura di carico immediato. In questo caso, infatti, è fondamentale, durante le prime 6 settimane dall’intervento, eseguire un monitoraggio costante degli impianti per intercettare eventuali cali di stabilità che potrebbero portare al fallimento implantare.
Alcuni Autori16-18 hanno evidenziato un fisiologico calo di stabilità dopo 3-4 settimane, imputabile probabilmente ai fenomeni infiammatori e di rimaneggiamento osseo che seguono la chirurgia12.
In uno studio prospettico Vanden Bogaerde e coll.19 hanno seguito, mediante RFA, 69 impianti Neoss per 18 mesi, evidenziando una leggera perdita di stabilità dopo 4 settimane, più marcata nel mascellare superiore che nella mandibola. Il valore medio di ISQ al baseline era di 68 ISQ, mentre risaliva a 72 ISQ dopo 6 mesi. Nello studio sono stati posizionati anche impianti in siti post-estrattivi immediati: è stato osservato che in caso di difetti ossei residui di tipo “closed”13 la stabilità media al baseline era comunque piuttosto elevata, con un valore di 65.8 ISQ. Nei difetti di tipo “open”, invece, la stabilità era piuttosto bassa, prossima alla soglia di fattibilità, con un valore di 51 ISQ.
Carico immediato in siti post-estrattivi immediati
La possibilità di inserire impianti in siti post-estrattivi immediati e caricarli immediatamente è stata analizzata in uno studio clinico prospettico20 in cui sono stati inseriti 50 impianti in siti estrattivi freschi. I risultati a 18 mesi hanno indicato la sorprendente percentuale di successo del 100%. L’analisi con la frequenza di risonanza, eseguita al baseline, dopo 1, 3, 4, 6 settimane e dopo 3, 6 mesi ha evidenziato tre tipi di curve: un primo gruppo di impianti ha mantenuto la stabilità nel tempo, un secondo ha mostrato un aumento progressivo di stabilità mentre un terzo gruppo, più esiguo, ha evidenziato un iniziale calo con un mantenimento nel periodo di osservazione.
Carico immediato in combinazione con la GBR
Il carico immediato può essere eseguito, in casi ben selezionati e controllati, anche su impianti che, in considerazione di mancanza d’osso localizzata, sono sottoposti a procedura di GBR. Mediante la RFA possiamo seguire l’evolversi del processo rigenerativo, constatando che dopo almeno 6 mesi la rigenerazione ossea è avvenuta a dispetto della iniziale esposizione implantare e che i valori di ISQ sono cresciuti in modo proporzionale alla rigenerazione stessa. In uno studio su cadavere21 sono stati estratti tutti i denti naturali e sostituiti con impianti posizionati nei siti post-estrattivi. È stato misurato il torque di inserzione, la frequenza di risonanza e la profondità dei difetti ossei. Lo studio ha dimostrato una proporzionalità diretta tra i difetti verticali perimplantari e i valori di frequenza di risonanza.
Carico immediato nel gruppo incisivo superiore
Il carico immediato eseguito nel gruppo incisivo superiore è una delle situazioni più a rischio di fallimento. In presenza di un severo deep bite si configura addirittura una reale controindicazione al trattamento, mentre in situazioni occlusali più favorevoli possiamo eseguire il carico immediato a condizione di effettuare un costante monitoraggio durante le prime settimane di guarigione. È comunque sempre indispensabile eliminare dalle protesi provvisorie qualsiasi tipo di contatto occlusale e istruire il paziente sulla necessità di evitare qualsiasi atteggiamento o abitudine viziata che possa determinare un trauma sull’elemento interessato.
Possibilità di intercettare un fallimento implantare
La frequenza di risonanza fornisce una possibilità che nessun altro strumento finora ci ha consentito: la possibilità di intercettare un fallimento implantare prima che esso si concretizzi realmente. Infatti, il monitoraggio continuo dell’impianto con la RFA ci permette di ottenere una “curva di stabilità” implantare.
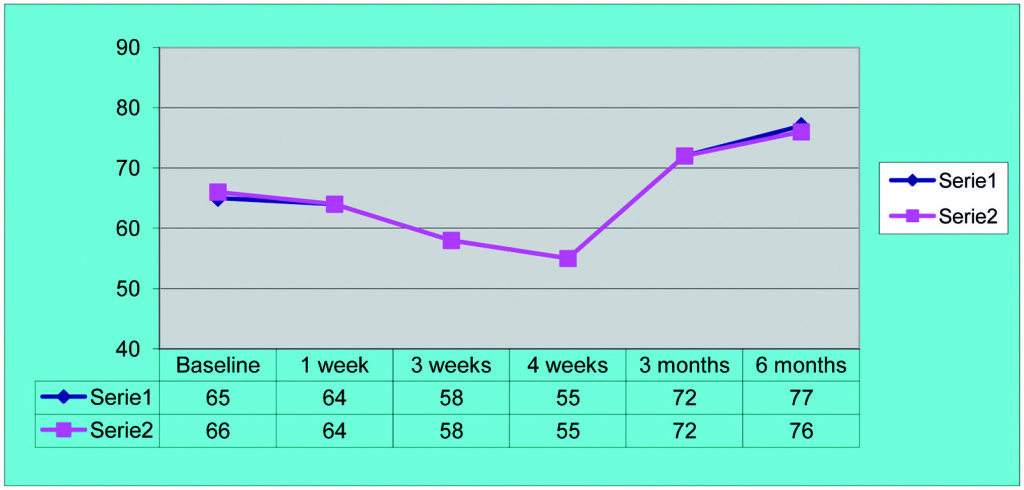
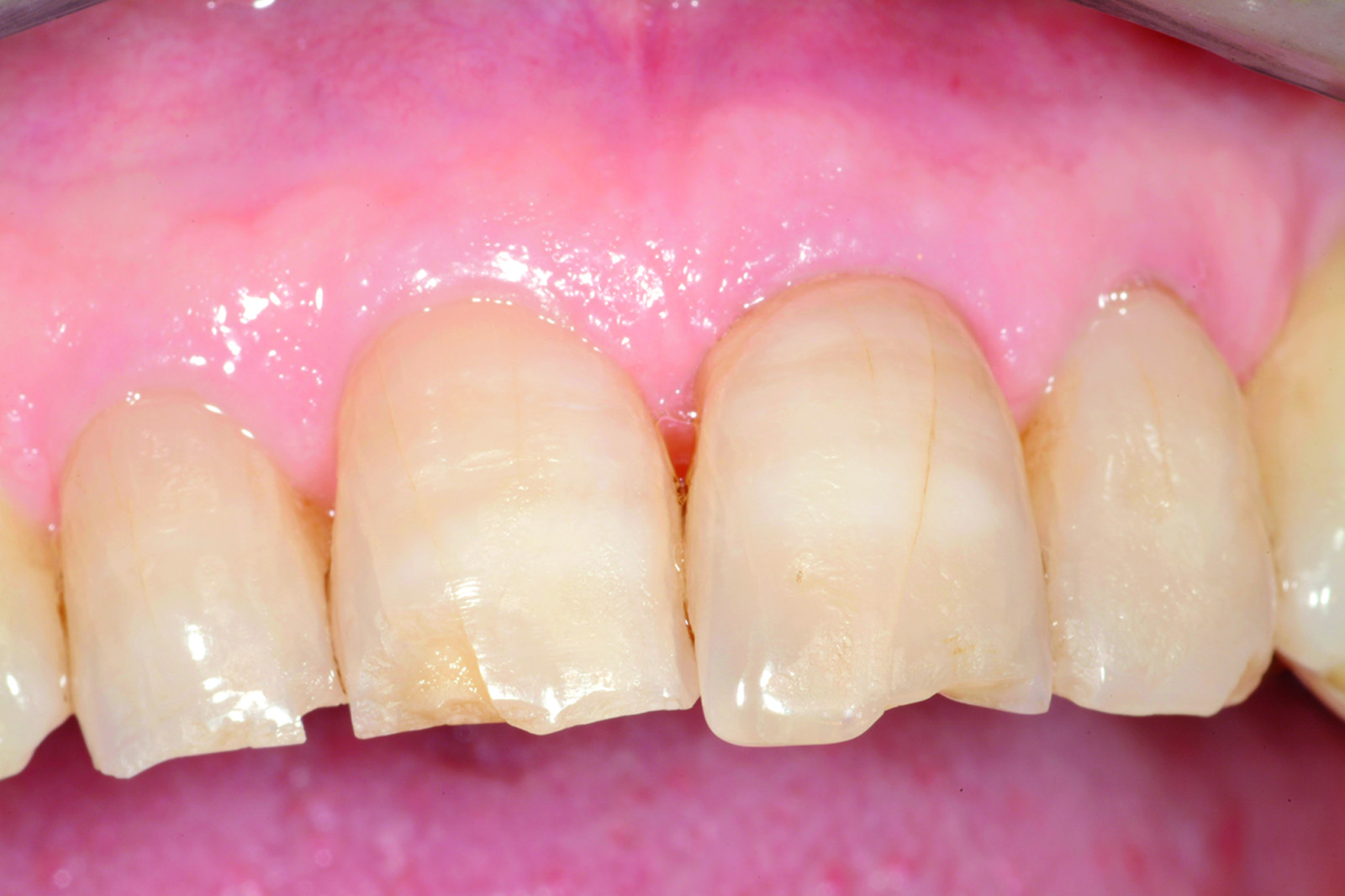
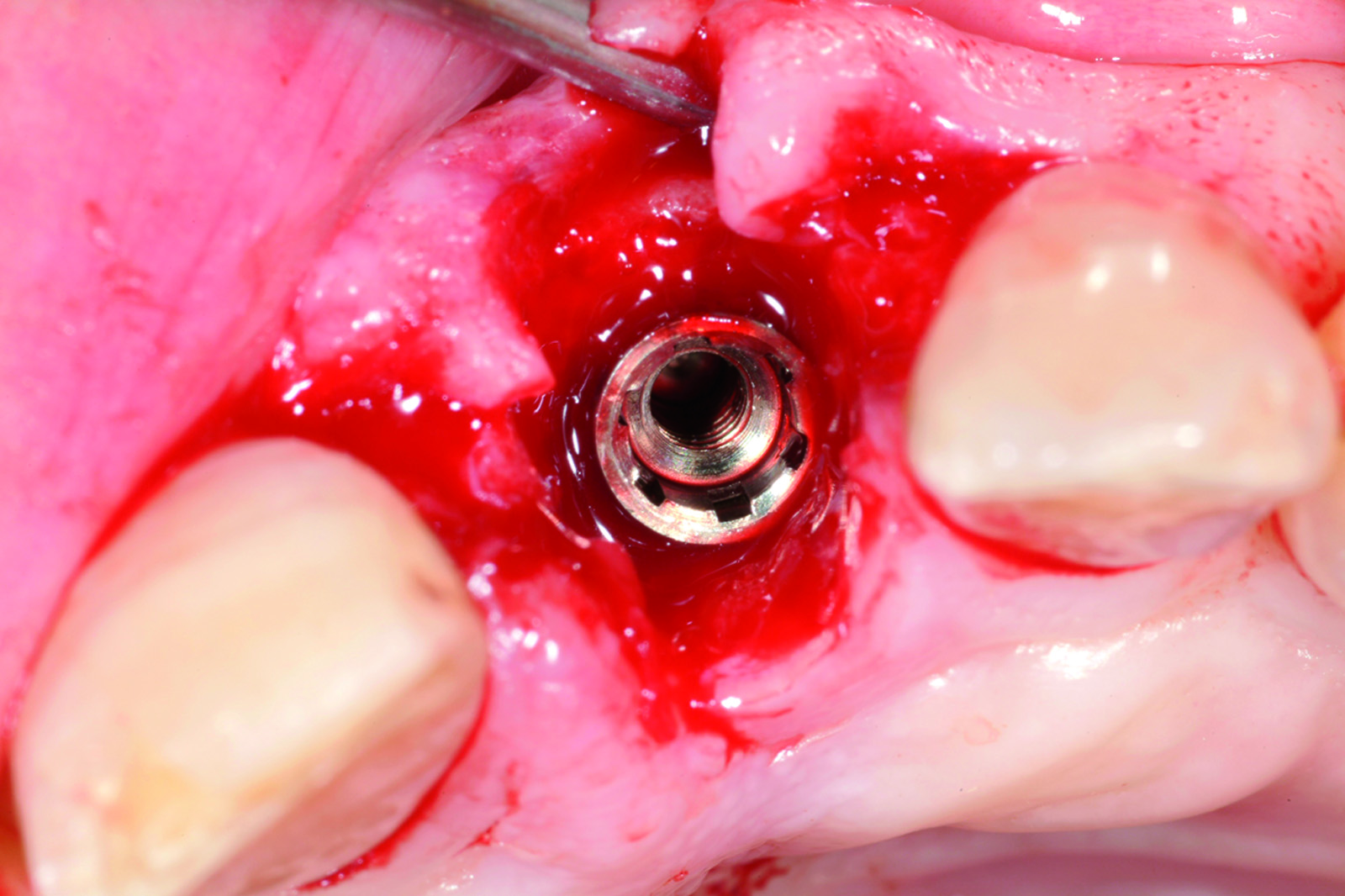
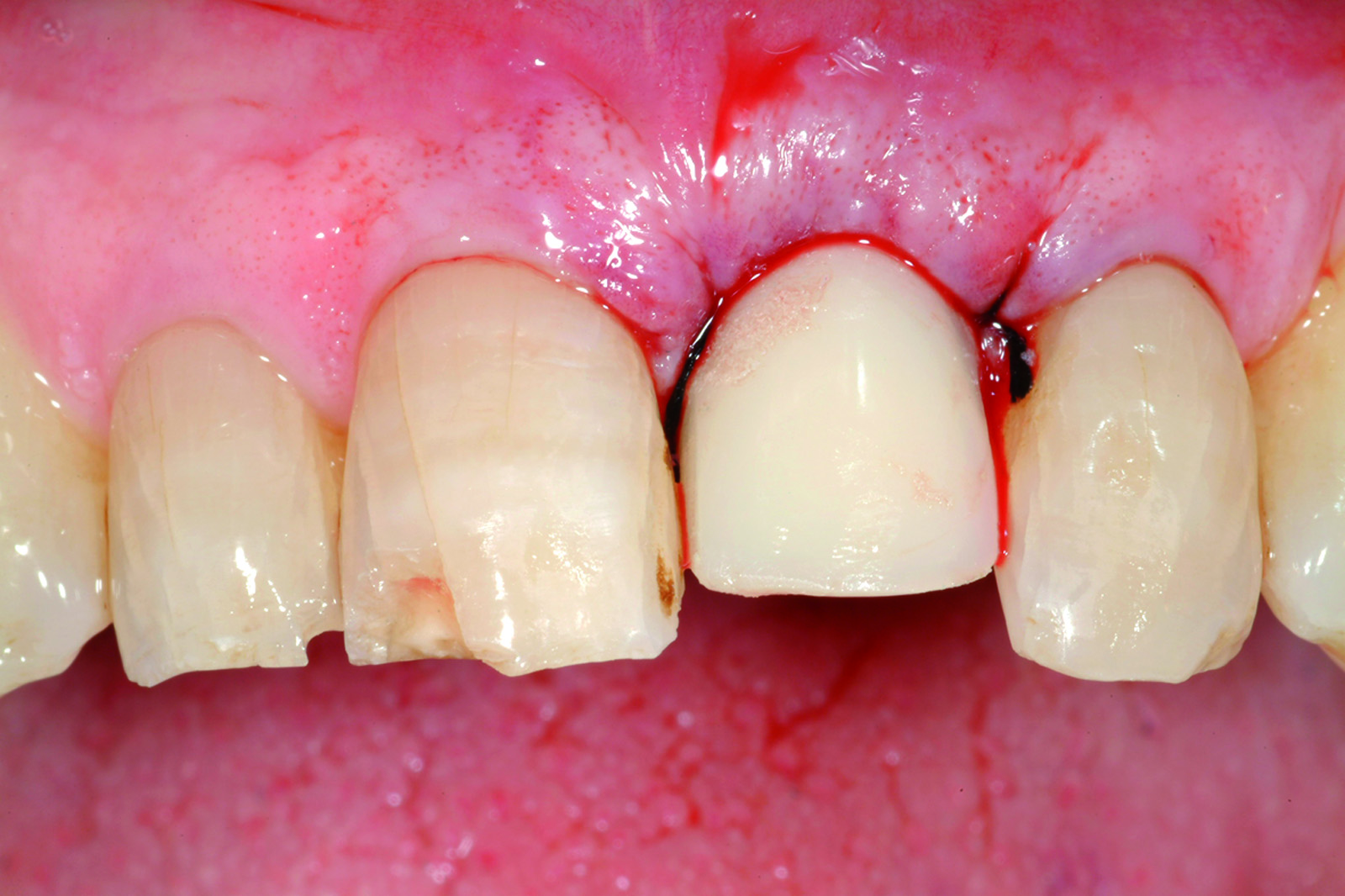
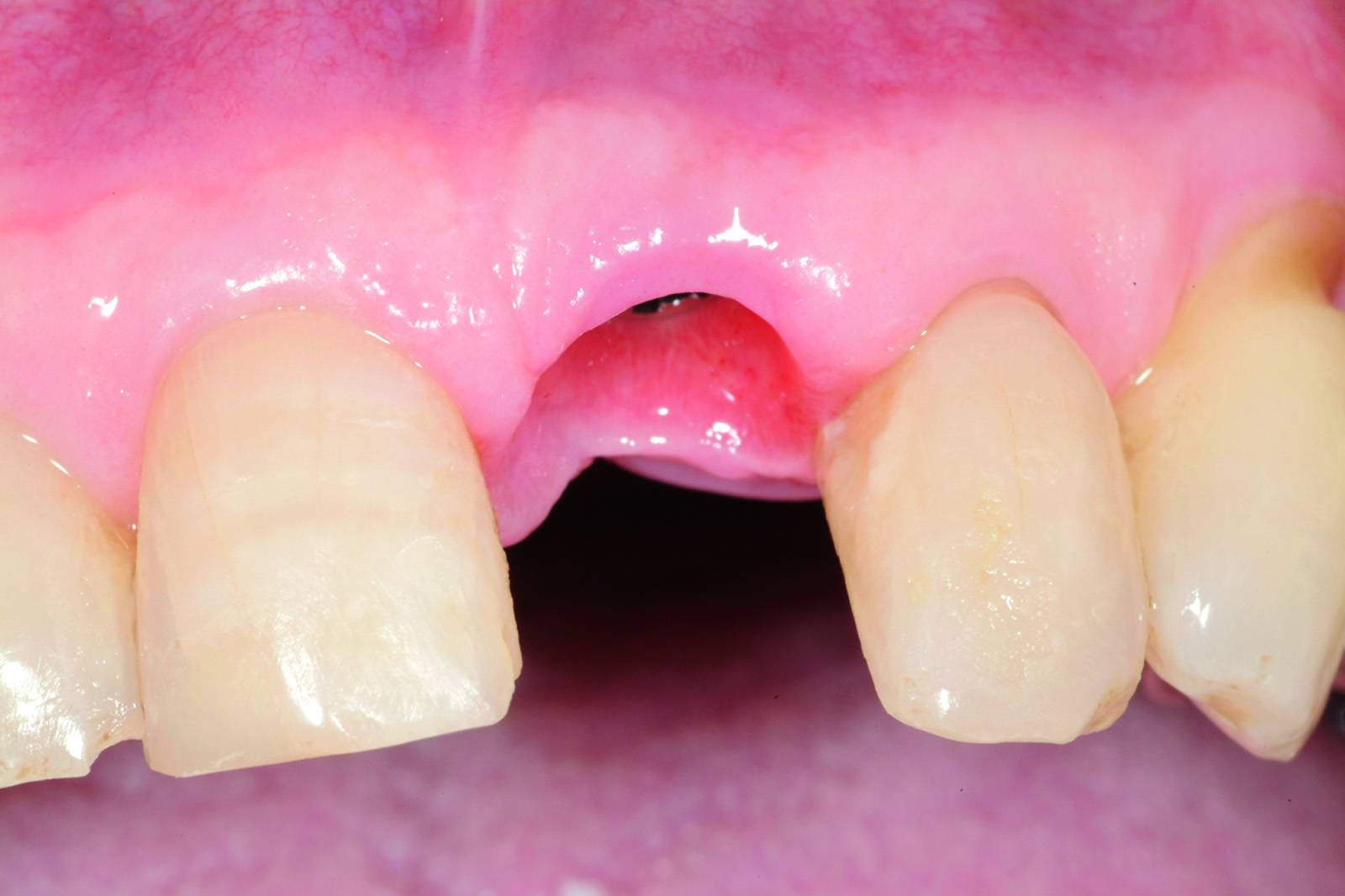
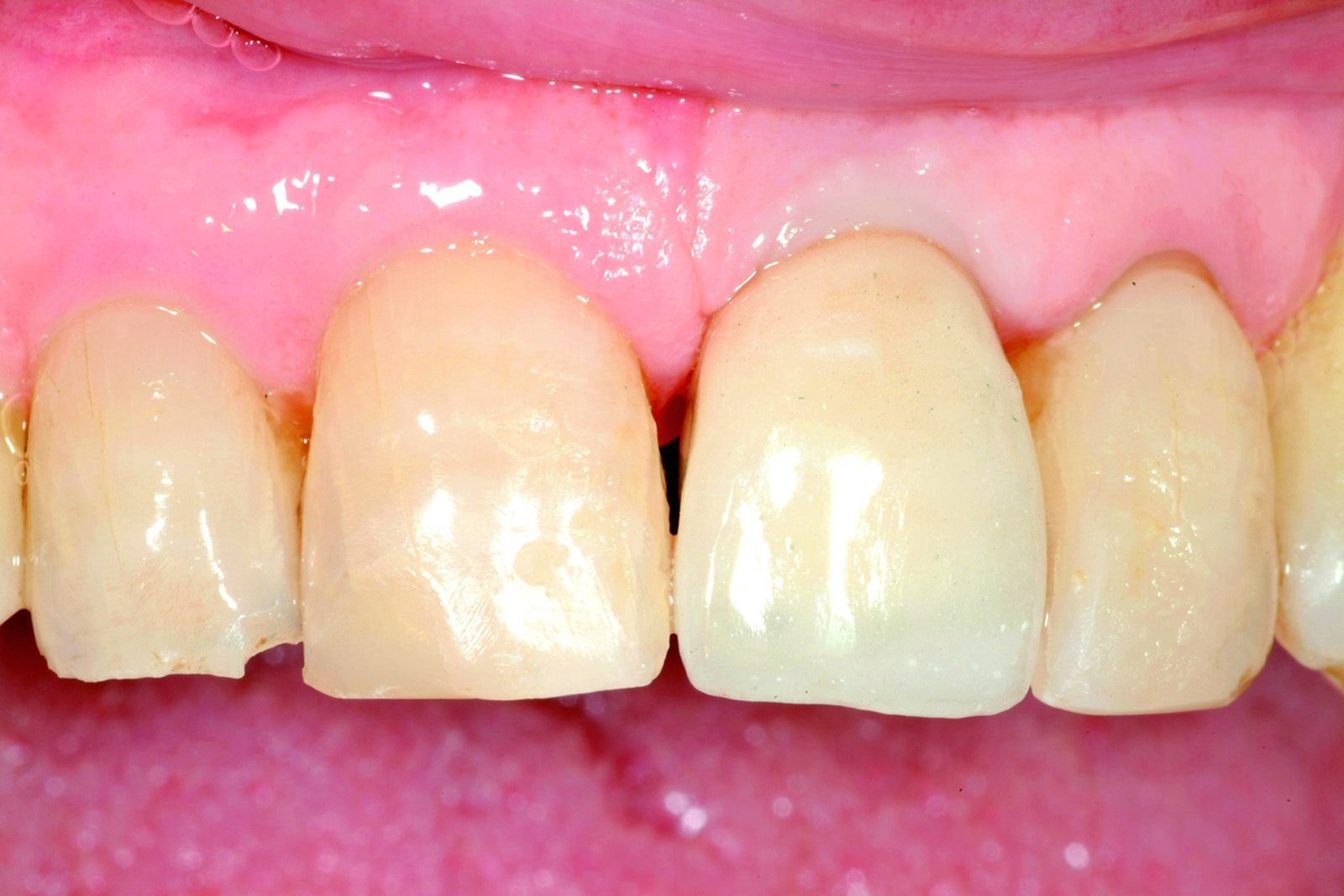
L’analisi dei valori presenti sulla curva ci mette in condizione di intervenire allorché gli stessi calino nel tempo in modo progressivo e continuo, avvicinandosi o raggiungendo un determinato “valore soglia”, al di sotto del quale l’impianto non è più recuperabile. Se noi riusciamo a intercettare il calo di stabilità prima che raggiunga valori critici, possiamo rimuovere la protesi provvisoria, attendere un periodo di guarigione e, infine, ripristinare il carico. Una vera e propria “Rescue procedure” in grado di recuperare completamente un impianto destinato al fallimento (Figure 4a-4f, Tabella 1).
Protocollo di controllo implantare nel carico immediato mediante l’utilizzo di frequenza di risonanza
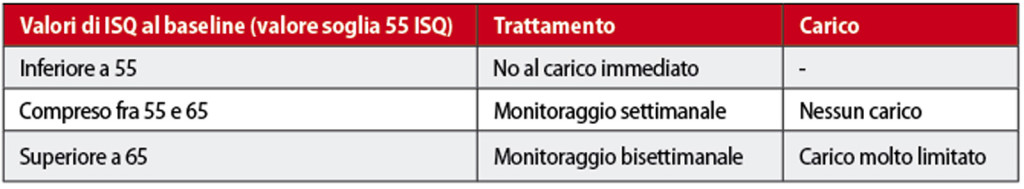
Il “valore soglia” di stabilità, misurato in ISQ, rappresenterebbe il valore al di sotto del quale la procedura di carico immediato non deve essere eseguita. Sulla definizione esatta di questo valore non vi è ancora oggi un consenso unanime. Vanden Bogaerde e coll.19, in uno studio prospettico, hanno stabilito arbitrariamente un “valore soglia” al baseline di 50 ISQ, osservando clinicamente che valori al di sotto di 50 ISQ erano associati a una visibile mobilità implantare. Altri Autori hanno invece definito e utilizzato valori differenti. Probabilmente, un valore soglia adeguato per il carico immediato potrebbe essere di 55 ISQ, utilizzando però un protocollo di applicazione come descritto nella tabella seguente:
Applicando questo protocollo è indispensabile poter rimuovere a intervalli regolari la struttura protesica provvisoria; pertanto è raccomandato l’uso di una protesi avvitata e non cementata. Quando la curva di stabilità, partendo dal valore al baseline, cala in modo continuo nel tempo raggiungendo il “valore soglia” di 55 ISQ, è indicato rimuovere il carico dall’impianto, attendere alcuni mesi affinché la stabilità risalga e quindi ripristinare il carico.
Rigenerazione Ossea Guidata
Il più importante requisito per il successo dell’osteointegrazione implantare è rappresentato da una sufficiente quantità e qualità del tessuto osseo che possa garantire la stabilizzazione dell’impianto con formazione di un contatto osso impianto ottimale22,23. In caso di insufficiente quantità di tessuto osseo nel sito dell’impianto, è stato descritta una minore percentuale di successo implantare24. La tecnica che negli anni ha avuto più successo per incrementare il supporto osseo è rappresentata dalla Rigenerazione Ossea Guidata (GBR)25-28. La metodica GBR deriva direttamente da un’altra procedura utilizzata per rigenerare il parodonto perduto a causa di malattia parodontale, la Rigenerazione Tissutale Guidata (GTR)29-31. Questa metodica prevede l’uso di una membrana che, agendo come una barriera meccanica, esclude dalla zona di riparazione chirurgica le cellule non competenti (epiteliali e connettivali), favorendo nel contempo la proliferazione di cellule del legamento parodontale, le uniche in grado di ricostruire il parodonto profondo. Basandosi sui principi biologici della GTR, nella GBR le membrane vengono utilizzate allo scopo di escludere dalla zona di guarigione le cellule differenti da quelle ossee, favorendo quindi la migrazione di cellule osteocompetenti in grado di rigenerare il tessuto perimplantare. La GBR ha elevate possibilità di successo per il trattamento dei difetti perimplantari32-35 e per la rigenerazione ossea prima del posizionamento degli impianti in difetti di cresta localizzati36-38 (Figura 5).

La possibilità di rigenerare l’osso perimplantare dipende da alcuni fattori:
- morfologia del difetto;
- tipo di membrana utilizzata (riassorbibile, non riassorbibile);
- tipo di materiale di riempimento (osso autologo, eterologo, di origine animale);
- tecnica chirurgica utilizzata.
Le membrane utilizzate per le tecniche di rigenerazione tissutale devono possedere alcuni requisiti fondamentali affinchè il processo rigenerativo sia sicuro e prevedibile. Tali requisiti sono:
- biocompatibilità. Il materiale deve essere biocompatibile;
- occlusività cellulare. Le membrane devono possedere capacità di barriera, isolando la zona di rigenerazione dalle aree non competenti per tale processo;
- integrazione tissutale. Il materiale deve permettere la crescita, al suo interno, di tessuto connettivo al fine di stabilizzare la membrana e di ritardare la migrazione epiteliale;
- mantenimento di spazio (“spacemaking”). La membrana dovrebbe possedere una sufficiente rigidità per garantire, soprattutto nelle prime fasi di guarigione, uno spazio sufficiente per la ricrescita di tessuto. Il collasso della membrana all’interno del difetto è causa frequente di insuccesso della tecnica rigenerativa;
- maneggevolezza clinica. Il materiale deve essere disponibile in diverse configurazioni e dimensioni per adattarsi alle differenti tipologie dei difetti, e deve essere sufficientemente malleabile per adattarlo alla morfologia della zona da trattare.
Ma gli impianti posizionati in osso rigenerato hanno la stessa percentuale di successo di quelli posti in osso nativo? In uno studio a 5 anni recentemente pubblicato39 sono stati messi a confronto impianti con simultanea GBR e impianti in osso nativo come controllo. La percentuale di sopravvivenza implantare è stata del 100% per il gruppo GBR e del 94% per il gruppo controllo, senza differenze statisticamente significative. Anche il livello di osso marginale mostrava in entrambi i gruppi un riassorbimento simile a 5 anni.
GBR perimplantare
In parodontologia esiste una classificazione dei difetti parodontali in base al grado di compromissione dei tessuti parodontali e al numero di pareti ossee che circondano il difetto stesso: parliamo di difetti ossei a una, due, tre pareti e difetti circumferenziali. La potenzialità rigenerativa e la difficoltà della tecnica chirurgica dipendono direttamente dal numero di pareti presenti intorno al difetto. Un difetto a tre pareti risponde molto meglio alla terapia sia perché in grado di mantenere la stabilità del coagulo nelle prime fasi di guarigione, sia per la sua intrinseca capacità spacemaking. Diversamente, in un difetto a una parete il coagulo è molto meno protetto e la terapia rigenerativa è più complessa in quanto è necessario creare una “camera rigenerativa” per consentire l’ingresso e la maturazione dei tessuti competenti. Sarà quindi necessario applicare una membrana rigida fissandola adeguatamente alle zone circostanti, associandola spesso a un materiale di riempimento. Basandosi sui principi biologici della parodontologia è stata proposta una classificazione dei difetti perimplantari40 che sono stati classificati come segue:
- difetti “closed”, con pareti ossee conservate (Figura 6);
- difetti “open”, con una o più pareti mancanti (Figura 7);
- deiscenze. Mancanza di osso su un lato dell’impianto, solitamente quello buccale;
- within the envelope. Difetti inclusi nel contorno della cresta alveolare (Figura 8);
- outside the envelope. Difetti che sporgono dal contorno della cresta alveolare (Figura 9).




Difetti “closed”
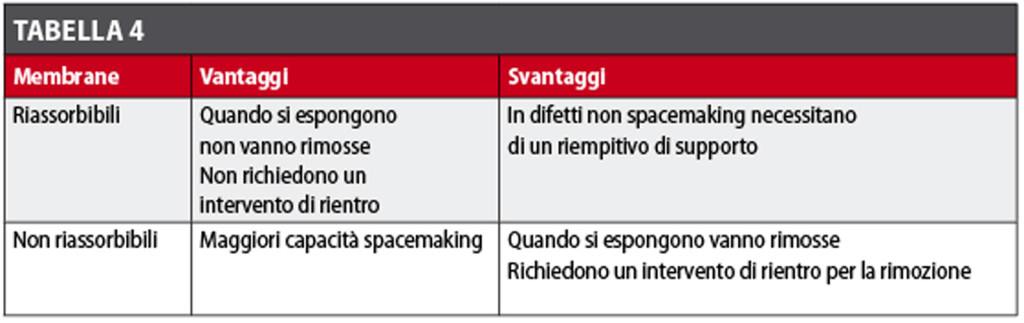
I difetti chiusi, con le loro pareti ossee conservate, offrono condizioni favorevoli per il processo rigenerativo. La morfologia di questi difetti è simile a una scodella o a un piccolo cratere.Essi contengono stabilmente il coagulo, ed eventuali innesti ossei, durante tutto il periodo di guarigione. Le pareti ossee conservate proteggono l’ambiente di guarigione dai movimenti dei tessuti sovrastanti, permettendo l’invasione indisturbata delle cellule osteorigenerative. Inoltre, i margini del difetto agiscono come sostegno impedendo alla membrana di collassare entro il difetto.
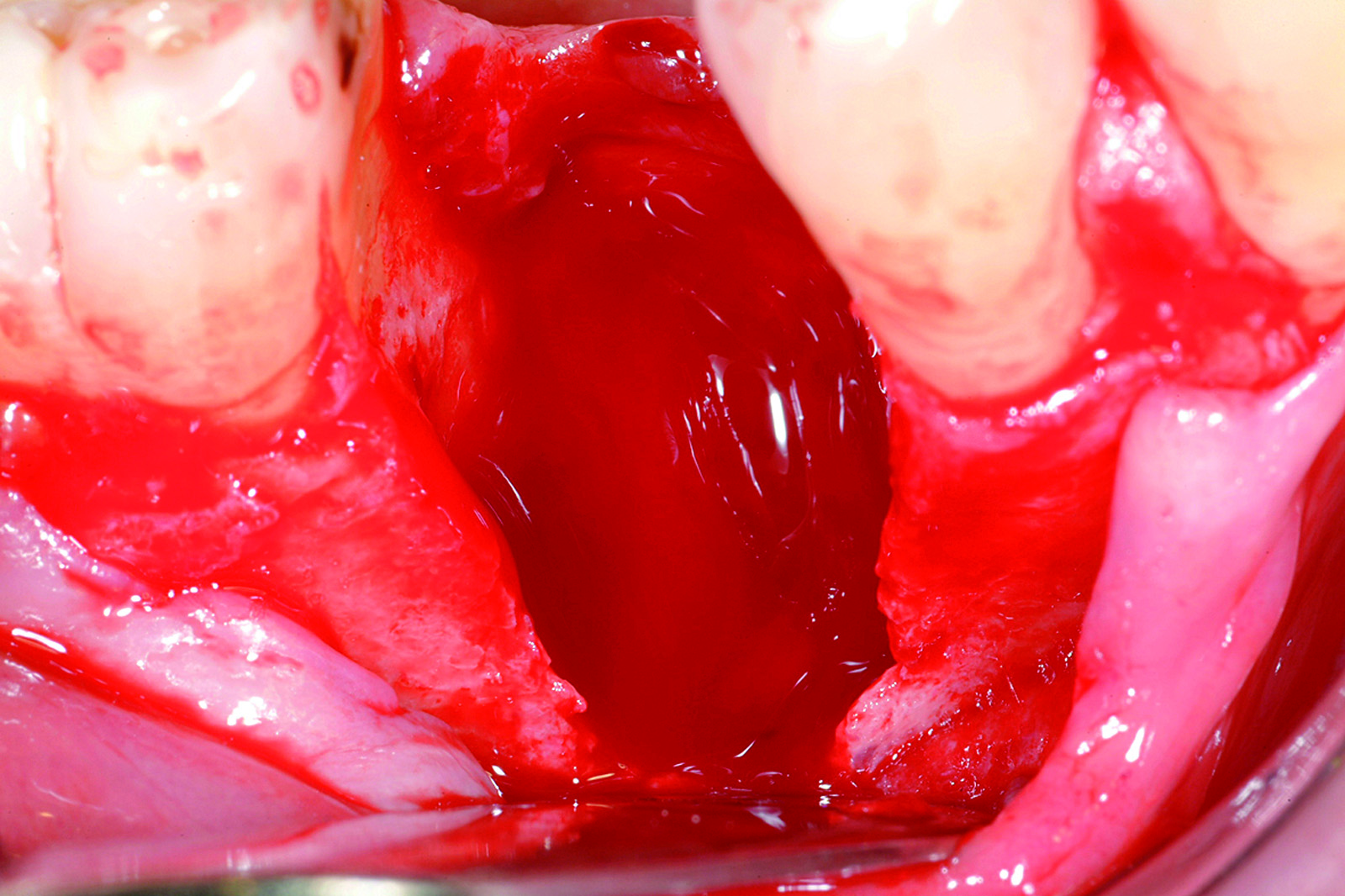
Terapia. Questi difetti, soprattutto quelli con un “gap” non superiore a 2 mm, potrebbero essere lasciati guarire spontaneamente, senza alcuna tecnica GBR. Uno studio sperimentale41 ha però dimostrato che più l’ampiezza del difetto aumenta, più la guarigione, in termini di contatto osso impianto (BIC), è peggiore. Quindi, potremmo evitare di trattare solo difetti molto stretti (1-2 mm), mentre per difetti più ampi è consigliabile sempre inserire un riempitivo, meglio se osso autologo raccolto nelle zone limitrofe. Data la capacità contenitiva del difetto, nella maggior parte dei casi non è necessaria l’applicazione di una membrana (Figure 10-11).
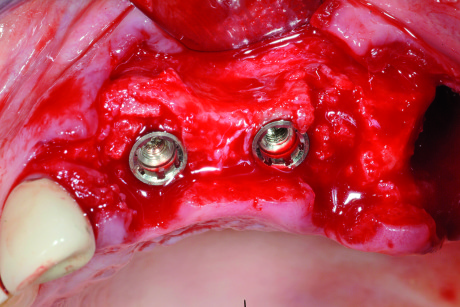
Difetti “open”
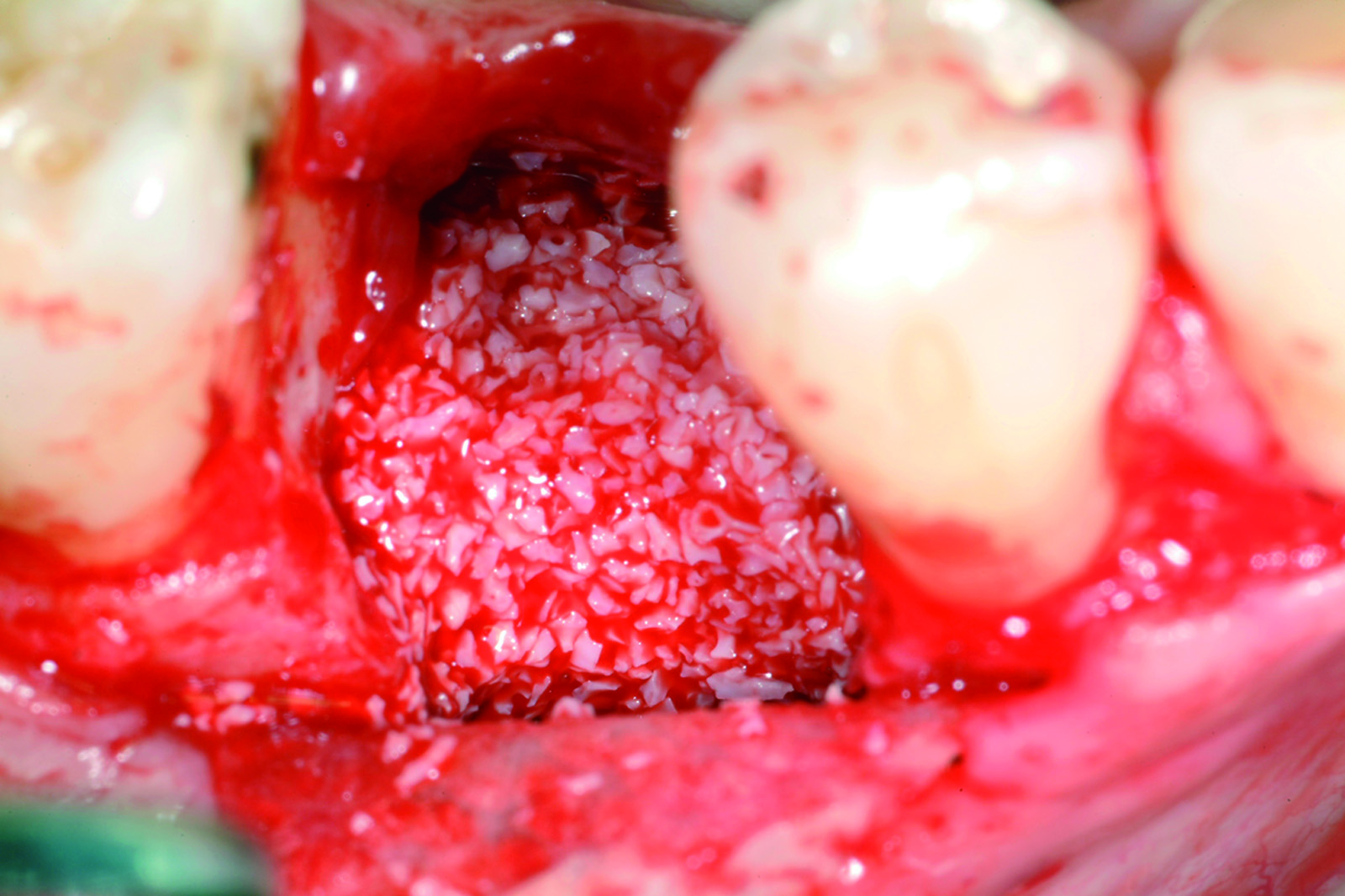
L’anatomia dei difetti open è meno favorevole per il processo rigenerativo dei difetti closed, dal momento che la mancanza di una o più pareti ossee espone l’ambiente di guarigione a traumi esterni. Nei difetti open il coagulo è meno protetto, innesti ossei particolati sono più soggetti a spostamento e una membrana posizionata per coprire il difetto può facilmente collassare perché non sufficientemente sorretta dalle pareti ossee circostanti (Figura 12).
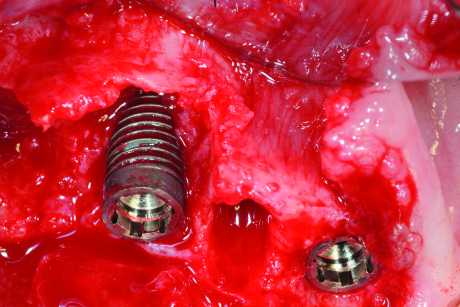
Naturalmente esistono difetti open più favorevoli e altri meno. I meno favorevoli sono, per esempio, quelli al di sopra della cresta in cui, per la mancanza completa di ogni parete ossea, la terapia rigenerativa è molto impegnativa e la prognosi incerta.
Terapia. La morfologia dei difetti open richiede comunque una terapia rigenerativa più complessa di quelli closed. È sempre consigliabile riempire il difetto con materiale di innesto particolato, previlegiando l’osso autologo rispetto ai sostituti dell’osso. L’innesto deve essere contenuto e protetto con una membrana non riassorbibile o riassorbibile. Già molti anni fa Gelb42 aveva messo in evidenza l’importanza dell’anatomia del difetto nel processo rigenerativo. Vennero trattati sia difetti a tre pareti che difetti a una parete con diverse terapie rigenerative; l’Autore osservò che i difetti a tre pareti guarivano con qualsiasi tipo di terapia adottata, mentre per quelli a una parete era più efficace una combinazione di membrana e materiale riempitivo.
Deiscenze
La deiscenza è la mancanza di osso su di un solo lato dell’impianto, solitamente quello buccale, dove la teca ossea è più sottile. Il difetto comporta l’esposizione delle spire implantari fino alla testa dell’impianto. Si distinguono in:
- deiscenze all’interno dell’envelope. Sono difetti compresi all’interno del contorno della cresta ossea alveolare, per cui la parte esposta dell’impianto risulta circondata da pareti ossee in grado sia di mantenere un innesto sia di fornire cellule osteopromotrici (difetto spacemaking). L’anatomia del difetto consente di posizionare un innesto di osso autologo, che risulterà spesso talmente stabile da non necessitare di una membrana contenitiva (Figure 13-14);
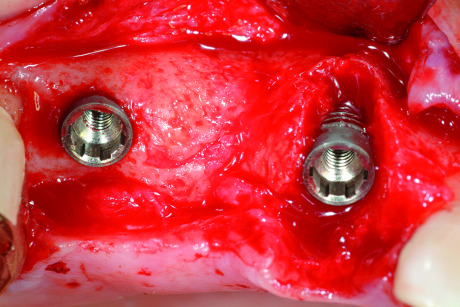
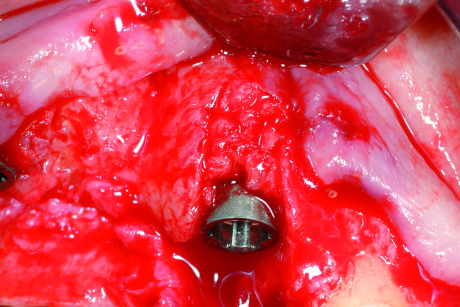
- deiscenze all’esterno dell’envelope. Sono difetti che protrudono al di fuori del contorno osseo, per cui le spire esposte dell’impianto non sono circondate da pareti contenitive (Figura 15). Infatti l’osso è piuttosto lontano dalle spire e la distanza che devono percorrere le cellule osteopromotrici è piuttosto ampia. Sono difetti “non spacemaking”, che non garantiscono uno spazio sufficiente e protetto per la rigenerazione. La terapia consiste nell’utilizzare uno “spacemaker”, cioè del materiale di riempimento al di sopra delle spire, che mantenga spazio. È necessario poi coprire tutto con una membrana ben fissata con dei chiodini all’osso circostante. È molto importante la stabilità della membrana in quanto il difetto, per sua natura non anatomicamente protetto, è fortemente esposto ai movimenti nel cavo orale e quindi a un dislocamento.
Fenestrazioni
Sono difetti simili alle deiscenze, ma che non arrivano a interessare la parte più coronale dell’impianto (Figura 16). In altre parole sono esposizioni limitate di spire confinate nel corpo dell’impianto. Non sono stati descritti casi di fallimenti implantari a causa di fenestrazioni, per cui la terapia dei casi meno estesi consiste nel non trattarli. Se abbiamo invece delle fenestrazioni piuttosto estese possiamo utilizzare le stesse tecniche descritte per le deiscenze.
Materiali di riempimento dei difetti perimplantari
L’osso autologo particolato è considerato il “gold standard” per il riempimento
dei difetti ossei perimplantari in quanto combina capacità osteoconduttive e osteoinduttive. I sostituti dell’osso posseggono invece solo capacità osteoconduttive, di “scaffold”; inoltre, se vengono in contatto con il tessuto connettivale sono invase immediatamente da tessuto fibroso, vanificando qualsiasi rigenerazione. Nella Tabella 2 sono indicati i vantaggi e gli svantaggi dell’osso autologo e dei suoi sostituti.
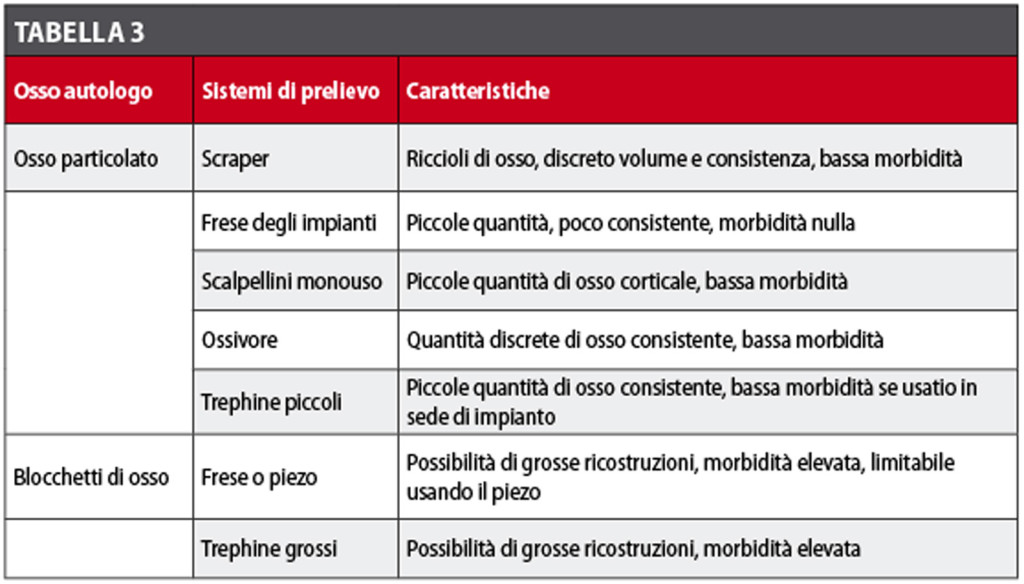
L’osso autologo particolato può essere prelevato in piccole quantità utilizzando tecniche mini-invasive. Per quantità maggiori, come i blocchi solidi, si possono utilizzare frese e trephine o, in modo meno traumatico, il piezo. Nella Tabella 3 sono elencate alcune di queste tecniche. È stato eseguito uno studio morfogenico sulla riparazione di “critical size defects”, cioè difetti che non guariscono spontaneamente, usando sia osso bovino deproteinizzato (DBB), sia osso autologo, nella calvaria di topo43.
Nello studio il DBB non era in grado di ripristinare l’osso mancante e i difetti risultarono occupati prevalentemente di tessuto connettivo fibrotico, mentre solo il 16% era nuovo osso. Nei difetti trattati con osso autologo si poteva invece assistere a una completa chiusura dei difetti con osso neoformato. Gli innesti ossei devono spesso essere coperti e protetti da una membrana; esistono membrane non riassorbibili (e-PTFE), che devono essere rimosse dopo alcuni mesi, e membrane riassorbibili (PLA o collagene) che non necessitano di alcuna rimozione. Nella Tabella 4 sono riportati i vantaggi e gli svantaggi dei due tipi di membrana.
GBR preimplantare
Ricostruzioni di cresta (RR)
Spesso nei mascellari si riscontrano estese perdite di tessuto osseo dovute a infezioni, cisti, estrazioni dentali, fratture radicolari, impianti falliti. Queste aree possono essere localizzate in zone strategiche per la masticazione oppure in aree estetiche, situazioni che richiedono in molti casi il posizionamento di impianti per ripristinare la funzione perduta.
Le ricostruzioni di cresta (RR) sono quindi quelle procedure chirurgiche che mirano a ripristinare l’integrità della cresta alveolare mediante l’utilizzo di materiali di riempimento e membrane, in vista di un successivo trattamento implantare.I grossi difetti crestali possono essere più o meno contenitivi in base alla presenza o meno di pareti ossee conservate.
Terapia. Data l’ampiezza dei difetti è indispensabile un materiale di riempimento che consenta la proliferazione delle cellule osteogenetiche. La distanza fra le pareti ossee non consente, infatti, un naturale “jumping” cellulare e l’innesto rappresenta un indespensabile “scaffold” per la rigenerazione. È inoltre consigliabile associare una membrana che potrà essere non-spacemaking (membrana in collagene) nei difetti con pareti conservate, o spacemaking (membrana riassorbibile in PLA o non riassorbibile in e-PTFE), fissate con pernini in titanio.
Quasi sempre è richiesta una notevole quantità di materiale come “scaffold”: abbiamo diverse possibilità:
- prelevare osso autologo dalla branca montante della mandibola, riducendolo poi a particolato;
- prelevare osso autologo con uno scraper con lembo o con tecnica “a tunnel”;
- fare un innesto miscelato di osso autologo particolato e osso bovino nella proporzione di 60/40. Non è consigliabile usare solo osso bovino per il rischio di colonizzazione estesa di tessuto connettivo e insufficiente formazione di osso;
- usare una tecnica a strati (Layer-Technique, Vanden Bogaerde, 2011). La procedura consiste nel riempire la metà o i 2/3 apicali del difetto con osso bovino e la restante parte coronale con osso autologo particolato.
Il principio alla base di questa tecnica è quello di circondare completamente l’innesto di osso bovino con osso autologo, impedendo così che, in fase di guarigione, cellule connettivali invadano le particelle di xenotrapianto. Al di sopra dell’innesto viene, infine, posizionata e fissata una membrana riassorbibile in PLA. Il maggiore vantaggio della riassorbibilità risiede
nel fatto che in caso di esposizione non deve essere rimossa (Figure 17a-17g).
Aumento orizzontale di cresta (HRA)
Le creste alveolari, in seguito all’estrazione dei denti, sono soggette a gravi fenomeni di riassorbimento in senso verticale, ma ancora di più in senso orizzontale. Si formano delle creste a lama di coltello di larghezza così ridotta da impedire il posizionamento di impianti. Per tale motivo è necessario applicare delle tecniche preimplantari per incrementare l’osso in senso orizzontale. Le procedure sono molteplici e la scelta della loro applicazione dipende spesso
dalla familiarità e dall’esperienza che l’operatore possiede nei confronti di una determinata metodica:
- innesto di osso autologo + membrana riassorbibile fissata con chiodini;
- innesto di osso autologo + membrana non riassorbibile fissata con chiodini;
- innesto a blocco di osso autologo fissato con viti da osteosintesi;
- split-crest.
Aumento verticale di cresta (VRA)
L’aumento verticale di cresta è una tecnica che consente di incrementare la quantità di osso crestale in altezza. È probabilmente la tecnica più impegnativa nel settore della GBR e riservata a operatori altamente specializzati e competenti. È anche una delle tecniche meno prevedibili in quanto il difetto da trattare è completamente senza pareti e la sorgente di cellule osteopromotrici arriva solo dalla base dello stesso. Inoltre, vi possono essere serie difficoltà nell’ottenere una copertura dell’innesto con i tessuti molli. Può essere eseguita in due modi:
- procedura in due tempi. Innesto di osso autologo o di miscela osso autologo/osso bovino posizionato sopra la cresta + membrana non riassorbibile rinforzata fissata con chiodini in titanio. Gli impianti vengono installati non prima di 9 mesi dalla chirurgia;
- procedura in un tempo unico. Gli impianti vengono posizionati alcuni millimetri al di sopra della cresta e contestualmente viene eseguita la tecnica rigenerativa come descritta sopra. È una procedura più rischiosa di quella precedente in quanto, in caso di esposizione della membrana, si vanifica la rigenerazione e una parte delle spire implantari rimangono esposte.
Aumento del pavimento del seno mascellare (SFA)
Molto spesso la presenza delle cavità dei seni mascellari impedisce il corretto posizionamento di impianti nei settori posteriori dei mascellari superiori. La metodica chirurgica definita come “rialzo del seno mascellare” mira a creare una base ossea sufficiente per gli impianti e può oggi essere considerata una procedura ben sperimentata e codificata. Proposta per la prima volta da Boyne et al. nel 1980, oggi viene eseguita di routine e la letteratura ci conforta sulle sue possibilità di successo a lungo termine44,45. L’osso bovino deproteinizzato (DBB) ha la caratteristica di mantenere il volume inalterato nel tempo; è stata eseguita un’analisi morfologica e morfometrica46 su biopsie eseguite a distanza di 11 anni utilizzando osso bovino deproteinizzato miscelato con osso autologo nella percentuale 80/20%. Gli Autori hanno evidenziato la presenza, dopo 11 anni, di particelle di DBB ben integrate in osso lamellare senza segni di riassorbimento. Generalmente si esegue la metodica in due tempi, con un intervallo di almeno 6 mesi; talvolta, però, se l’osso residuo crestale è superiore a 6 mm si possono posizionare gli impianti contestualmente al rialzo. La tecnica chirurgica può così essere riassunta:
- sollevamento di un lembo a tutto spessore, spesso con un’incisione di rilasciamento mesiale o distale;
- assottigliamento della parete ossea esterna del seno utilizzando uno scraper fino a evidenziare il caratteristico colore bluastro della membrana. L’uso dello scraper consente anche di raccogliere dei frammenti ossei che alla fine dell’intervento possono essere utilizzati a chiusura della finestra ossea. Per assottigliare l’osso si può anche utilizzare il piezoelettrico;
- utilizzo del piezoelettrico o di una fresa a pallina per disegnare il contorno della finestra e arrivare alla membrana;
- scostamento della membrana, prima con il piezo e poi con scollatori dedicati;
- riempimento del seno con osso bovino oppure con una miscela di osso bovino e autologo. La presenza di coagulo sanguigno è favorevole. Possiamo naturalmente utilizzare osso autologo per l’innesto, tuttavia la necessità di una quantità notevole di materiale comporta anche una maggiore morbidità per il paziente;
- chiusura della finestra con uno strato di osso autologo raccolto con lo scraper e copertura con una membrana in collagene;
- sutura a punti staccati.
Eventuali piccole lacerazioni della membrana possono essere trattate con una membrana in collagene, sostituendo l’osso bovino particolato con osso bovino/collagene che presenta minori rischi di dispersione di materiale all’interno del seno mascellare. Grandi lacerazioni invece rappresentano una reale controindicazione a questa metodica. È sempre consigliabile eseguire un monitoraggio nel tempo degli impianti inseriti in un seno mascellare aumentato utilizzando la Frequenza di Risonanza. Le misurazioni ci consentono di stabilire quando gli impianti hanno raggiunto la sufficiente stabilità per sopportare il carico occlusale.
Il trattamento dei sitipost-estrattivi
Nella pratica clinica quotidiana, con sempre maggiore frequenza ci troviamo nelle condizioni di dovere scegliere fra il mantenimento di un elemento dentario e la sua estrazione con immediato o successivo posizionamento di un impianto. Escludendo naturalmente i casi di frattura radicolare o di carie estesa alla radice in cui è imperativo eseguire l’avulsione, vi sono situazioni più sfumate in cui la scelta può dipendere da numerosi fattori:
- l’integrità e la lunghezza della radice del dente naturale;
- la presenza di lesioni periapicali;
- la necessità di eseguire un allungamento della corona clinica dei denti adiacenti, con conseguente perdita di osso anche a carico di questi ultimi;
- la presenza di una parodontite diffusa che comporta una prognosi incerta per il mantenimento dell’elemento dentario a medio termine;
- il rapporto costo-benefici di una terapia complessa per la conservazione del dente naturale.
Se si decide per l’estrazione del dente è necessario conoscere le dinamiche di rimaneggiamento osseo che avvengono nelle settimane e nei mesi successivi all’intervento. Schropp e coll.47 in uno studio clinico hanno analizzato le modificazioni dell’alveolo post-estrattivo usando radiografie standardizzate. I risultati hanno dimostrato che i maggiori cambiamenti dell’alveolo avvengono durante i primi 12 mesi successivi all’estrazione con una riduzione di spessore della cresta alveolare del 50%, quantificabile in 5-7 mm. Inoltre, i due terzi di questa riduzione avviene nei primi 3 mesi dopo l’avulsione.
Araùjo e Lindhe48 hanno studiato i cambiamenti dell’alveolo post-estrattivo utilizzando una tecnica convenzionale a lembo e una tecnica “flapless”. L’esperimento dimostra che la rimozione di un dente comporta, durante la guarigione, una marcata riduzione della cresta alveolare, soprattutto nella parte più coronale e più dal lato buccale che da quello linguale. Dopo 6 mesi di guarigione si è verificata una riduzione del 35% di quantità di tessuto osseo. L’osservazione più importante è stata però che la quantità di tessuto duro perso nel periodo di guarigione è stata simile sia con la tecnica a lembo che con quella flapless. Il riassorbimento osseo principalmente localizzato sul lato buccale dell’alveolo sembra essere correlato alle caratteristiche anatomiche della zona. Infatti, la teca ossea buccale è spesso costituita esclusivamente da “bundle bone” cioè quel tipo di lamina ossea in cui si inseriscono le fibre di Sharpey (fibre del legamento parodontale) provenienti dal cemento radicolare. Sembra che dopo l’avulsione dentaria il “bundle bone” perda la sua funzione e quindi si riassorba. Il piatto osseo linguale subisce meno riassorbimento perché costituito sia da “bundle bone” che da osso lamellare49. Allorché la teca ossea buccale si riassorbe, si assiste all’ingresso di tessuto molle nello spazio prima occupato dal “bundle bone”, con conseguente mancanza di spazio per la rigenerazione ossea e quindi al collasso della cresta in senso orizzontale e verticale.
Covani e coll.50 hanno dimostrato che la rimozione di un singolo dente intercalato causa un marcato cambiamento della parete ossea buccale e, come conseguenza, la cresta alveolare si riduce scivolando lingualmente. Il riassorbimento osseo verticale risulta più marcato (10.6 mm) nel centro della cresta rispetto alle estremità mesiale (5.4 mm) e distale (6.6 mm).
Riassumendo, quando decidiamo di estrarre un dente, abbiamo in genere 3 opzioni:
- attendere la guarigione dell’alveolo;
- ricostruire l’alveolo;
- inserire un impianto contestualmente all’avulsione.
Abbiamo già visto come l’estrazione del dente comporti spesso un collasso dell’alveolo.
Esistono oggi delle possibilità di impedire questo fenomeno utilizzando delle tecniche che promuovano una ricostruzione ossea dell’alveolo?
La ricostruzione dell’alveolo
Fickl e coll.49 hanno studiato la possibilità di mantenere dimensionalmente gli alveoli post-estrattivi utilizzando il seguente protocollo di ricerca:
- inserimento nell’alveolo di osso bovino collagene;
- osso bovino collagene e innesto gengivale libero;
- solo coagulo come controllo.
L’innesto xenogenico sembra essere in grado di sostituire il “bundle bone” prevenendo in parte il collasso dell’alveolo. Esso agirebbe anche come “scaffold” per la rigenerazione ossea sebbene, nella parte più coronale, le particelle innestate siano circondate da tessuto connettivo.
Sembra inoltre che l’uso di un innesto gengivale libero per sigillare l’ingresso dell’alveolo comporti dei benefici rispetto al gruppo di controllo senza innesto. Tuttavia non vi è un accordo definitivo sulla possibilità di prevenire il collasso dell’alveolo mediante biomateriali. Araujo e coll.51 hanno eseguito uno studio sul cane trattando siti post-estrattivi con osso bovino collagene e usando il lato controlaterale non trattato come controllo. I risultati istologici mostrano come la presenza di cellule multinucleate nel tessuto circostante l’innesto xenografico ritardi la guarigione dell’alveolo. Una presenza significativa di nuovo osso è stata osservata solo nella parte più apicale dell’alveolo dove il materiale di innesto era assente. Nella restante parte dell’alveolo innestato, i granuli di biomateriale risultavano circondati da una matrice provvisoria infiammata ed erano frequentemente ricoperti da cellule multinucleate che potevano essere identificate come osteoclasti derivanti dalla linea dei macrofagi. La presenza di cellule multinucleate nella matrice provvisoria indicava che le particelle di xenoinnesto erano riconosciute come estranee all’organismo. Nei siti non innestati di controllo si potevano osservare grandi quantità di “woven bone” distribuite nella maggior parte dei compartimenti dell’alveolo.
Santos e coll.52 hanno condotto una ricerca sul cane per valutare la reazione dei tessuti duri e molli dopo l’inserimento in alveoli post-estrattivi immediati di due differenti tipi di idrossiapatite (sintetica e naturale) e di vetro bioattivo. I risultati del gruppo di controllo mostravano la formazione di osso lamellare dopo 4 settimane e di osso compatto dopo 28 settimane. Le idrossiapatiti e il biovetro mostravano a 28 settimane risultati simili, con la formazione intorno alle particelle sia di tessuto connettivo che di osso neoformato. Nessuno dei materiali risultava completamente riassorbito. In ultima analisi, si può dire che tutti i materiali innestati hanno ritardato la guarigione dell’alveolo.La tecnica da noi preferita per la ricostruzione dell’alveolo è quella che viene definita “Layer- Technique” (Vanden Bogaerde, 2011). Questa procedura consiste nel riempimento dell’alveolo in modo stratificato: sul fondo, a livello di circa i due terzi dell’alveolo, viene posizionato dell’osso bovino. Il terzo coronale viene riempito con osso autologo prelevato con scraper. Infine, un innesto gengivale libero sigilla l’imbocco dell’alveolo. A nostro parere il vantaggio di questa tecnica consiste nell’isolamento completo dell’innesto di biomateriale, che risulta interamente circondato da osso nativo e innestato. Il biomateriale non entra direttamente in contatto con il connettivo o l’epitelio ed è quindi colonizzato solo da cellule osteopromotrici (Figure 18a-18d).
Inserimento contestuale dell’impianto
Dall’analisi degli studi sopra riportati si evince che il tentativo di preservare l’alveolo per mezzo di biomateriali spesso non è all’altezza delle aspettative. Possiamo, a questo punto, domandarci se possa essere utile, per il mantenimento del livello osseo, posizionare immediatamente un impianto in un sito post-estrattivo fresco. Ma, secondo la letteratura, quale prevedibilità e possibilità di successo hanno gli impianti posizionati in siti post-estrattivi? Botticelli e coll.53 hanno eseguito uno studio prospettico a 5 anni ottenendo una percentuale di sopravvivenza implantare del 100%. Quindi gli impianti posizionati in siti post-estrattivi, a condizione di rispettare un adeguato protocollo chirurgico, avrebbero, in termini di percentuale di successo, una prognosi paragonabile a quelli posizionati in osso nativo. Ma l’impianto può prevenire il riassorbimento dell’osso marginale?Paolantonio e coll.54 in uno studio clinico e istologico nell’uomo hanno asserito che il posizionamento immediato di un impianto in un sito post-estrattivo può evitare il processo di riassorbimento del piatto osseo buccale. Questo risultato è stato successivamente smentito da altri ricercatori55,56. Recentemente, Sanz e coll.57 hanno confermato che impianti posizionati in siti post-estrattivi immediati comportano una marcata riduzione del livello osseo sia in senso orizzonatale che verticale, più marcato sul lato buccale che su quello palatino. Il riassorbimento osseo verticale sul lato buccale può essere quantificato in 2.6 mm secondo Araujo e coll.56 in uno studio a 3 mesi nel cane, o di 2.8 mm secondo Botticelli e coll.58 sempre in uno studio sul cane a 4 mesi.
Guarigione spontanea del “gap” perimplantare
È necessario chiarire ciò che avviene nel “gap” perimplantare durante la fase di guarigione. Uno studio istologico di più di dieci anni fa41 esaminava la guarigione ossea del gap perimplantare lasciato guarire spontaneamente. Gli Autori valutarono, in siti post-estrattivi simulati, gli effetti di “gap” perimplantari di varia ampiezza, lasciati guarire spontaneamente. Furono preparati difetti sperimentali di ampiezza crescente di 0.5, 1.0, 1.4 mm, con un lato controllo senza gap. I difetti furono lasciati guarire senza alcuna terapia rigenerativa. Benché clinicamente tutti i difetti erano guariti, l’esame istologico, eseguito dopo 12 settimane, mostrava che la percentuale di contatto osso impianto (BIC) diminuiva quanto maggiore era l’ampiezza del difetto iniziale. Questo articolo ci indica che un difetto può essere lasciato guarire spontaneamente purché la sua ampiezza sia ridotta; diversamente, la connessione osso impianto ne può risultare indebolita.
Morfologia del difetto perimplantare
Il processo di guarigione del difetto dipende anche dalla morfologia dello stesso; vi sono difetti più o meno spacemaking, cioè in grado di mantenere sufficiente spazio durante il periodo di guarigione. È stata proposta una classificazione dei difetti ossei in base alla morfologia e al numero di pareti ossee presenti40.
I difetti ossei contigui agli impianti sono stati distinti in due gruppi principali: closed, cioè difetti con presenza di pareti ossee completamente conservate, simili ai difetti parodontali a tre pareti; open, cioè difetti con mancanza di una o più pareti ossee. È evidente che il primo tipo di difetto, per la sua conformazione anatomica, mostra caratteristiche di mantenimento di spazio, con ottima stabilità del coagulo durante le prime fasi di guarigione e quindi migliore prevedibilità del processo rigenerativo. I difetti open, invece, in considerazione della mancanza di una o più pareti ossee hanno minori possibilità di mantenere la stabilità del coagulo o di un eventuale materiale di innesto. Quindi questi difetti hanno una prognosi meno prevedibile dei precedenti e richiedono una terapia rigenerativa più complessa e costosa, consistente in innesti ossei e utilizzo di membrane.
Trattamento del “gap” perimplantare
Un aspetto importante è rappresentato dal materiale di innesto che possiamo utilizzare per il riempimento dei difetti. Vi è un comune consenso sul fatto che l’osso autologo sia il “gold standard” fra gli innesti ossei in considerazione delle sue capacità sia osteoconduttive che osteoinduttive. A dispetto della crescente diffusione di sostituti ossei, ancora oggi l’osso autologo può essere considerato il materiale di prima scelta per questo genere di lesioni. Per i difetti perimplantari in genere non necessitano ingenti quantità di osso, per cui si possono eseguire dei micro prelievi nell’ambito del cavo orale. A tale scopo è possibile utilizzare degli scraper, strumenti in grado di asportare dalla superficie dell’osso piccole quantità di materiale da innesto. È interessante osservare come spesso all’interno di questi prelievi sia possibile rinvenire cellule ossee vitali, a testimonianza dalla bassa traumaticità di tale metodica. Esistono attualmente anche dei mini-scraper con i quali possiamo eseguire prelievi con tecniche mini invasive. Una di queste è la “tecnica a tunnel”: si esegue un’incisione verticale sul lato esterno della mandibola a livello del primo molare, si scolla il periostio, si inserisce il mini-scraper di forma tubulare e, muovendolo avanti e indietro, si gratta la superficie dell’osso corticale raccogliendo nell’apposito deposito piccoli “riccioli” di osso. Pochissimi punti di sutura sono necessari per chiudere la ferita di accesso. L’utilizzo di sostituti dell’osso per il trattamento del gap perimplantare espone, a nostro parere, il difetto a una indesiderata invasione di tessuto connettivo, con conseguente incapsulamento delle particelle di biomateriale e assenza di neoformazione ossea. La guarigione del difetto ne risulterebbe impedita con il rischio, inoltre, che la proliferazione connettivale funga da tramite per possibili fenomeni infettivi e infiammatori.
Uso di impianti conici
Dobbiamo anche analizzare la possibilità di riempire il gap perimplantare con titanio invece che con innesto particolato: usando impianti conici, che mimano la morfologia dell’alveolo, possiamo ridurre al minimo la presenza del difetto perimplantare. Un recente studio sperimentale nel cane59 ha analizzato questa problematica. Sono stati posizionati impianti in siti post-estrattivi immediati, nel lato controllo sono stati inseriti impianti cilindrici di piccolo diametro, mentre nel lato test impianti conici più larghi con forma a radice. Dopo 4 mesi sono state eseguite delle analisi istomorfometriche. I risultati evidenziano un riassorbimento osseo sia nel lato test che in quello controllo, con una maggiore perdita buccale nel gruppo test rispetto a quello di controllo. Quindi, l’utilizzo di impianti conici non solo non preverrebbe il riassorbimento della cresta, ma indurrebbe un maggiore riassorbimento buccale rispetto agli impianti cilindrici.
Posizione dell’impianto nell’alveolo
La localizzazione dell’impianto nell’alveolo post-estrattivo è stato oggetto di uno studio specifico condotto da Caneva e coll.60 nell’animale da esperimento (cane). Sono stati posizionati impianti in siti post-estrattivi immediati: nel lato controllo al centro dell’alveolo, mentre nel lato test sono stati inseriti 0.8 mm in profondità e verso il lato linguale. Dopo 4 mesi sono stati analizzati da un punto di vista istomorfometrico. Tutti gli impianti risultarono integrati con presenza di osso lamellare; vi era in entrambi i gruppi un riassorbimento marginale, tuttavia questo risultava meno pronunciato nel gruppo test (impianti più profondi e linguali) che in quello di controllo. In conclusione, è consigliabile posizionare l’impianto sempre verso il lato linguale per diversi motivi:
- la teca ossea linguale è più spessa e si riassorbe meno facilmente;
- la parete ossea linguale è in genere costituita da osso corticale e quindi garantisce maggiore stabilità primaria all’impianto;
- posizionando l’impianto verso il lato linguale liberiamo più spazio sul lato buccale per un eventuale innesto osseo.
- Per quando riguarda la profondità di inserzione dell’impianto, dobbiamo valutare le differenti localizzazioni nelle arcate mascellari:
- nelle zone estetiche è consigliabile posizionare l’impianto a livello della cresta o più profondamente; la scelta dipende sia dallo spessore dell’osso alveolare sia dallo spessore e dalla consistenza dei tessuti molli. Dobbiamo considerare che un impianto collocato a livello o sotto la cresta è spesso accompagnato, nella fase di guarigione, da un riassorbimento della cresta legata alla necessità di stabilirsi dell’“ampiezza biologica”;
- nelle zone posteriori può essere invece utile posizionare l’impianto 1-2 mm sopra la cresta sia per minimizzare la perdita ossea verticale legata all’“ampiezza biologica”, sia per diminuire la distanza interocclusale e quindi il braccio di leva.
Tecnica flapless
Araujo e Lindhe48 hanno eseguito uno studio nel cane per valutare la guarigione del tessuto osseo dopo estrazione dentale eseguita con o senza lembo. La procedura di estrazione dentale eseguita con o senza lembo non comporta differenze statisticamente significative in termini di riassorbimento osseo marginale. Blanco e coll.61 hanno condotto uno studio nel cane per valutare le alterazioni della cresta alveolare dopo avulsione dentaria, sia in senso orizzontale che verticale. Dopo 3 mesi le misurazioni hanno evidenziato un riassorbimento verticale di 1.48 mm e 1.22 mm per i gruppi flap e flapless rispettivamente, e una perdita orizzontale di 4.41 mm e di 4.5 per i gruppi flap e flapless rispettivamente. I risultati non erano però statisticamente significativi. Quindi il riassorbimento osseo non era influenzato dal tipo di tecnica utilizzata, se flap o flapless. I pareri non sono però concordi; infatti Fickl e coll.62 hanno concluso uno studio nell’animale teso a definire le conseguenze sull’osso di tecniche di estrazione con o senza lembo. Gli Autori hanno riscontrato una perdita ossea di 2.1 mm nel gruppo flapless e di 2.5 mm nel gruppo flap, considerando la differenza significativa. Hanno quindi concluso che lasciando in sede il periostio diminuisce la velocità di riassorbimento dell’alveolo estrattivo. È necessario sottolineare che le differenze di risultati degli studi citati potrebbero essere attribuibili alla diversa localizzazione degli elementi dentari interessati, con differenti anatomie e spessori ossei.
Precauzioni nell’inserimento di impianti in siti
post-estrattivi immediati
Prima di procedere con l’inserimento degli impianti in siti post-estrattivi immediati è indispensabile assumere alcune precauzioni tese a valutare alcuni fattori:
- la presenza di parodontite. La presenza di malattia parodontale attiva è una controindicazione all’implantologia in siti post-estrattivi immediati. È necessario preventivamente: eseguire una terapia adeguata della parodontite, tenere sotto controllo la placca batterica con un programma di igiene orale rigoroso, monitorare nel tempo le condizioni implantari mediante radiografie e
frequenza di risonanza. È stato dimostrato che in caso di parodontite aggressiva generalizzata (GAP), i pazienti hanno una maggiore incidenza di patologie parimplantari, un più accentuato riassorbimento osseo marginale e un minore tasso di sopravvivenza implantare63,64; - impianti in siti infetti. Sembra possibile inserire impianti anche in siti infetti, eseguendo un accurato curettage dell’alveolo; tuttavia, dobbiamo sempre tenere presente che, in tali siti, possono residuare dei frammenti di tessuto infiammatorio che possono rimanere intrappolati dopo l’installazione implantare dando origine a fenomeni infettivi anche gravi con perdita dell’impianto o con formazioni di perimplantiti apicali (granulomi);
- la concomitanza di parodontite e fumo può rappresentare una seria e reale controindicazione alla procedura implantare63.
Corrispondenza
Leonardo Vanden Bogaerde
Via Dante 32 – 20863 Concorezzo (MB)
Telefax 039.6049005
leonardo@vandenbogaerde.it
1.Ericsson I, Randow K, Glantz P-O, Lindhe J, Nilner K. Clinical and radiographical features of submerged and nonsubmerged titanium implants. Clin Oral Implants Res 1994; 5:185–189 2. Ericsson I, Randow K, Nilner K, Petersson A. Some clinical and radiographical features of submerged and non-submerged titanium implants. A 5-year follow-up study. Clin Oral Implants Res 1997; 8:422–426. 3. Bernard JP, Belser UC, Martinet JP, Borgis SA. Osseointegration of Brånemark fixtures using a single-step operating technique. A preliminary prospective one-year study in the edentulous mandible. Clin Oral Implants Res 1995; 6:122–129. 4. Henry P, Rosenberg J. Single-stage surgery for rehabilitation of the edentulous mandible: preliminary results. Pract Periodontics Aesthet Dent 1994; 6:1–8. 5. Randow K, Ericsson I, Nilner K, Petersson A, Glantz PO. Immediate functional loading of Brånemark dental implants. An 18-month clinical follow-up study. Clin Oral Implants Res 1999; 10:8–15. 6. Tabassum A, Meijer GJ, Wolke JGC, Jansen JA. Influence of the surgical technique and surface roughness on the primary stability of an implant in artificial bone with a density equivalent to maxillary bone: a laboratory study. Clin. Oral Impl. Res. 20, 2009; 327–332. 7. Glauser R, Rèe A, Lundgren AK, Gottlow J, Hämmerle C, Schärer P. Immediate occlusal loading of Brånemark implants applied in various jawbone regions: a prospective, 1-year clinical study. Clin Implant Dent Relat Res 2001; 4:204–213. 8. Roze´ J, Babu S, Saffarzadeh A, Gayet-Delacroix M, Hoornaert A, Layrolle P. Correlating implant stability to bone structure. Clin. Oral Impl. Res. 20, 2009; 1140–1145. 9. Rompen E, DaSilva D, Hockers T, et al. Influence of implant design on primary fit and stability. A RFA and histological comparison of MkIII and MkIV Brånemark implants in the dog mandible. Appl Osseointegration Res 2001; 1:9–11. 10. Glauser R, Lundgren AK, Gottlow J, et al. Immediate occlusal loading of Brånemark System® TiUnite implants placed predominantly in soft bone: 1-year results of a prospective clinical study. Clin Implant Dent Relat Res 2002. 11. Vanden Bogaerde L, Pedretti G, Dellacasa P, Mozzati M, Rangert B. Early function of splinted implants in maxillas and posterior mandibles using Brånemark System® machined-surface implants: an 18-month prospective clinical multicenter study. Clin Impl Dent Relat Res 2003; 5:21–28. 12. Abrahamsson I, Berglundh T, Linder E, Lang NP, Lindhe J. Early bone formation adjacent to rough and turned endosseous implant surfaces. An experimental study in the dog. Clin. Oral Impl. Res. 15, 2004; 381–392 13. Vanden Bogaerde L, Pedretti G, Dellacasa P, Mozzati M, Rangert B,Wendelhag I. Early function of splinted implants in maxillas and posterior mandibles, using Brånemark System® TiUnite™ implants: an 18-month prospective clinical multicenter study. Clin Oral Impl Res 2004; 6:121–129 14. Meredith N, Alleyne D, Cawley P. Quantitative determination of the stability of the implant-tissue interface using resonance frequency analysis. Clin oral Impl Rea 1996; 7: 261-269 15. Meredith N, Book K, Friberg B, Jemt T, Sennerby L. Resonance frequency measurements of implant stability in vivo. A cross-sectional and longitudinal study of resonance frequency measurements on implants in the edentulous and partially dentate maxilla. Clin Oral Impl Res 1997; 8: 226-233. 16. Barewal RM, Oates TW, Meredith N, Cochran DL. Resonance Frequency Measurements of Implant Stability in vivo on implants with a sandblasted and acid-etched surface. Int J Oral Maxilofac Implants 2003; 18: 641-651. 17. Portmann M, Glauser R. Report of a Case Receiving Full-Arch Rehabilitation in Both Jaws Using Immediate Implant Loading Protocols: A 1-Year Resonance Frequency Analysis Follow-Up. Clinical Implant Dentistry and Related Research, Volume 8, Number 1, 2006. 18. Han J, Lulic M, Lang NP. Factors influencing resonance frequency analysis assessed by Osstellt mentor during implant tissue integration: II. Implant surface modifications and implant diameter. Clin. Oral Impl. Res. 21, 2010; 605–611. 19. Vanden Bogaerde L, Pedretti G, Sennerby L, Meredith N. Immediate/Early Function of Neoss Implants Placed in Maxillas and Posterior Mandibles: An 18-Month Prospective Case Series Study. Clinical Implant Dentistry and Related Research 2010; 12, suppl 1: 83-94. 20. Vanden Bogaerde L, Rangert B, Wendelhag I. Immediate early function of Brånemark System® TiUnite™ implants in fresh extraction sockets in maxillae and posterior mandibles: an 18-month prospective clinical study. Clin Implant Dent Relat Res 2005; 7 (Suppl 1):121–130. 21. Turkyilmaz I, Sennerby L, Yilmaz B, Bilecenoglu B, Ozbek EN.. Influence of Defect Depth on Resonance Frequency Analysis and Insertion Torque Values for Implants Placed in Fresh Extraction Sockets: A Human Cadaver Study. Clin Impl Dent Relat Res 2009: 11: 52-58. RIGENERAZIONE OSSEA GUIDATA 22. Albrektsson, T., Branemark, P.-I., Hansson, H.A. & Lindstrom, J. (1981) Osseointegrated titanium implants. Requirements for ensuring a longlasting direct bone anchorage inman. Acta Orthopaedica Scandinavica 52: 155–170. 23. Adell, R., Lekholm, U., Rockeler, B. & Bra°nemark, P.-I. (1981) A 15-year study of osseointegrated implants in the treatment of the edentulous jaw. The International Journal of Oral Surgery 10: 387–416. 24. Lekholm, U., Adell, R. &Lindhe, J. (1986) Marginal tissue reactions at osseointegrated titanium fixtures. A cross-sectional retrospective study. The International Journal of Oral and Maxillofacial Surgery 15: 53–61. 25. Dahlin, C., Sennerby, L., Lekholm, U., Linde, A. & Nyman, S. (1989) Generation of new bone around titanium implants using a membrane technique: an experimental study in rabbits. The International Journal of Oral & Maxillofacial Implants 4: 19–25. 26. Kostopoulos, L. & Karring, T. (1994) Augmentation of the rat mandible using guided tissue regeneration. Clinical Oral Implants Research 5: 75–82. 27. Nyman, S.R. & Lang, N.P. (1994) Guided tissue regeneration and dental implants. Periodontology 2000 4: 109–118. 28. Hammerle, C.H.F., Schmid, J., Olah, A.J. & Lang, N.P. (1996) A novelmodel systemfor the study of experimental bone formation in humans. Clinical Oral Implants Research 7: 38–47. 29. Nyman S, Lindhe J, Karring T, Rylander H. New attachment following surgical treatment of human periodontal disease. J Clin Periodontol 1982; 9:290-6. 30. Nyman S, Gottlow J, Karring T, Lindhe J. The regenerative potential of the periodontal ligament. An experimental study in the monkey. J Clin Periodontol 1982; 9: 157-265. 31. Gottlow J, Nyman S, Karring T, Lindhe J. new attachment formation as a result of controlled tissue regeneration. J Clin Periodontol 1984; 11: 494-503. 32. Becker, W., Becker, B., Handelsman, M., Ochsenbein, C. & Albrektsson, T. (1991) Guided tissue regeneration for implants placed into extraction sockets: a study in dogs. Journal of Periodontology 62: 703–709. 33. Dahlin, C., Lekholm, U., Becker, W., Becker, B., Higuchi, K., Callens, A. & van Steenberghe, D.(1995) Treatment of fenestration and dehiscence bone defects around oral implants using the guided tissue regeneration technique: a prospective multicenter study. The InternationalJournal of Oral & Maxillofacial Implants 10: 312–318. 34. Bragger, U., Hammerle, C.H.F. & Lang, N.P. (1997) Immediate transmucosal implants using the principle of guided tissue regeneration. II. A crosssectional study comparing the clinical outcome 1 year after immediate to standard implant placement. Clinical Oral Implants Research 7: 268–276. 35. Simion, M., Jovanovic, S.A., Tinti,C. & Benfenati, S.P. (2001) Long-term evaluation of osseointegrated implants inserted at the time or after vertical ridge augmentation A retrospective study on 123 implants with 1–5 years follow-up. Clinical Oral Implants Research 12: 35–45. 36. Buser, D., Bra¨gger, U., Lang, N.P. & Nyman, S. (1990) Regeneration and enlargement of jaw bone using guided tissue regeneration. Clinical Oral Implants Research 1: 22–32. 37. Nyman, S., Lang, N.P., Buser, D. & Bra¨gger, U. (1990) Bone regeneration adjacent to titanium dental implants using guided tissue regeneration. A report of 2 cases. The International Journal of Oral & Maxillofacial Implants 5: 9–14. 38. Hammerle, C.H.F., Jung, R.E., Yaman, D. & Lang, N.P. (2007) Ridge augmentation by applying bioresorbable membranes and deproteinized bovine bone material. A report of 12 consecutive cases. Clinical Oral Implants Research 19: 19–25. 39. Benic´ GI, Jung RE, Siegenthaler DW, Ha¨mmerle CHF. Clinical and radiographic comparison of implants in regenerated or native bone: 5-year results. Clin. Oral Impl. Res. 20, 2009; 507–513 40. Vanden Bogaerde L. A proposal for the classification of bony defects adjacent to dental implants. Int J Periodontics Restorative Dent 2004; 24: 264-271 41. Akimoto K, Becker W, Persson R, Baker DA, Rohrer MD, O’Neal RB. Evaluation of titanium implants placed into simulated extraction sockets: a study in dogs. Int J Oral Maxillofac Implants 1999; 14:351–360. 42. Gelb DA. Immediate implant surgery: three-year retrospective evaluation of 50 consecutive cases. Int J Oral Maxillofac Implants 1993; 8: 388-399. 43. de Oliveira RC, Oliveira FHG de, Cestari TM, Taga R, Granjeiro JM. Morphometric evaluation of the repair of critical-size defects using demineralized bovine bone and autogenous bone grafts in rat calvaria. Clin. Oral Impl. Res. 19, 2008; 749–754. 44. Bornstein MM, Chappuis V, von Arx T, Buser D. Performance of dental implants after staged sinus floor elevation procedures: 5-year results of a prospective study in partially edentulous patients. Clin. Oral Impl. Res. 19, 2008; 1034–1043 45. Nkenke E, Stelzle F. Clinical outcomes of sinus floor augmentation for implant placement using autogenous bone or bone substitutes: a systematic review. Clin. Oral Impl. Res. 20 (Suppl. 4), 2009; 124–133. 46. Mordenfeld A, Hallman M, Johansson CB, Albrektsson T. Histological and histomorphometrical analyses of biopsies harvested 11 years after maxillary sinus floor augmentation with deproteinized bovine and autogenous bone. Clin. Oral Impl. Res. 21, 2010; 961–970. IL TRATTAMENTO DEI SITI POST ESTRATTIVI 47. Schropp L, Wenzel A, Kostopoulos L, Karring T. Bone healing and soft tissue contour changes following single-tooth extraction: a clinical and radiographic 12-month prospective study. Int J Periodontics Restorative Dent 2003; 23: 313-323. 48. Araujo MG, Lindhe J. Ridge alterations following tooth extraction with and without flap elevation. An experimental study in the dog. Clin. Oral Impl. Res. 20, 2009; 545–549 49. Fickl S, Zuhr O, Wachtel H, Bolz W, Huerzeler MB. Hard tissue alterations after socket preservation: an experimental study in the beagle dog. Clin. Oral Impl. Res. 19, 2008; 1111–1118 50. Covani U, Ricci M, Bozzolo G, Mangano F, Zini A, Barone A. Analysis of the pattern of the alveolar ridge remodelling following single tooth extraction. Clin. Oral Impl. Res. 22, 2011; 820–825. 51. Araujo MG, Lindhe J. Ridge preservation with the use of Bio-Oss collagen: a 6-month study in the dog. Clin. Oral Impl. Res. 20, 2009; 433–440. 52. Santos FA, Pochapski MT, Martins MC, Zenóbio EG, Spolidoro LC, Marcantonio E. Comparison of Biomaterial Implants in the Dental Socket: Histological Analysis in Dogs. Clin Impl Dent Relat Res 2010; 12: 18-25. 53. Botticelli D, Renzi A, Lindhe J, Berglundh T. Implants in fresh extraction sockets: a prospective 5-year followup clinical study. Clin. Oral Impl. Res. 19, 2008; 1226–1232 54. Paolantonio, M., Dolci,M., Scarano, A., d’Archivio, D., Placido, G., Tumini, V. & Piatelli, A. (2001) Immediate implantation in fresh extraction sockets. A controlled clinical and histological study in man. Journal of Periodontology 72: 1560–1571. 55. Botticelli, D., Berglundh, T. & Lindhe, J. (2004) Hard-tissue alterations following immediate implant placement in extraction sites. Journal of Clinical Periodontology 31: 820–828. 56. Araujo,M.G. & Lindhe, J. (2005) Dimensional ridge alterations following tooth extraction. An experimental study in the dog. Journal of Clinical Periodontology 32: 212–218. 57. Sanz M, Cecchinato D, Ferrus J, Pjetursson EB, Lang NP, Jan L. A prospective, randomized-controlled clinical trial to evaluate bone preservation using implants with different geometry placed into extraction sockets in the maxilla. Clin. Oral Impl. Res. 21, 2010; 13–21. 58. Botticelli, D., Persson, L.G., Lindhe, J. & Berglundh, T. (2006) Bone tissue formation adjacent to implants placed in fresh extraction sockets: an experimental study in dogs. Clinical Oral Implants Research 17: 351–358. 59. Caneva M, Salata LA, de Souza SS, Bressan E, Botticelli D, Lang NP. Hard tissue formation adjacent to implants of various size and configuration immediately placed into extraction sockets: an experimental study in dogs. Clin. Oral Impl. Res. 21, 2010; 885–890. 60. Caneva M, Salata LA, de Souza SS, Baffone G, Lang NP, Botticelli D. Influence of implant positioning in extraction sockets on osseointegration: histomorphometric analyses in dogs. Clin. Oral Impl. Res. 21, 2010; 43–49. 61. Blanco J, Mareque S, Linares A, Munoz F. Vertical and horizontal ridge alterations after tooth extraction in the dog: flap vs. flapless surgery. Clin. Oral Impl. Res. 22, 2011; 1255–1258. 62. Fickl, S., Zuhr, O., Wachtel, H., Stappert, C.F.J., Stein, J.M. & Hu¨ rzeler, M.B. (2008) Tissue alterations after tooth extraction with and without surgical trauma: a volumetric study in the beagle dog. Journal of Clinical Periodontology 35: 356–363. 63. De Boever AL, Quirynen M, Coucke W, Theuniers G, De Boever JA. Clinical and radiographic study of implant treatment outcome in periodontally susceptible and nonsusceptible patients: a prospective long-term study. Clin. Oral Impl. Res. 20, 2009; 1341–1350. 64. Matarasso S, Rasperini G, Iorio Siciliano V, Salvi GE, Lang NP, Aglietta M. A 10-year retrospective analysis of radiographic bone-level changes of implants supporting single-unit crowns in periodontally compromised vs. periodontally healthy patients. Clin. Oral Impl. Res. 21, 2010; 898–903.